

基于微流控的血管芯片来模拟人体血管内部剪切力分布状况
描述
结肠癌是世界上最常见的癌症之一,其发病率和病死率较高,严重威胁着人类的健康。红细胞分布宽度(red blood cell distribution width,RDW)是反映红细胞(red blood cell,RBC)体积大小变异性的标准全血细胞计数测试参数,是对RBC异质性检测的客观指标。近年来,越来越多的研究发现RDW与癌症总体死亡率关,因而在一定程度上可以预测癌症患者的死亡风险,能够作为癌症患者住院后短期死亡率的独立预后指标。因此,模拟血管内部情况并研究RDW的特征对于结肠癌早期诊断及转移过程的作用机制研究具有重要意义。毛细血管占据人体内血管的90%以上,且红细胞的直径和毛细血管的直径具有相同的数量级(微米级别),因此毛细血管流量对红细胞流变特性具有显著影响。
据麦姆斯咨询报道,基于此,来自郑州大学第一附属医院的陈冰等设计了一种基于微流控的血管芯片,可用来模拟人体血管(尤其是毛细血管)内部剪切力分布状况,相关研究成果发表在期刊《微纳电子技术》上。
首先,研究人员采用COMSOL软件对微流控血管芯片进行了功能验证和尺寸优化。COMSOL软件仿真步骤如图1所示。然后将L-Edit16软件绘制好的芯片结构导出为GDS的格式文件,并将芯片上的图案转移到微流控芯片母模上,具体步骤如下:首先利用DWL66激光直写系统对铬版上的光刻胶进行曝光,随后依次在显影液、去铬液以及去离子水中进行浸泡,制作成掩模版,并通过光刻机将掩模版的图案以光刻胶的形式转移到硅片上得到母模。接下来制作聚二甲基硅氧烷(PDMS)芯片,首先将硅片母模进行三甲基氯硅烷预处理,然后将PDMS预聚物和固化剂以10∶1的质量比充分混合,将其倒在硅烷化的母模晶片上,在85℃的烘箱中固化2h。将固化后的PDMS层进行打孔以形成入口/出口。PDMS的厚度约为3mm,适合固定插入的管子。通过氧等离子体处理将PDMS复制品永久粘合到盖玻片上。实验中使用的Ag/AgCL电极是通过将Ag丝放入KCL溶液中,以Pt为参比电极,在Ag丝面沉积涂覆AgCL制成的。将制作好的Ag/AgCL电极依次用异丙醇和去离子水进行清洗,用针在进样管和出样管侧壁的位置各扎一个小孔,然后将清洗完成的Ag/AgCL电极从进样管和出样管的扎孔位置穿入,另一端连接到电压放大器(德国FEM TO公司)进行信号测量。
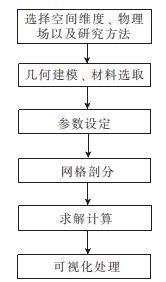
图1 COMSOL软件仿真步骤
接着,研究人员基于人体血管的形态,充分考虑了血管内部细胞流速和剪切力实际情况,构建了基于微流控的血管芯片模型。为了模拟血管里的剪切力变化情况,设计了挤压芯片和分叉芯片两种血管芯片模型。挤压芯片模型如图2所示。该血管芯片包括一个入口和一个出口,其中入口用于通入细胞样品溶液,出口用于收集流出的废液。样品中存在一些无关的杂质,可能会导致微沟道堵塞等,从而影响实验结果。因此通过在入口处添加过滤器来阻挡这些杂质,过滤器的间隔为10μm。由于血管芯片的高度较低,出、入口的空腔跨度过大,会引起坍塌,因此在血管芯片出、入口设计了支柱。该挤压血管芯片中除了挤压区域的宽度(即俯视下沟道的宽度)和高度(三维中的厚度)不一样,其他区域的尺寸是一样的,从而可以用于研究挤压对红细胞的影响。该模型的微流控血管芯片挤压宽度为4、6、8、10、12和15μm,挤压次数为300、400、500、600、800、1000和1500。不同的挤压宽度和挤压次数会使剪切力有所不同,通过设置不同的挤压宽度和挤压次数来研究剪切力对RDW和红细胞变形性的影响。
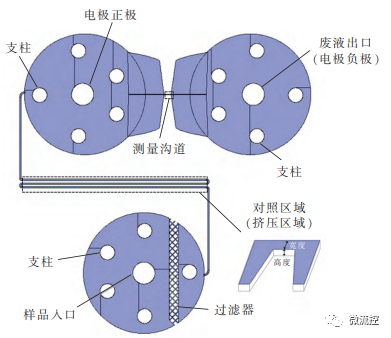
图2 挤压芯片模型
分叉芯片模型如图3所示,该血管芯片包括一个入口和一个出口,其中入口用于通入样品溶液,出口用于收集流出的废液。该分叉芯片同样设计了过滤器和支柱。此外,研究人员设计了分叉次数为8、16、32、64和128的微流控血管芯片来进行实验,研究分叉结构以及分叉次数对RDW和红细胞变形性的影响。
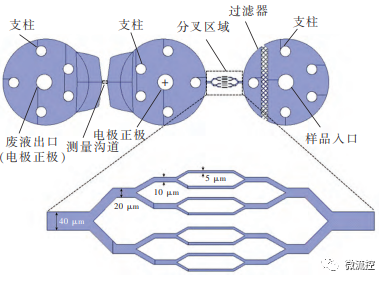
图3 分叉芯片模型
随后,研究人员探索了微流控芯片挤压宽度对RDW-CC和红细胞变形性的影响。实验中采用的微流控芯片挤压宽度分别为4、6、10和15μm,对照组的挤压宽度为20μm。微流控芯片的挤压次数为500次,实验条件完全一致,将样品瓶和恒压泵通过软管连接起来。微流控芯片入口先通入PBS排出芯片里的气泡,然后通入配置好的红细胞溶液。实验中,先将恒压泵的出口压力设置为0.002MPa,等待钢针端口缓慢地流出液体时,再将钢针插入微流控芯片的入口,然后将0.1MPa作为正负压恒压泵的出口压力,采用放大器对细胞产生的电信号进行采集并放大。然后利用NI6363采集卡进行A/D转换,最后用LabVIEW软件进行数据显示。实验结束后,把采集到的每种尺寸的电信号用Matlab程序进行处理。实验结果如图4所示,挤压次数为500时,挤压宽度由15μm变成4μm,RDW-CC值升高了0.0763,且红细胞的传输时间增加1.47ms,即挤压宽度越窄,RDW-CC值越大,红细胞的传输时间越长。

图4 不同挤压宽度的红细胞密度图和传输时间
为了验证微流控芯片挤压次数对RDW-CC值和红细胞变形性的影响,实验分别设置了500、800、1000和1500的芯片挤压次数,挤压宽度为15μm,实验条件完全一样。在同一挤压宽度(15μm)下,当挤压次数由500次变成1500次时,即增加了1000次时,RDW-CC值升高了0.0981,红细胞的传输时间增加了1.02ms,即挤压次数越多,RDW-CC值越大,红细胞的传输时间也越长,如图5所示。
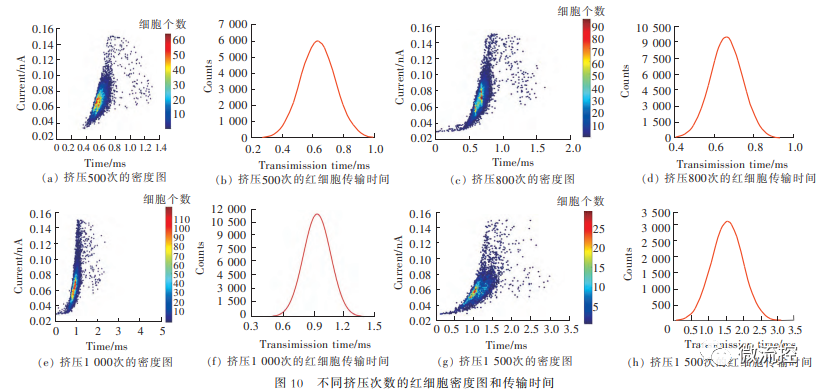
图5 不同挤压次数的红细胞密度图和传输时间
最后,实验还设计了分叉结构用于研究剪切力对RDW-CC值和红细胞变形性的影响,分叉次数依次为8、16、32、64和128。当分叉次数由8次变成128次时,即增加16倍时,RDW-CC值升高了0.0415,红细胞的传输时间增加1.2ms,即分叉次数越多,RDW-CC值越大,红细胞的传输时间越长(图6)。
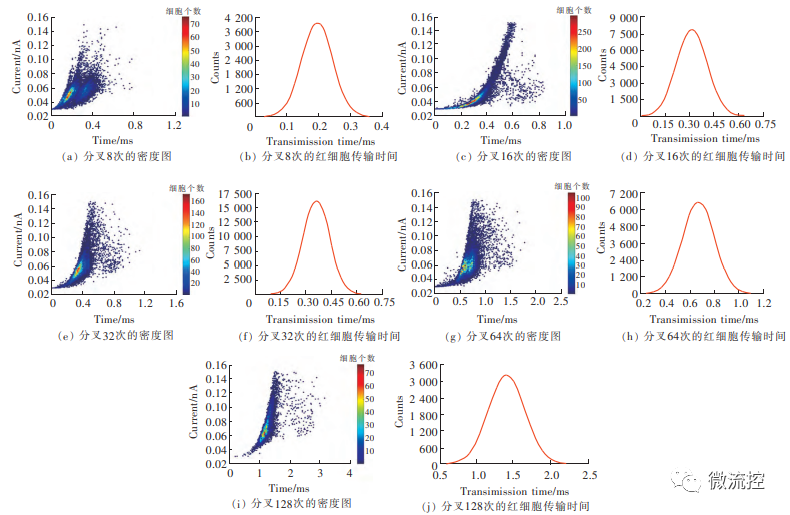
图6 不同分叉次数的红细胞密度图和传输时间
综上所述,研究人员提出了采用一种基于微流控的血管芯片来模拟人体血管内部剪切力分布状况,并研究了RDW变化。仿真结果表明微流控芯片内的流体分布符合预期。利用电脉冲的幅值和宽度对RBC的大小和可变形性进行表征,结果发现挤压宽度越窄、挤压次数越多、剪切力越大,则RDW表征参数(RDW-CC)值越大、RBC的传输时间越长;当分叉结构中分叉次数越多、剪切力越大,则RDW-CC值越大、RBC的传输时间越长。该方法不仅可用于RDW-CC的研究,也可用于其他血管模型的构建。
论文链接:
http://dx.doi.org/10.13250/j.cnki.wndz.2022.06.008
审核编辑 :李倩
-
【Aworks申请】血管介入手术训练机2015-07-06 0
-
血管介入手术器械运动控制系统2014-01-26 3797
-
东京大学研发血管芯片 有助开发抑制肿瘤血管新生药物2018-02-23 977
-
微流体系统模拟毛细血管帮助预测血管易堵塞程度2018-09-23 3070
-
机器人做神经血管内手术 可以作为远程中风干预的先驱2020-03-04 365
-
通过微流控系统来模拟并研究血管中的脉动剪切应力2022-09-06 1601
-
点成分享 | 微流控集成系统在人体血管研究中的应用2022-10-31 676
-
芯片微焊点剪切力推拉力机有哪些特点?如何操作?2023-01-05 720
-
一种基于微流控的血管芯片模型设计2023-03-09 1031
-
点成分享| 如何探究剪切力在细胞层面的影响?微流控芯片来帮你2021-09-15 1012
-
血管内超声(IVUS)成像系统在心血管疾病评估中的作用2023-09-08 1358
-
芯片剪切力测试机试验机推力速度2023-10-09 426
全部0条评论

快来发表一下你的评论吧 !

