

抗抗原变异交叉保护的H3N2流感微针疫苗的研制
描述
使用长度为100~1,000μm的微针可以将疫苗等具有大分子量的活性成分,无痛地通过角质层,并且可以递送到真皮层。由于真皮层内存在免疫细胞,因此研究人员已积极研究如何使用微针递送疫苗。目前,流感微针(MN)疫苗已进入临床前和临床研究阶段,且相关研究已发现,其与肌肉注射(IM)给药可以达到相似的免疫功效。
据麦姆斯咨询报道,近期,韩国嘉泉大学生物纳米技术系的研究人员开发了一种可实现抗原变体交叉保护的H3N2微针疫苗,相关研究成果以“Development of the H3N2 influenza microneedle vaccine for cross-protection against antigenic variants”为题发表于Scientific Reports期刊上。
由于H3N2病毒具有不断变异的特性,因此研究人员在制备H3N2微针疫苗时考虑了两个方面:(1)快速制备;(2)针对多种抗原变体的交叉保护。在过去的研究中,测量血凝素(HA)含量的方法需要标准抗体,但由于标准抗体的缺乏,往往无法实现针对突变型H3N2病毒的微针疫苗的快速制备。在这项研究中,研究人员通过高效液相色谱(HPLC)进行H3N2微针疫苗的制备,该方法不使用抗体,且制备获得的疫苗可产生针对多种抗原变体的交叉保护。
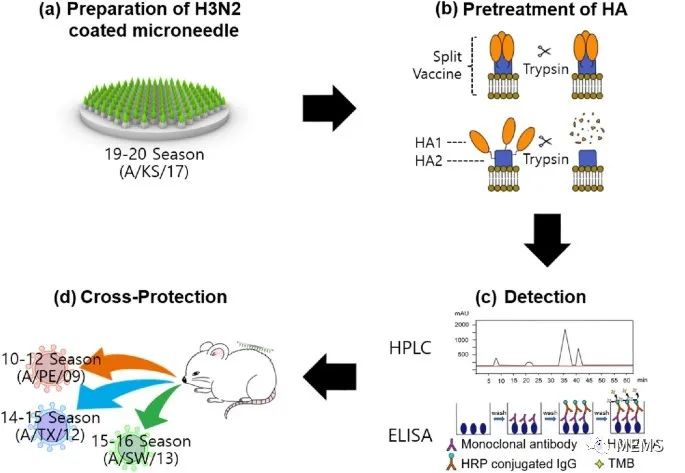
图1 基于HA的HPLC分析用于H3N2流感病毒交叉保护的H3N2微针疫苗开发示意图

图2 H3N2涂层微针示意图
利用FITC标记的葡聚糖作为模型药物,研究人员在猪皮上对制备获得的H3N2微针疫苗进行体外药物递送实验。在初始给药后15至330分钟观察到荧光强度分布高于预设的阈值强度(图3a),且微针表面荧光强度随时间变化而变化(图3b)。在初次给药后30至60分钟之间下降最为剧烈,给药210分钟后,大多数荧光信号即检测不到。此外,FITC-葡聚糖的扩散速率受涂层从固体层溶解到凝胶然后变成液体溶液的阶段的影响。随着涂层溶解的进行,FITC-葡聚糖在几个小时内缓慢地扩散到猪皮中。
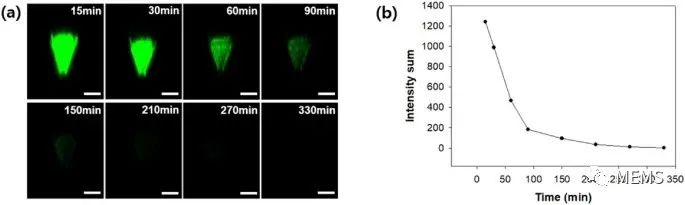
图3 (a)共聚焦显微镜在15、30、60、90、150、210、270和330分钟时观察到的微针表面荧光图像(比例尺 = 200μm);(b)从15到330分钟,微针尖端表面的荧光强度变化。
接着,研究人员利用几种不同的抗原变体,对H3N2微针疫苗的体内交叉保护功效进行了评估。通过监测体重变化和存活率,研究了19-20A/KS/17H3N2微针疫苗对感染2015-16季节性H3N2流感病毒的小鼠的交叉保护作用。将疫苗分别接种于两组小鼠,一组通过微针注射,另一组通过肌肉注射(IM)。结果发现两组的体内功效相似,并且两组的交叉保护功效也相似。
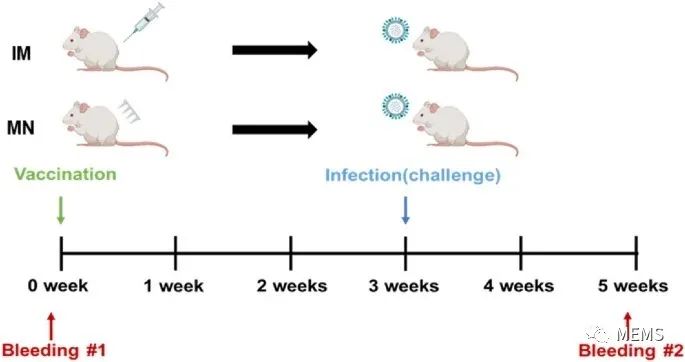
图4 小鼠体内实验时间轴。BALB/c小鼠用19-20A/KS/17H3N2微针疫苗(3μg/小鼠)皮内免疫或用疫苗制剂(3μg/小鼠)肌肉内免疫。在疫苗接种后3周,用鼠源性15-16A/SW/13 H3N2病毒感染小鼠。
图5 (a)用鼠源性15-16A/SW/13 H3N2病毒感染后,监测小鼠14天的体重变化和(b)存活率;(c)分别感染A/PE/09 H3N2、A/TX/12 H3N2和A/SW/13 H3N2病毒14天后,19-20A/KS/17 H3N2疫苗微针接种小组和IM接种小组的小鼠血清的中和抗体滴度。(d)分别感染A/PE/09 H3N2、A/TX/12 H3N2和A/SW/13 H3N2病毒14天后,19-20 A/KS/17 H3N2疫苗微针接种小组和IM接种小组小鼠体内血凝抑制(HI)滴度。
总体而言,使用HPLC可能被证明是快速制备季节性H3N2流感微针疫苗的有效方法,也是对抗抗原变体的替代解决方案。
论文链接:
https://doi.org/10.1038/s41598-022-16365-2
审核编辑 :李倩
- 相关推荐
- 微针技术
-
对于疫苗事件你怎么看?2016-03-24 0
-
新版疫苗管理条例开始施行2016-04-26 0
-
恒流驱动电流感测2019-04-30 0
-
雨季防雷保护基本措施2020-08-20 0
-
H3芯片开发板是如何对交叉编译工具链进行下载的2021-12-27 0
-
迎战流感 奥普研制一秒测体温红外耳温枪2009-12-03 598
-
基于数据竞争故障的变异策略2017-12-09 745
-
如何利用近红外光谱技术提高流感疫苗生产效率?2018-10-17 1949
-
人工智能如何应对流感季2019-07-11 330
-
应用AI和机器学习来了解流感2020-04-23 1255
-
悉尼大学正在测试一种可替代传统疫苗接种的方式2020-12-01 1341
-
音圈模组3D打印的疫苗贴片2021-10-12 363
-
抗原检测试剂盒自动装配解决方案2022-05-20 1287
-
如何提高抗原检测试剂盒的产能2022-06-27 594
-
如何对不同主接线下CT保护范围交叉检查2023-10-27 156
全部0条评论

快来发表一下你的评论吧 !

