

一种双CRISPR/Cas12a辅助的逆转录-重组酶介导扩增(RT-RAA)检测方法
描述
短时间内进行大量新冠病毒检测是控制新冠病毒传播的关键之一,发展可现场诊断的检测设备有利于促进新冠肺炎的早期干预和治疗,并有效降低疾病传播风险。重组酶聚合酶扩增(RPA)以及重组酶介导扩增(Recombinase aided amplification,RAA)因其快速、简便、等温而成为现场诊断的首选扩增技术,但可能存在非特异性扩增的假阳性问题。规律成簇的间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)具有良好的特异性和可靠性。RPA与CRISPR的结合可以兼具灵敏度和特异性,在开发下一代POCT分子诊断技术方面具有广阔前景。然而,目前大多数CRISPR/Cas辅助RPA方法包含前扩增子的转移和多种人工操作,使测试过程复杂化,增加了污染风险,而少数一锅法的反应又需要较长的反应时间。
近期,南方科技大学的研究人员开发了一种双CRISPR/Cas12a辅助的逆转录-重组酶介导扩增(RT-RAA)检测方法和“样本进-结果出”的离心微流控平台,该平台可在30min内自动检测1拷贝/μL的新冠病毒(SARS-CoV-2),具有一步、自动化、快速和灵敏的优点,在临床诊断和疾病预防方面具有重大潜力。相关研究成果以“Dual-CRISPR/Cas12a-Assisted RT-RAA for Ultrasensitive SARS-CoV‑2 Detection on Automated Centrifugal Microfluidics”为题发表于Analytical Chemistry期刊。

该基于双CRISPR/Cas12a辅助的RT-RAA的自动化微流控平台操作流程和工作原理如图1所示,RT-RAA和CRISPR/Cas12a试剂分别通过冷冻干燥的方式预装入扩增室和检测室进行长期保存。操作人员只需加入核酸样品溶液,并将芯片放置在相应的检测仪器上,即可在30分钟内自动完成扩增-检测-报告流程。针对新冠病毒的E基因序列设计RT-RAA引物、Cas12a-crRNA序列,并引入标记FAM和BHQ-1的单链核酸报告序列。由于两个crRNA识别不同的位点,每个扩增子都可以激活两个CRISPR/Cas复合物,此双活性复合物显著提高了ssDNA-FQ报告基因的切割率,更有利于低浓度模板RNA的RT-RAA系统的检测。
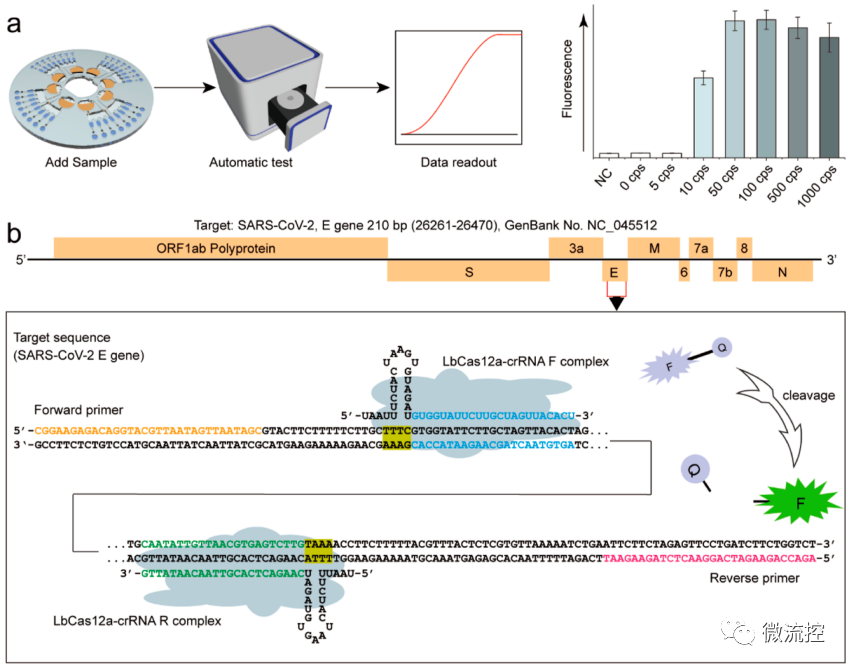
图1 CRISPR/Cas12a辅助的RT-RAA的超敏检测SARS-CoV-2的自动化离心微流控平台
研究人员首先验证了基于双CRISPR/Cas12a辅助的RT-RAA系统的可行性和灵敏度。引入CRISPR/Cas12后,可见空白组非特异性荧光信号明显降低。相较于单一crRNA,双crRNA策略的荧光信号最强,且实时荧光增长速度最高。此外,也通过凝胶电泳验证了双crRNA策略的可行性,如图2a所示,加入混合crRNA样品后,不仅生成了片段-F和片段-R,还生成了最短的片段-M。接着,研究人员采用无需开盖的一锅法测定该法的灵敏度(将CRISPR/Cas12a体系放在盖帽,RT-RAA体系放在管内),荧光成像和测定结果如图2b所示,该法可检测到低至约10个拷贝的SARS-CoV-2的E基因。
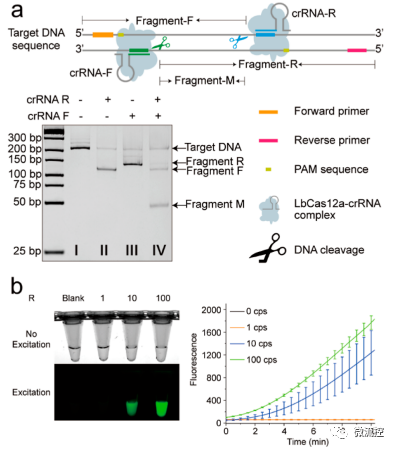
图2 双CRISPR/Cas12a法灵敏快速检测SARS-CoV-2
鉴于微流控平台在微尺度流体自动控制方面的优势,该研究将双CRISPR/Cas12a辅助的RT-RAA法引入微流控平台(图3)。该平台由三层组装而成,分别为注射层(1mm)、连接层(1mm)和反应层(2mm)。其中,进样层上的8个进样孔(Φ=1mm)与移液管的20μL完美贴合,出样孔(Φ=0.5mm)保证样本量顺利进入样品腔。连接层上的连接通道可以保持密封芯片内样品腔与预分配腔之间的压力平衡。反应层上的600μm宽通道可以保证样品在低转速800转/分钟时顺利进入放大腔。扩增室与检测室之间的100μm窄通道和毛细管阀可以防止低转速下的样品进入检测,只有在转速达到3000转/分钟时才能使样品进入检测室。该芯片可以同时进行32项测试,只需要两次样品转移和两步反应,可认为是一种低成本、直接检测的离心微流控平台。图4a-b显示了该微流控平台的采样过程、检测仪器和检测流程。此外,采用不同颜色清晰地显示不同阶段的流动状态,将CuSO₄和海藻糖/聚蔗糖的混合物通过冷冻干燥的方式预加载到芯片中(图4c)。当以800转/分钟低速旋转时,黄色酸性FeCl₃溶液(代表目标溶液)进入扩增室,变为绿色,蓝色检测室表示无液体进入检测室。而当转速提高到3000转/分钟时,溶液进入检测室并变为绿色,因此该芯片按照预期逐步完成样品转移。
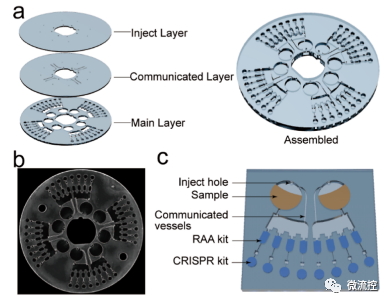
图3 离心微流控芯片的结构
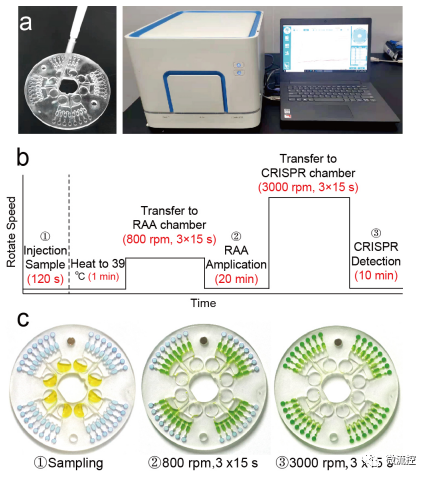
图4 离心微流控芯片的结构和自动化微流控平台的工作流程
接着,研究人员对该微流控平台的灵敏度进行了考察,如图5所示,该法的检出限为1拷贝/μL。此外,对34份SARS-CoV-2临床标本(26例阳性,8例阴性)进行了实际应用,采用商用RT-qPCR作为金标准,增加Orf1ab基因为补充靶基因增加检测的准确性,结果显示,对于阈值循环数(Ct)<30的RT-qPCR检测样品,CRISPR检测在10分钟内达到最大荧光信号,定义为“强阳性”样品;Ct>30的RT-PCR检测样品,CRISPR检测在10分钟后无法达到最大荧光,被定义为“弱阳性”样品。因此,该双CRISPR/Cas12a辅助RT-RAA微流控平台提供了一种直接、快速、自动化的方法,有潜力开发用于SARS-CoV-2检测的POCT诊断。
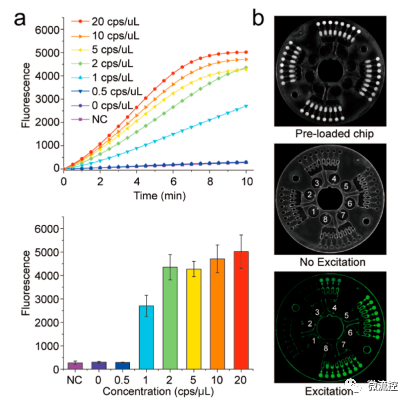
图5 基于双CRISPR/Cas12a辅助RT-RAA的自动微流控平台上检测SARS-CoV-2
综上所述,该研究提供了一种基于双CRISPR/Cas12a辅助RT-RAA微流控平台方法,实现了SARS-CoV-2快速、现场、自动化、超灵敏的检测要求,在开发下一代POCT分子诊断技术方面具有很大的潜力,可用于家庭或小型诊所的传染病快速检测。为了实现更好的实际应用,今后改进和发展方向如下:(1)通过注射成型的方法制作微流控芯片,满足定标需求;(2)优化冷冻干燥技术参数,延长芯片的存储时间;(3)将检测结果无线传输到网站或报告服务器,实现简单、快速、智能、互联的疾病诊断和跟踪;(4)同时检测和鉴别其他病毒感染,以实现有效的疾病治疗和管理等。
论文链接: https://pubs.acs.org/doi/10.1021/acs.analchem.2c00638
审核编辑 :李倩
-
如何采用一种标准的低成本双焊盘检测电阻实现高精度开尔文检测?2021-03-18 0
-
求一种新的双T型选频网络电路的设计方法2021-04-23 0
-
GUIDE-seq和Digenome-seq等全基因组CRISPR 检测的关键技术介绍2017-09-24 3143
-
一种应用于核酸超敏检测的CRISPR-Cas9链取代扩增技术2018-12-10 4727
-
中国科学家设计出一种用光控制基因编辑工具CRISPR-Cas92019-04-10 6663
-
Cas13a将该反应体系引入到电极电化学发光(pBPE-ECL)检测平台上2020-06-17 2540
-
英国推出“Nudgebox”和“LamPORE”两种新的新冠病毒检测法2020-09-01 1985
-
一种基于CRISRP技术的超灵敏、高通量COVID-19荧光诊断系统2021-02-23 3026
-
CRISPR诊断技术在不同领域的优势2022-09-26 1905
-
基于环介导等温扩增的纸基核酸快速检测2022-10-12 1384
-
基于CRISPR-Cas系统的新型电化学生物传感器2022-11-29 1309
-
基于CRISPR技术的高特异和高灵敏分子诊断方法CRISPR-Dx2022-12-01 1063
-
无标记阻抗免疫传感器,用于新冠病毒抗体即时检测2023-01-12 1054
全部0条评论

快来发表一下你的评论吧 !

