

讨论高压锂离子电池的老化机理及电解质设计策略
锂电池
描述
一、背景介绍
为了实现锂离子电池中更高的能量密度,工业界和学术界对开发高压LIBs(>4.3 V)表现出极大兴趣。然而,增加商用锂离子电池的充电截止电压会导致正极材料和传统的LiPF6有机碳酸酯电解质的严重退化。
因此,使用传统的LiPF6有机碳酸盐电解质的锂离子电池在较高的充电截止电压下工作循环寿命较短。本文综述了高压锂离子电池的老化机理,并对电解质设计策略进行了讨论。
二、正文部分
01 成果简介
美国太平洋西北国家实验室首席科学家许武及博士后贾灏在知名国际期刊Trends in Chemistry 发表了“Electrolytes for high-voltage lithium batteries”为题的综述性文章,系统的介绍了提升上截止电压是如何引起锂离子电池的老化加剧以及如何通过电解质抑制老化过程(本文定义高压为上截止电压>4.3V)。这项工作得到了美国能源部(DOE)汽车技术办公室负责能源效率和可再生能源的助理部长的支持,通过先进电池材料研究(BMR)项目。
02 研究亮点
1、高电压下电解质、正极材料的分解和正负极之间的串扰通过电解质变得更加严重,导致电池寿命大幅度缩短以及引发安全担忧。因为很多老化过程源于电解质,设计高压条件下兼容的电解质是延长电池寿命的主要途径。
2、其中最有效且经济的方法是通过在电解质中引入CEI添加剂改善正极电解质界面(CEI),因为有效的CEI可以显著抑制电解质分解动力学。
3、用更稳定的锂盐和溶剂替换当前的电解质体系锂盐和溶剂,调整电解质中的溶剂化结构可以显著提高电解质的化学和电化学稳定性,这可以有效缓解电解质分解和正极材料结构降解。
4、可以通过设计过渡金属清除电解质来有效阻断正极和负极之间的有害串扰。
03 图文导读
(1)提升锂电池工作电压的动机
随着电动汽车发展,对电池能量密度需求显著增加。除了使用高比容量的活性电极材料如正极富镍层状氧化物和负极硅、锂金属,另一种不从根本上改变其制造基础结构情况下增强锂离子电池能量密度可行的方法是提高锂离子电池的截止电压。
以商业锂电中最常见的Gr||LiNixMnyCo1-x-yO2为例,提升上截止电压不仅增加工作平均电压,也增加电池的比容量,这是因为更多的Li参与了充放电循环。这两种方法都增加了锂电的能量密度,但通过提高电压增加能量密度是以加剧老化问题为代价,从而显著缩短了循环寿命。
(2)高电压引发的挑战
提高上截止电压,老化过程(如电解质阳极分解、阳离子混排和正极材料内重建、释氧、正极粒子内部和粒子之间开裂以及过渡金属溶解迁移沉淀)变得更加严重,本节将简要讨论在高上截止电压下的老化过程。
1)电解质负极分解
在较高的上截止电压下,电解质分解的恶化主要是由两个因素驱动的:电解质的阳极稳定性不足和正极材料表面的化学反应催化作用。
传统的LiPF6-有机碳酸盐电解质通常由1.0-1.2mol/L的 LiPF6盐溶解在碳酸乙烯(EC)、其他线状或环状有机碳酸盐以及功能性添加剂的混合物中组成。这种电解质系统是为在截止电压≤4.2V下工作的锂电设计和优化的。高压锂电中这种电解质的阳极稳定性往往是不够的。
在较高的电压下,正极材料中过渡金属的价态升高,其直接结果是,由于化学反应性催化表面的形成,常规电解质在正极表面的分解显著加速。还应该注意的是,电解质的阳极稳定性取决于与它搭配的正极材料。例如,据报道传统的LiPF6碳酸盐电解质在尖晶石材料上是稳定的,如LNMO可达5.2 V;然而,在高镍层状正极上即使在4.4 V也是不稳定的。
传统电解质中,EC和PF6-最容易发生阳极分解的两个组分当电解质分解,分解产物在正极材料上形成了一个钝化层,这通常被称为CEI。尽管CEI会抑制电解质的持续分解,但通过传统LiPF6-有机碳酸盐电解质形成的CEI不能在长循环中提供有效的保护,从而缩短了高压锂电循环寿命。
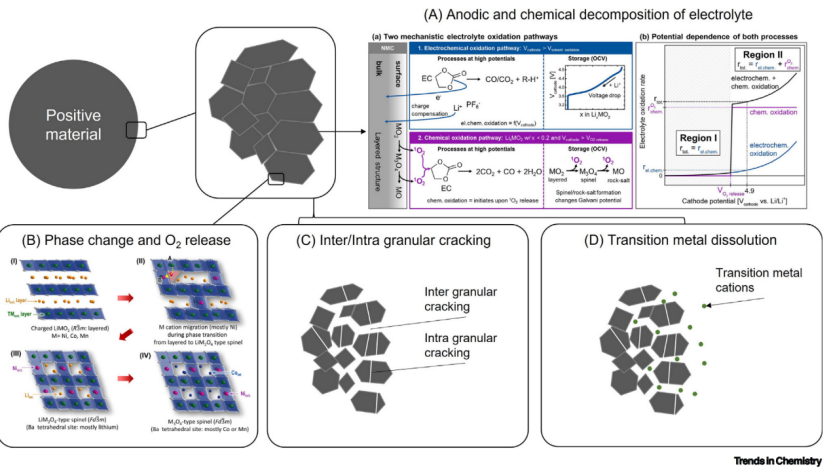
图1工作电压升高时老化过程显著加速。(A)电解质的阳极分解。(B)阳离子混合、结构重建和释氧。 (C)间/内微裂纹氧释放。(D)过渡金属的溶解。
2)正极阳离子混排、相变和氧释放
阳离子混排的定义是过渡金属阳离子和锂离子在正极材料晶格中自发的转位。材料中阳离子混排的积累如NMC会导致从层状结构到岩盐结构的相转变,因为后者离子电导明显低于前者,正极材料相变对锂离子电池的动力学是有害的。阳离子混排主要是由正极材料固有的结构特性;然而,它也可以被正极材料和电解质之间的相互作用显著影响。此外,结构的转变也会导致正极材料氧释放,这不仅加速电解质分解,也会提高锂离子电池安全隐患。
3)晶间/晶内微裂纹和氧气生成
当电压升高,更多的锂离子从正极晶格迁移,引起了正极材料体积缩减。由于一次颗粒各向异性的体积减小,在一次粒子晶格间形成了微裂纹。因此,单晶正极材料的晶间开裂受到越来越多的关注。然而,在较高的上截止电压下,一次粒子或单晶粒子内部也会产生晶内开裂。
当在高电压下更多的锂离子从晶格间迁移,晶格的金属氧化物平面变得松散。因为氧原子的静电排斥力没有被过渡金属氧化物平面之间的足够的带正电的Li离子有效地缓解,所以发生了正极材料的平面滑动,其累积导致材料的晶内微裂纹(图1C)。正极材料中微裂纹的形成导致新鲜的表面暴露在电解质中,导致电解质过度分解和过渡金属溶解(图1A、D)
4)过渡金属阳离子溶解和迁移
过渡金属溶解是另一种易受LIBs工作电压影响的老化机制。在较高的电荷截止电压下,正极材料会不稳定,使材料更容易受到电解质的化学和电化学浸出(图1D)。
过渡金属阳离子的溶解只导致正极材料的轻微或可忽略的容量损失。然而,一旦溶解的过渡金属阳离子通过电解质迁移并沉积在负极上,会导致锂离子电池严重的电化学性能退化,因为即使在负极固体电解质间相(SEI)存在微量的过渡金属阳离子也会导致阻抗显著增加。
如果负极是金属Li,SEI中过渡金属的不利影响会变得更加明显,因为阻抗的增加导致高表面积Li的形成,从而导致电解质消耗过多,活性Li损失,甚至“翻车”失效。
(3)电解液设计策略
目的主要是针对机械老化中正极和电解质之间的相互影响和正负极之间通过电解液的互相影响,设计主要是:1.抑制电解质和正极之间相互作用的有害动力学2.加强电解质固有的电化学和化学稳定性;3.阻断正负极通过电解质的串扰。
1) 抑制电解液和电极之间有害的相互作用动力学
最常用的方法是在正极表面原位形成有效的CEI。理想的CEI除了对于正极保持化学和电化学稳定,绝缘电子传导离子,因此对于正极和电解液之间副反应构建充电壁垒确保电解液在高压下的暂时稳定状态,这里主要介绍两种抑制方法。
·lCEI形成添加剂
在传统电解质中引入形成CEI的添加剂可以有效、经济地提高CEI的品质。CEI添加剂是一种化合物,在形成循环过程中可以在正极上优先氧化,以调节CEI的组成、结构和性质。
因为最高占据分子轨道(HOMO)能量反映了一种化学物质的失去电子的能力,因此它是氧化/阳极稳定的,HOMO能量已被广泛用于半经验筛选适当的CEI添加剂。根据其组成,常见的CEI添加剂可分为两大类:有机分子型添加剂(共价添加剂)和盐型添加剂(或离子添加剂)有机添加剂一般是由以F、P、Si、N、B、S和这些的混合为基础的小有机分子。
本文总结了一些常见的高压锂离子有机分子添加剂的化学结构如表1。有机分子型添加剂一个一般的设计原则是的降低分子阳极稳定性,这样它们就可以在正极上被优先分解同时可以提高CEI的特性。常见方法包括:形成环状结构、结合不饱和键、降低中心原子的氧化态、引入高电子密度的官能团和相对不稳定的键。
如通过2,4,6-三苯基硼酸(TPBX),其开环反应可以被优先分解。在长期循环性能评估中,含TPBX电解质形成的CEI不仅具有较高的离子电导率,而且生长速度也较慢(图2A)。与TPBX相似,其他CEI添加剂提高高压锂离子电池循环性能也是通过牺牲分解形成紧凑和稳定的CEIs的循环性能。其他功能也可以集成到CEI形成的添加剂中。
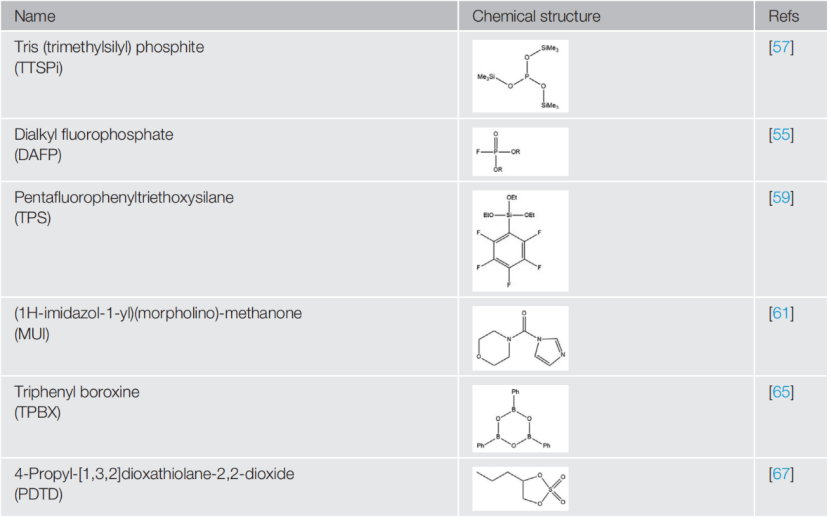
表1 种有机分子基CEI形成添加剂的化学结构
另一个主要分类形成CEI添加剂盐型添加剂,考虑到他们是带负电,如果他们设计合理阴离子在正极表面上优先被氧化。常规盐型CEI添加剂如表2,这些盐形成CEI的机制并不相同,但通常要优于无添加剂。
如LiDFP通过直接参与CEI的形成可有效延长锂离子电池高电压下的循环寿命,研究表明其主要优势在于:比无添加剂形成CEI更能抑制阳极分解,更进一步抑制了正极中过度金属的分解。
机理研究表明,含LiDFP的电解质形成的CEI有两个主要优势:(i) LiDFP参与的CEI比无添加的电解质更有效地抑制其阳极分解(ii)其参与生成的CEI可抑制正极材料的过渡金属溶解(图2B)。
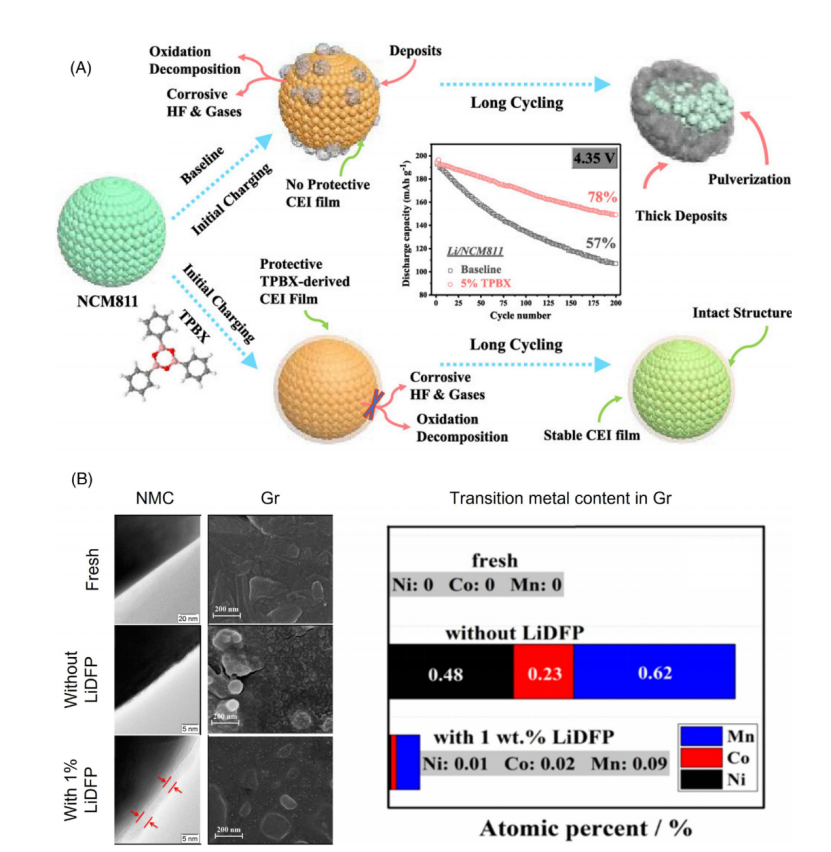
图2 阴极电解液CEI形成添加剂的工作机理(A)2,4,6-triphenyl boroxine(TPBX)(B)Lithium difluorophosphate(LiDFP)
但Mg(TFSI)2的作用机制较为特殊。据Wagner研究,除了直接参与形成CEI,在传统电解液中也促进了LiPF6的分解。LiPf6二次分解的产物,主要是氟化磷酸盐,可以提高CEI性能,也就Mg(TFSI)2是是直接和间接参与调控CEI的组成。可以同时引入上述几种添加剂改善高压循环性能,因为在他们之间存在协同效应。由于Li和Gr的低电压窗口,许多添加剂可以在负极表面进行阴极分解,构成SEI,因此添加剂对于SEI和CEI的贡献要进一步研究。
·正极材料表面改性剂
另一种使正极与电解液相互作用危害减弱的方法是引入一种优先覆盖在正极材料表面的阳极稳定剂。这些添加剂不再在高电压被优先分解,而是扮演正极材料表面的调节剂。因此可以减缓正极和碳酸盐电解液直接相互作用。丁腈是其中一种,因为它的两个腈((-C≡N))基团可以与过渡金属阳离子形成稳定的复合物,这种在正极和电解液之间的复合物会阻止正极材料与电解液中的其他成分接触,同时这种SN阳极稳定剂也会保护自身以及电解液其他成分免于阳极分解,此外SN也被认为在正极材料上构成了液态CEI。最近研究表明SN是以牺牲分解方式保护正极,尽管还未有确切正极,但表面改性剂仍然是一个值得考虑的策略之一。
2)设计从本质阳极稳定的电解液
除了抑制电解液和正极之间有害的相互作用动力学,另一种有效的方法是延长高电压锂离子电池循环寿命加强固有阳极和电解液的化学稳定性。因此,电极和电解质的之间的副反应可以被有效的抑制当新的正极表面因为微裂纹被暴露在电解液中。这种加强电极液固有阳极稳定性的方法主要有三类:1)优化和改善常规电解质2)研究基于阳极稳定溶剂的电解质3)调节溶剂电解液溶剂化结构。
·常规环状碳酸盐电解质和线性碳酸盐电解质的优化与改性
EC被认为是商业化锂离子电池电解质必不可少的成分,因为可以在形成过程中通过自分解在碳负极上形成有效的SEI。但是最新研究表明,EC对高电压锂离子电池的循环和安全性能有害。因为它的环状结构,EC的不饱和度为1,当充电到截止电压提高到超过某个阈值容易受环的裂解反应影响。
这反映了在常规电解质中EC的分解通常伴随着P阴离子的分解,着加速了锂电老化过程,例如过渡金属的溶解、CEI变厚,因此电池的阻抗增加。为了解决上述问题,提出并评估了无EC的电解质,这种电解质由于缺少EC提高了阳极稳定性,极大的改善了高电压锂离子电池的循环寿命。这个发现表明传统电解质也可以被改善去匹配高电压锂离子电池。
·有机碳酸盐类溶剂的氟化反应
另一个提高电解质阳极稳定性是修饰溶剂的化学结构。由于它们的电负性最高,一旦形成化学键,F原子可以显著的减少临近原子的电子密度。因为低电子密度与好的氧化稳定有关,因此氟化作用被认为是一个加强商业化电解质溶剂阳极稳定性有效的方法。
根据这个原则,设计合成不同的氟化碳酸盐溶剂。按照Zhang等研究氟化有机碳酸盐分子具有高的理论阳极稳定性比非氟化有机碳酸盐分子。通过电化学漂浮试验,也对氟化碳酸酯阳极稳定性的改善进行了实验验证,用氟化碳酸盐电解质的Gr/LNMO电池的循环性能显著提升和一般的电解质相比。氟化碳酸盐溶剂另一个好处可燃降低,由于卤化阻燃的影响。
·基于替代阳极稳定溶剂的电解质
除了对传统LiPF6-有机碳酸盐电解质成分的改性,另一个加强电解质固有阳极稳定性的方法是用阳极稳定溶剂替代有机碳酸盐。应该注意的是高阳极稳定的溶剂也应当与负极兼容。腈类被认为是潜在的阳极溶剂稳定剂。然而,如上所述,它们在高压下很容易在正极材料表面分解,并且与负极较差的兼容性,腈类可能不是一个好的溶剂系统配制电解质用于高压锂电池。相比之下,砜类和室温离子液体(RTILs)更有前景替代溶剂。
砜类较好的阳极稳定性通过以活性正极作为工作电极的线性循环伏安扫描被证实。除了优异的阳极稳定性,某些砜类还表现出优异的SEI形成能力。例如,环丁砜可以形成可以与Gr电极形成有效的SEI,使得其具有前景可替代溶剂用于配制电解质应用于高压锂电中。
目前,砜类溶剂已经广泛应用于高压锂电电解液中。室温离子液体是另外一种重要的阳极稳定性溶剂分类, 然而,由于高粘性,低锂盐溶解度、价格高以及和负极相对较差的兼容性是阻碍其广泛在应用在高压锂电电解液。
·调节电解质的微观溶剂化结构
近年来研究表面,电解质的溶剂化结构对电解质阳极稳定性有巨大的影响。因此,高浓度的水、非水溶剂、聚合物以及局部高浓度电解质,已经成为具有前景的高压锂电电解质类。
在传统的LiPF6-有机碳酸盐电解质,存在相当一部分溶剂分子不参与锂离子的溶剂化。这些“游离”溶剂分子更容易被氧化比参与溶剂化的部分(图3A)。随着锂盐在电解质中的浓度的增加,这些“游离”溶剂分子将减少。如果盐浓度增加超过某一阈值,这些“游离”溶剂分子比例将下降到大约为0,这种电解质被归类为HCEs(图3B)。因为没有或者可以忽略的电解质中“游离”溶剂分子,电解质的阳极稳定性将有较大的提升。
LHCEs是HCEs的衍生物。通过引入可混合且不配位溶剂到HCE,HCE的溶剂化网络可以被分成较小的的溶剂-离子对和溶剂-离子团簇(图3C)。每个离子对和离子团簇可以被认为是HCE的微观“水滴”。与HCEs相似,在LHCEs没有或者可以忽略“游离”溶剂分子。因此与纯溶剂和“游离”溶剂存在的电解质相比HCEs和LHCEs都展现了显著阳极稳定性的提升。
另外,HCEs和LHCEs溶剂化结构都显著的提升了SEI和CEI的性能通过通过促进阴离子参与SEI和CEI的形成过程。
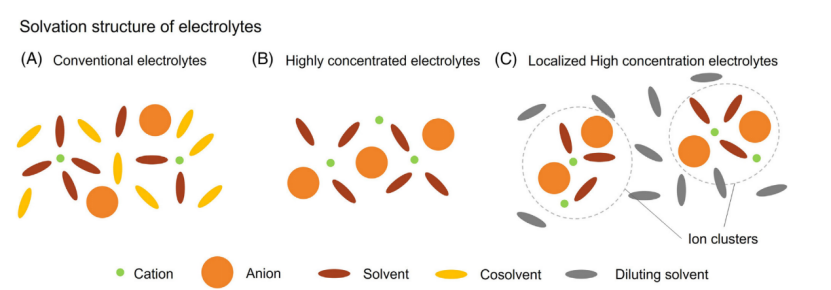
图3常规电解质、高浓度电解质和局部高浓度电解质的溶剂化结构示意图
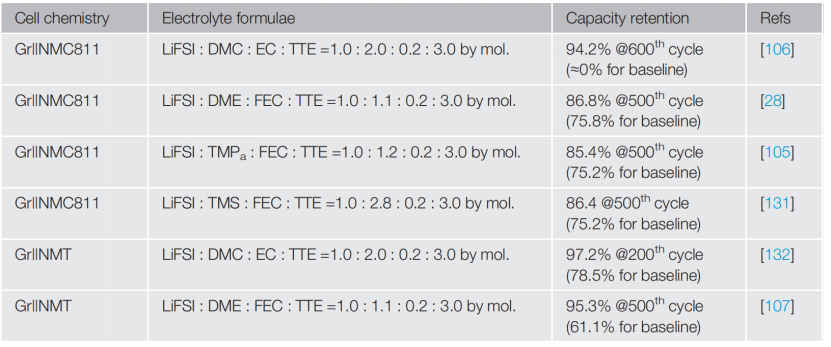
表3 使用基于不同溶剂的局部高浓度电解质的高压锂离子电池(2.5-4.4V)的容量保持
研究工作中电解质:1 mol L-1 LiPF6 in (EC:EMC=3:7 by wt.) + 2wt. % VC 作为所有工程中的基线电解质
由于拓宽了阳极稳定窗口以及提高了SEI/CEI的形成能力,HCEs和LHCEs比传统的LiPF6-有机碳酸盐电解质更显著提升了高压锂电的循环寿命(表3)。同时,由于LiFSI在大多数LHCEs中被用作导电盐,比LiPF6具有更稳定的化学和热稳定性,因为LiPF6引起或促成的正极材料的过渡金属溶解和表面结构分解得到了有效的抑制。
3) 设计化学稳定电极抑制过渡金属离子溶解
正如上述讨论,过渡溶解源于正极和电解液的相互作用。传统LiPF6-有机碳酸盐电解液化学不稳定性是正极过渡金属溶解的主要原因。
·电解液中的氢氟酸和水清除剂
以前大家认为在传统LiPF6-有机碳酸盐电解质中的源于LiPF6和H2O的自发反应的普通酸性物种是造成过渡金属溶解的主因。基于这个假设,HF和H2O清除剂被引入到电解质中抑制过渡金属阳离子的溶解。因为它们与酸反应,金属氧化物和金属盐酸盐经常被引入到电解质中作为HF消除剂。然而金属氧化或者金属碳酸盐与HF反应产生水,水反过来会与LiPF6反应产生更多的HF(图4)。
因此,长期有效的方法仍然有待证实。围绕着这个问题,也设计和评估了易混合的有机添加剂消除HF 或者水。尽管许多已经被证实在抑制电解液中HF和H2O有效,易混合的添加剂参与SEI的形成以及抑制其他老化过程。因此,困难的是这些易混合的添加剂的有益作用是否源于它们在电解液中提升SEI或者清除HF和H2O的能力。
近年来不溶性的有机HF清除剂,如吡啶衍生物和联吡啶衍生物,也展现出了电解质中HF清除能力,因为它们可以和HF形成路易士酸碱复合物。
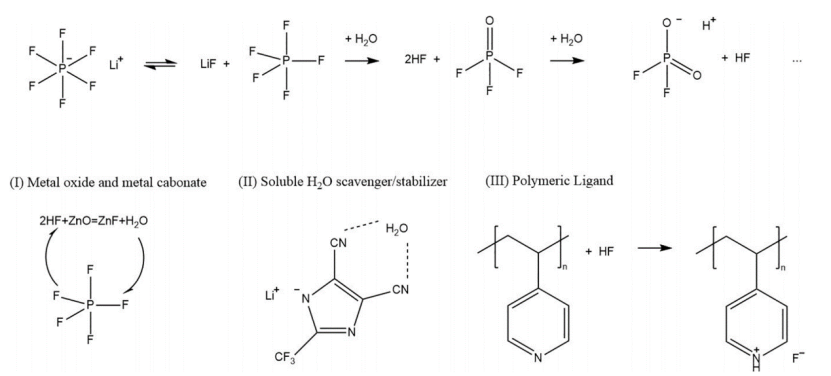
图4常规LiPF6-有机碳酸盐电解质中LiPF6与水的反应以及几种HF和水清除剂/稳定剂的工作原理
·无LiPF6的电解质
尽管HF酸浸出被认为是过渡金属溶解的主要原因,但几个最新的研究表面过渡金属溶解可能比简单的HF浸出机制更加复杂。尽管缺少清晰的LiPF6是如何影响过渡金属阳离子从正极中溶解,但已经知道LiPF6是其中一个过渡金属溶解的 “罪魁祸首”。
例如,通过用LiBF4替换LiPF6,电解质分解和过渡金属溶解在截止电压都有显著的减少。相似的影响也可以在LiFSI-基的LHCES中观察到。因此,替换最先进的商业化电解质中通常的LiPF6用可替换的电化学稳定导电盐被认为是可行的减缓过渡金属的溶解严重程度的方法。
4)通过设计电解质阻止正极和负极材料之间有害得相互作用
通过上述讨论,只有在SEI浸透后过渡金属阳离子才会引起显著的锂离子电池阻抗的增加,因此阻断正极和负极通过电解质的有害串扰是另一个加强高压锂电性能的方法。 电解质中引入过渡金属清除剂的,也就是最普通的不溶性配体被认为是一种切实可行的方法。
由于过渡金属和配体之间强的络合作用,通过过渡金属离子从电解质中迁移可以从电解质相中被清除。换句话说,这些含配体功能的聚合物可作为过渡金属阳离子的过滤器。因此,负极被保护起来即使过渡金属阳离子从正极中溶解。遵循这个原则,Banerjee等人系统的研究了用含有配体聚合物作为过滤器的益处。这些聚合物许多不止有过渡金属阳离子清除能力,也有去除HF的能力在电解质中。
结果,当用过渡金属清除聚合物时,Gr电极上的过渡金属阳离子含量检测到显著降低,这与改善电池的性能密切相关。除了聚合物清除剂,例如LiCO3化合物和不溶的配体可以并入分离器作为过渡金属清除剂。
04 总结和展望
为了提升锂离子的更广的应用,工作电压增加到传统LiPF6-有机碳酸碳电解质无法承受的水平。
在本综述中,系统研究了高工作电压锂离子电池的老化机制。针对这些老化机制,总结了在电解质的设计和电解质阳极稳定性的策略。添加CEI形成添加剂,提升电解质的固有化学和阳极稳定性,引入过渡金属清除剂是抑制高压锂电老化过程和增加循环寿命切实可行有效的方法。对于高压锂电中使用的电解质的未来发展,作者提出了以下一些前景性方向(参见突出问题)。
注(突出问题):
1.我们如何确定不同电池化学物质中电解质的真正阳极稳定性?
2.CEI的基本特性是什么?如离子导电性、电子导电性、结构、组分、形貌以及机械强度?
3.哪些技术可以用来系统的测定CEI的这些特性?
4.这些CEI的特性如何影响高压锂离子电池的循环寿命?
5.不同延长高压锂电池的寿命方法组合时如何相互作用?
6.在综述中列举的几种方法对SEI和负极也有巨大的影响。怎样可以分辨改善SEI的贡献?
1.电解质阳极稳定性的可靠性测定
发展固有高阳极稳定性电解质的第一步是建立一个可靠性测定的方法。在以前的文章中主要采用铂、玻璃碳、不锈钢作为测定电解质阳极稳定的工作电极。然而,工作电极的表面化学性质对所测定的阳极稳定性有较大的影响。影响因素如化学反应、高度脱锂的催化正极表面和活性电极表面积不能很好地通过平的惰性电极如Pt,、C或者 SS表现出来。因此,通过这些电池测定阳极稳定性常常偏离真实值。
在更早的1999年,Xu等人建议用LiMn2O4(LMO)作为工作电极测定真实的阳极稳定性窗口,因为LMO的脱锂在一个相对低的电势完成并且不干扰电解质的阳极分解电流。与Pt和C电极相比,LMO的脱锂更类似高压锂电中使用的正极。然而,与常规正极材料如NCM和LiNi0.8Co0.15Al0.05O2相比,LMO的活性仍然不满足。因此电解质筛选需要设计电池化学以便更好的模拟高压锂电真实正极。
2.CEI特性与循环性能之间的相关性
与负极的SEI相比 ,CEI在以前没有引起过多的关注,因为电解质在4.2V截止电压下相对稳定。然而,在高压锂电中,CEI的重要性不应该被低估。为了更好的理解CEI如何影响高压锂电池的循环性能,需要系统的研究其组成、结构、形貌、离子/电子传导率和机械强度。通过这些信息,可以建立CEI特性与循环性能的相关性。
3.方法组合
上述介绍的方法可以组合应用进一步提高高压锂电性能 。例如,无EC的电解质、高阳极稳定性溶剂、无LiPF6盐和有效的CEI形成添加剂有望进一步提高高压锂电循环性能。混合优势设计原则将来可以开发应用在高压锂电的未来电解质
审核编辑:刘清
-
[讨论]讨论聚合物锂离子电池是否能替代锂离子电池2009-05-13 0
-
锂离子电池的类型2013-05-17 0
-
聚合物锂离子电池的构成2013-06-06 0
-
锂离子电池的性能2013-06-13 0
-
锂离子电池电解液有机溶剂的发展趋势2013-06-17 0
-
【转】锂离子电池的维护和保存技巧分享2016-08-18 0
-
锂离子电池电解液超全面介绍 有何神秘之处?2017-02-22 0
-
锂离子电池SEI膜的性能影响2019-05-24 0
-
锂离子电池主要有哪些类型2020-11-03 0
-
锂离子电池简介2020-11-03 0
-
锂离子电池循环寿命影响因素及预测2021-04-22 0
-
锂离子电池聚合物电解质导电机理是什么?2009-10-29 6907
-
锂离子电池及其电解质的研究2009-11-04 3171
-
锂离子电池聚合物电解质导电机理2009-12-09 1921
-
锂离子电池堆电解质的要求及对电池性能的影响2020-12-30 3537
全部0条评论

快来发表一下你的评论吧 !

