

先进等离激元技术及其在多尺度生物医学成像中的应用
描述
成像技术对于破译各种空间尺度的生物现象、结构和机制至关重要。传统成像方式的空间分辨率不能满足生物医学领域高精度研究和诊断的需求。等离激元共振是光与物质的相互作用,它使远场辐射聚焦到近场,形成局域化的强电磁场,增强了纳米消融、吸附物的弹性/非弹性散射和附近荧光体的光致发光发射。
此外,纳米粒子的等离激元共振散射可以灵敏地反应微环境的变化。将等离激元的高空间分辨能力与拉曼、红外、荧光等分子光谱分析技术相结合,可以发展出一系列优秀的成像技术,实现从组织到亚细胞水平的各种生物过程的实时监测。
近期,厦门大学李剑锋教授与厦门大学附属心血管病医院王焱教授从空间分辨率的角度综述了一系列等离激元技术的原理,并展开论述其在生物医学成像领域的应用。相关成果以“Advanced plasmonic technologies for multi-scale biomedical imaging”为题发表在国际化学权威杂志Chemical Society Reviews上。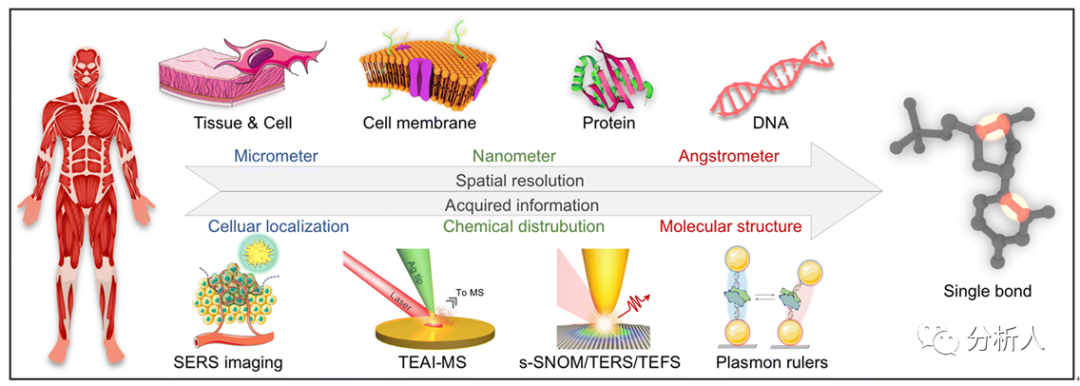
图1 不同尺度空间分辨等离激元技术在生物成像中的应用
等离激元光子学的基础
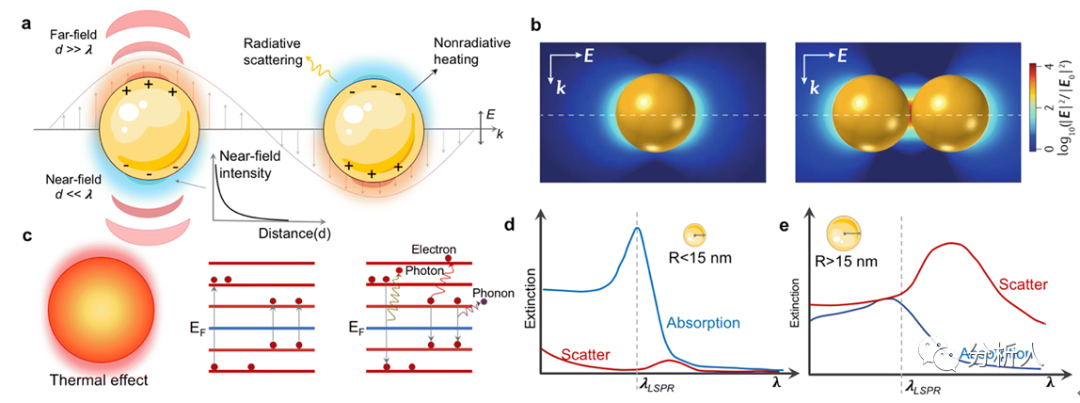
图2 等离激元的机理和现象
作者首先简要介绍了等离激元光子学的基本概念,并强调了局域等离激元共振效应(LSPR)的纳米尺度的特点,引申介绍了三个LSPR相关的现象:
(1)金属表面附近的电磁场增强。在局部等离激元共振状态下,电磁场延伸到周围大约10 nm-30 nm,因此,它只能影响附近的物体,例如,增强表面吸附分子的拉曼(非弹性)散射,增强金属附近荧光团的荧光发射,以及在纳米区域消融/电离样品。这种局部的电磁场使得探测纳米区域的信号成为可能。
(2)纳米结构的加热效应。一旦局部表面等离激元被激发,吸收的能量就会诱导金属的电子从基态转移到高能态,产生热载流子。一小部分热载流子通过光致发光或能量转移到周围介质而衰变。而大多数作为阻尼振荡器,通过电子-光子、电子-电子和电子-声子的耦合进行非辐射衰减,导致局部热效应。这种热能可以作为纳米级的热源用于光热解吸、光热治疗和材料合成。
(3)纳米结构奇特的散射和吸收效应。当纳米粒子中电子振荡的频率与入射光的频率相吻合时,入射光子就会发生显著的消光,包括散射和吸收,因此纳米粒子溶液显示出独特的颜色。不同尺寸的纳米粒子表现出不同的吸收/散射行为。吸收/散射谱图的变化反应了纳米粒子之间以及纳米粒子与周围环境的相互作用,这为埃级距离变化的传感提供了一种有效方式。
LSPR提供了适合于纳米尺度成像的超敏感分析方法。上述增强的拉曼和荧光效应可以衍生为表面增强的拉曼散射光谱(SERS)和针尖增强的拉曼/荧光光谱(TERS/TEFS)。等离激元材料的增强电磁场和加热效应可以发展为针尖增强的烧蚀和电离质谱(TEAI-MS)。弹性散射可以发展为散射型扫描近场光学显微镜(s-SNOM)和等离激元尺。因此,接下来,该综述从空间分辨率的角度(即从微米到埃级的分辨率),叙述了以上技术在生物医学成像中的应用。
SERS生物成像:从微米到纳米的分辨率
自1970年代发明以来,SERS技术由于其超灵敏和抗干扰能力而被广泛用于生物成像和生物感应。目前有三种基于纳米结构的SERS检测方法:直接SERS成像、基于反应的SERS成像和标签式SERS成像(图3a-c)。根据SERS生物成像的模式,空间分辨率从微观到纳米不等。所有这些SERS检测方法都可以适应普通的基于激光的光学系统,以获得由点扫描、线扫描或面扫描逐像素收集的光谱集产生的SERS图像。SERS成像的空间分辨率通常受到远场衍射极限的限制。
SERS成像可以用于研究细胞外、细胞膜和细胞内发生的单细胞生物学过程(图4)。比如用增强基底对细胞外pH进行成像,利用SERS-标签策略监测叶酸与其细胞表面受体之间的受体介导的内吞作用,以及用超窄的纳米间隙SERS编码标签实现活细胞的细胞器成像。
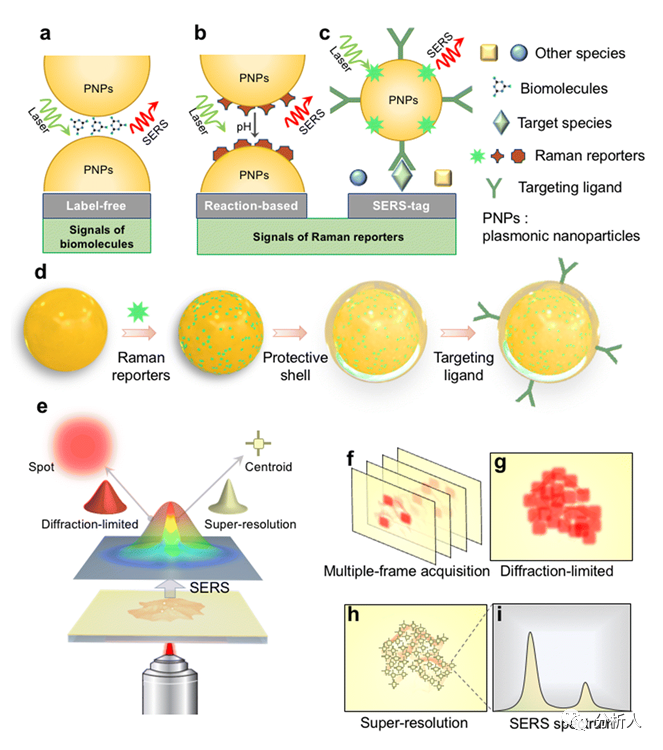
图3 SERS生物成像的模式
SERS技术还适用于组织水平的可视化、诊断和疾病的预后,如肿瘤和缺血性坏死(图4)。SERS基底已经成为一种探测组织切片和高灵敏化学成像的表征手段。比如用金纳米珊瑚增强基底获取生物切片的独特拉曼带,实现缺血区和正常控制区的显著区分。
进一步,经过保护性壳层修饰的SERS标签粒子可以用于图像引导的外科肿瘤切除和热成像引导的微肿瘤消融。另外,将SERS标签与近红外-II荧光相结合,可以提供了一个双模式跟踪平台,以评估体内化学分布和标记的干细胞的动态。这种标记和多模态追踪系统在不同器官疾病的治疗方面具有巨大的潜力。
上述细胞级成像应用主要受远场衍射的限制,分辨率在微米/亚微米的量级。而超分辨率SERS成像扩展了纳米级成像的可能性,同时还可以获得丰富的光谱信息(图3e-i)。为了实现打破衍射极限的更高空间分辨率,可以采用独特的超分辨率方法(STORM)来获取和处理信号。
SERS超分辨率成像借鉴于单分子荧光成像技术:当个别分子扩散进入或者离开纳米粒子间隙形成的热点时,会导致SERS强度随时间发生波动(表现为在微秒或毫秒尺度的宽场图像中的光闪烁现象)。因此可以利用热点的这一特征,实现单个分子的SERS散射信号在“开”和“关”状态之间的不断切换。
通过SERS-STORM超分辨技术,实现了针对革兰氏阳性和革兰氏阴性细菌的化学成像,图像分辨率小于50 nm。需要指出的是为了获得具有纳米级分辨率的生物样本的SERS超分辨全景成像,通常还需要高密度和大面积的热点,作为纳米级的激发源,随机“照亮”生物样本表面的分子。
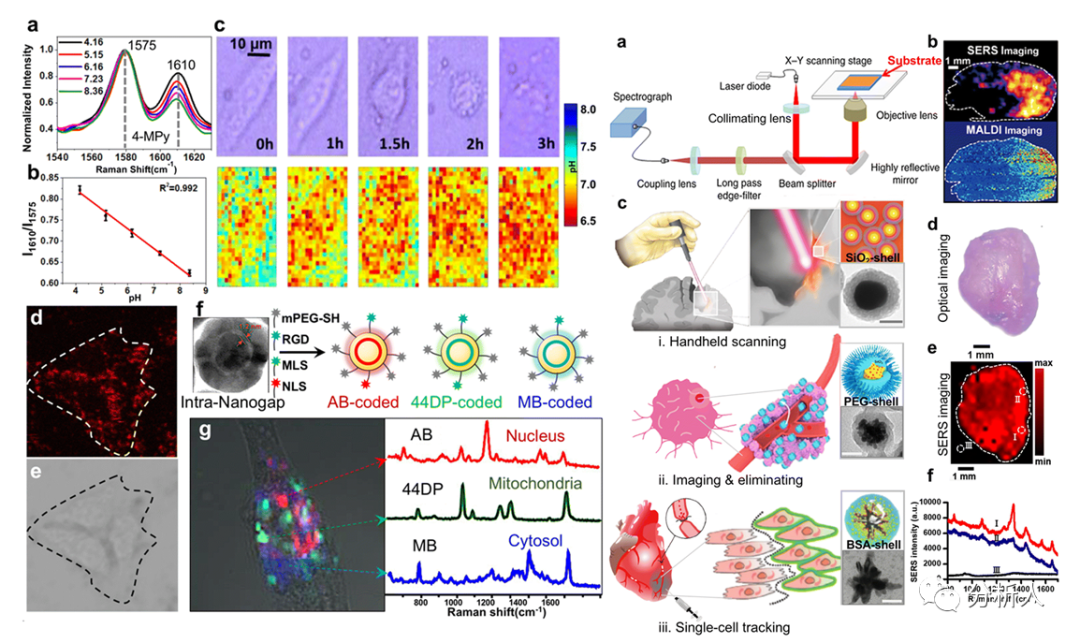
图4 SERS细胞成像和组织成像的应用
针尖增强的烧蚀和电离质谱成像:亚微米级的分辨率
尽管二次离子质谱(SIMS)可以提供纳米级分辨率的化学成像,但它受到光谱干扰、基质效应和质量范围的限制。若将近场技术引入质谱分析,质谱成像(MSI)的空间分辨率可以达到亚微米级甚至纳米级。研究人员通过引入一个纳米级的无孔探头实现了纳米级的MSI。
由于LSPR效应,无孔针尖顶点的辐照度被放大,并作为直接电离的强化光源,使化学成像的横向分辨率超越了远场衍射极限限制(图5)。除了化学信息,在近场方法中使用的针尖可以同时获得表面的拓扑信息,这对理解复杂的生物性质是一种重要补充。
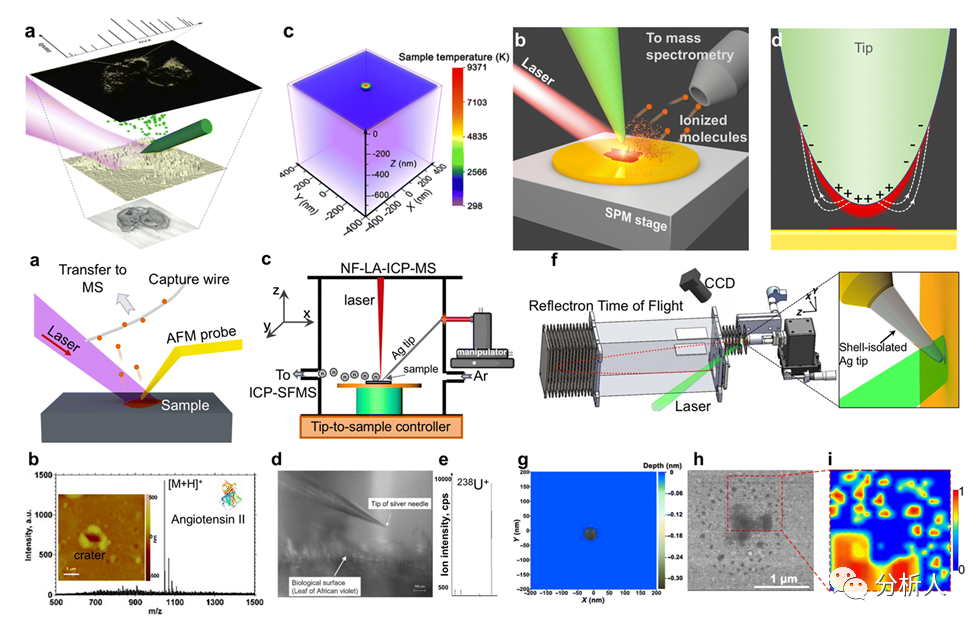
图5 针尖增强质谱的成像原理、模式和应用
由于等离激元材料提供了增强的烧蚀作用,MSI系统和针尖增强方法的结合可以实现微米/纳米级空间分辨率的烧蚀并提供化学信息。研发人员开发一种离线质谱方法来转移和分析生物大分子,在分析血管紧张素II时发现了一个直径为1 μm的烧蚀坑。近场针尖增强的ICP-MS可以在叶子和花瓣上进行单次测量,横向分辨率为300 nm。此外,将扫描隧道显微镜(STM)与自制的反射光飞行时间质谱仪结合起来,可以以50 nm的横向分辨率对KI残留物的图案进行成像(图5)。
针尖增强的纳米光谱成像:纳米级的分辨率
扫描探针显微镜(SPM)可以获取单分子的原子级分辨率图像,然而获得的化学信息有限。相比之下,光谱工具提供了获得分子的振动/电子信息的机会,因此可以进行化学分析鉴定。但是光谱技术的成像空间分辨率是由半波长衍射极限(>200 nm)决定的。为了获得超高空间成像分辨率以及化学结构信息,科学家们将SPM和光谱学结合起来,实现了针尖增强的纳米光谱学技术。它在测量生物样品或纳米材料的形态、并同时获得样品化学分布和物理特性等方面具有很大的潜力。针尖增强纳米光谱成像技术按发展的时间顺序可细分为几种技术:散射型扫描近场光学显微镜(s-SNOM)、针尖增强拉曼光谱(TERS)、针尖增强荧光光谱(TEFS)和同步针尖增强拉曼和荧光的双模式(TERS-TEFS)。
s-SNOM借助原子力显微镜(AFM)的空间分辨率提供样品表面的化学和光学特性信息(图6)。s-SNOM的发明大大促进了纳米级生物成像技术的发展。例如通过配备宽带红外光源,利用金涂层针尖扫描单个包膜病毒可以追踪病毒破裂过程中的细微结构和指纹光谱变化。s-SNOM还可以扫描单个蛋白并实现30 nm横向分辨率的图像。独特的吸收光谱表明,胰岛素的二级β-折叠结构被外部的α-螺旋结构所包裹(图6)。
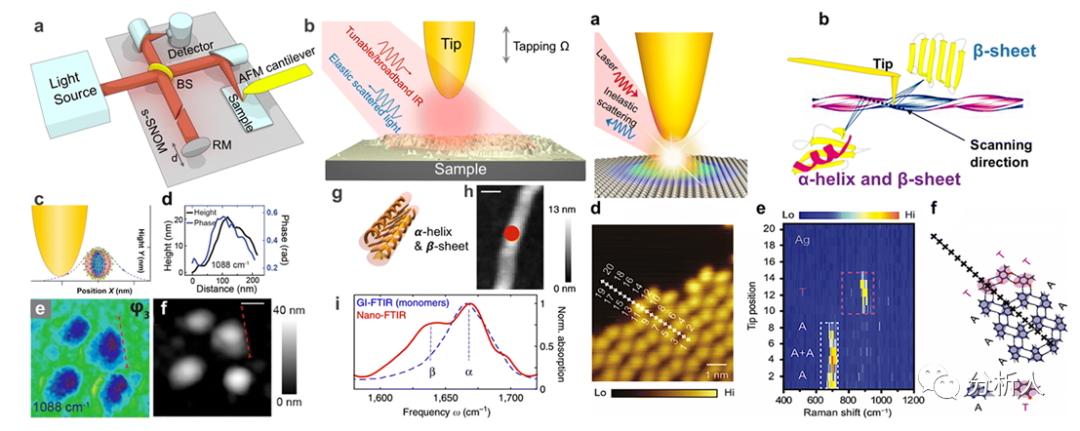
图6 s-SNOM、TERS原理及生物成像应用
TERS为探索生物组织的超分辨拉曼散射提供了机会。例如,TERS可以识别蛋白质的结构和特定官能团的比例,并获得用于测序的无标签DNA或RNA信号(图6)。TERS可以获得纳米区域内的胰岛素纤维的特征信号。高空间分辨率的光谱显示,只有34%的纤维素表面是纯β-折叠,其余的由α-螺旋和无序结构部分组成。TERS已被用于DNA研究,如测序和监测DNA链的断裂过程。在超高真空(10-10 torr)和低温(80 K)的环境下,通过配备光学低损耗的银尖端,TERS扫描可以将腺嘌呤(A)和胸腺嘧啶(T)碱基氢键网络的分辨率进一步提高到亚纳米水平。
针尖增强荧光光谱(TEFS)几乎与TERS同期发展。与拉曼光谱不同,荧光光谱可以提供有关材料的电子特性和光激发状态的弛豫动态的信息。TEFS的实现方式(图7)与TERS相似,而增强效应的规则并不相同。在荧光增强和淬灭之间存在着一种竞争性的效应。比如在垂直方向上,偶极子发射器金属表面上的球形纳米粒子模型系统中,荧光速率经历了从增强到淬灭的转变。荧光增强在距离z∼5 nm时达到最大值(图7)。
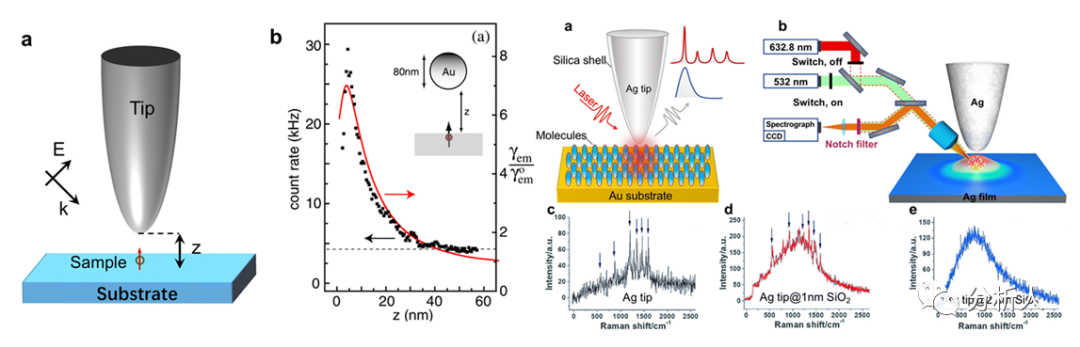
图7 基于等离激元材料,制造s-SNOM针尖以获得更强的信号
先进的近场技术可以实现亚衍射极限的成像。比如利用孔径上的尖端策略可获得空间分辨率为26 nm ± 4 nm的细胞成像。光学纳米天线可以清楚地分辨出其原生环境中的蛋白质,增强荧光图像的空间分辨率为50 nm。另外,无孔针尖可以观察小分子和蛋白质之间相互作用的更多细节。荧光标记DNA的针尖增强全内反射荧光显微镜(TIRFM)和AFM成像联用,可实现39nm的空间分辨率。理想条件下,利用银尖端的单个原子和NaCl层隔离的银基质,可以以0.8 nm的空间分辨率对单个酞菁分子进行成像。这些概念性研究的成功为推动TEFS以超高空间分辨率获得复杂生物体系成像奠定了基础。
TERS用于获得分子的化学键振动信息,而TEFS可以获得分子的电子转移动力学信息。这两种技术的结合可以在同一台仪器上实现,被称为TERS-TEFS,以实现更全面的材料表征。针尖增强的近场光学技术实现了高对比度和高空间分辨率(17 nm)的有机半导体薄膜(diindenoperylene,DIP)的图像,拉曼指纹出现在荧光背景的顶部,表明目标分子是直立的。此外,TERS-TEFS技术可用于同时获得单层卟啉分子的振动信号和激发态能量衰减路径。尽管被广泛用于材料应用,但TERS-TEFS中使用的贵金属针尖在实际系统中很容易被污染,导致光谱干扰。
使用壳隔绝的针尖在屏蔽干扰的同时,可获得增强且重复性好的拉曼和荧光信号,二者的相对强度可以通过包覆不同厚度的壳层来调节。在实践中,荧光背景可能会影响拉曼信号,也就是说主要的拉曼带位于宽阔的荧光峰区。为了解决干扰问题,作者介绍一个整合两个激光设备的想法,在针尖共聚焦光谱系统中研究R6G分子,其中一个532 nm的连续波激光用于激发分子荧光,一个632.8 nm的He-Ne激光用于激发拉曼信号(图7)。将针尖-样品的距离优化为2 nm,使得拉曼区远离荧光区,巧妙地避免了相互干扰。
等离激元/分子尺:纳米/埃米尺度分辨率
等离激元尺由两个纳米粒子和它们之间的连接物组成。其原理是基于测量与粒子间的距离有关的等离激元共振吸收峰位置的移动或颜色的变化(如图8)。例如,在引入另一个生物分子时,由生物分子(如DNA链)连接的金纳米粒子二聚体的距离发生了变化,导致等离激元谱共振波长的急剧变化。暗场散射光谱反映出“侵入”生物分子的特性。等离激元尺包含成对的纳米粒子,可以准确测量和分析单个生物分子的特性,包括距离变化和生理化学特性。
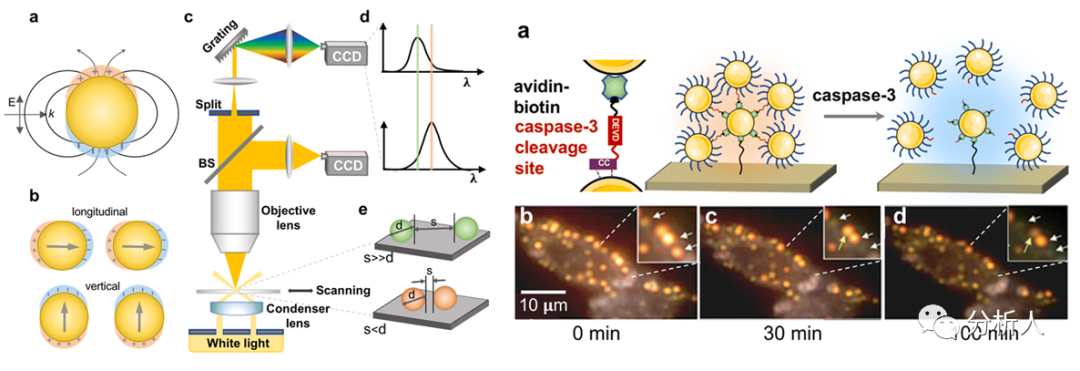
图8 等离激元尺的原理和生物成像应用
等离激元尺可用于动态观察体外DNA分子的生物物理过程(图8)。比如使用金纳米粒子卫星等离激元尺系统,通过核心粒子周围的肽连接,可以观察到活细胞中单个生物分子的长时间变化轨迹。此外,等离激元尺还可以研究蛋白质的活性以及研究DNA在酶作用下的弯曲和断裂过程。虽然一维等离激元尺可以研究亚纳米尺度的生物分子的基本参数,但不利于全面了解软物质运动/反应过程。而通过电子束光刻和逐层纳米堆积技术构建的"H型"结构,具有尖锐的散射光谱。任何轻微变化(埃米尺度)都可以产生可观察到的光学信号,从而实现高分辨率的传感。
作者进一步设想,生化连接物可以连接这些三维等离激元尺进行生物测量。例如,三维等离子体标尺可以在不同的位置附着在大分子上,如DNA/RNA链或蛋白质,然后在暗场显微镜下测量光散射光谱,以解析目标分子的构象结构。
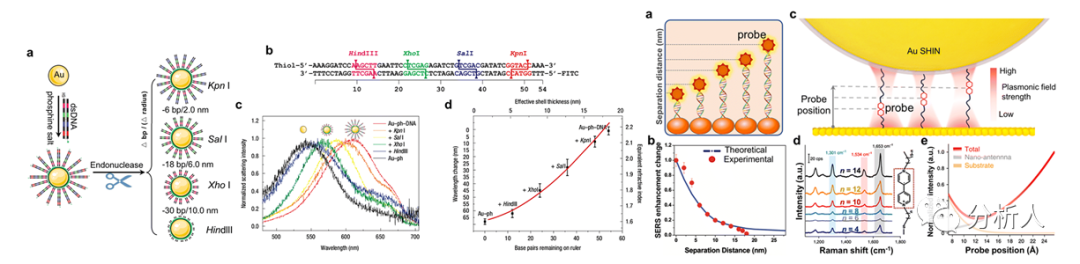 图9 分子尺的原理和应用
图9 分子尺的原理和应用
金纳米粒子上用双链DNA构建的等离激元尺,可以用它来测量由各种内切酶定制的DNA的长度或碱基对的数量(图9)。暗场散射谱以亚纳米的轴向分辨率记录了金纳米连接物的等离激元共振波长与DNA长度之间的关系,显示每个DNA碱基对的平均波长变化约为1.24 nm。若是将一系列具有R6G染料修饰的dsDNA分子尺连接到Au纳米粒子上,可以观察到距离相关的SERS现象,可用于探明与距离相关的生物过程(图9)。另外一种带有探测分子的分子尺,即紫罗碱基团沿着骨架链在不同的分子位置上移动(图9),可以用来分析光学纳米腔内电磁场强度的不均匀性,空间分辨率为0.2 nm,结果发现电磁场形成了一个梳状,其强度不均匀,梯度大,远远超出预期。
这些分子尺技术显示了在超高空间分辨率下研究单个实体构象变化的巨大潜力。作者设想将生物分子附着在分子尺的特定位置上并放置于等离激元场中,生物分子的微妙特征将被明确地展示出来。
总体而言,尽管目前有许多临床测量和成像技术,但由于衍射限制,它们的空间分辨率被限制在亚微米水平。另外,灵敏度不足进一步阻碍了它们在超低浓度传感方面的应用。等离激元技术正在为具有化学敏感性和空间分辨率的生物成像铺平道路。等离激元学的基本物理效应,如电磁场增强、等离激元散射和热效应,支撑起了许多先进技术,包括SERS、TEAI-MS、针尖增强纳米光谱(红外、拉曼、荧光等)和等离激元子/分子尺。这些新兴技术可以实现微米、纳米、甚至亚纳米级别的空间分辨率,可以应用于生命科学的体外和/或体内成像。
然而,为了更深入广泛的应用于生物体系成像分析,等离激元技术需要进一步发展:(1)实现埃级的超高分辨率,为解开复杂生物分子的微妙动态结构提供帮助;(2)在实验室内已证实了等离激元技术在生物医学成像中的可行性,但是还需要技术的进一步发展,在临床试验中验证该技术的有效性;(3)突破单一化的技术模式,发展多模态联用技术为生物研究和临床诊断提供完整多层次的图像信息。
审核编辑:刘清
-
仪器技术在生物医学的前沿应用2009-10-15 0
-
测试测量与医学成像领域的模拟技术趋势2008-06-13 0
-
骆文生物诚聘生物医学人才2014-05-20 0
-
求labview2014或者15版本的生物医学工具包2016-08-06 0
-
【AD新闻】中国深圳先进院在高分辨率超声成像领域取得重要进展2018-03-23 0
-
不同医学成像方法电子设计的挑战2019-05-16 0
-
不同医学数字成像设的挑战2019-07-10 0
-
测试测量与医学成像领域的模拟技术未来将如何发展?2021-05-13 0
-
生物医学电子学在生物医学工程中的应用?2009-04-22 3183
-
飞利浦开展新型医学成像技术PET/MR研究2009-12-05 1070
-
生物医学数字信号处理2015-12-30 854
-
偏振光学在生物医学中的应用2022-11-07 1507
-
高光谱图像在生物医学中的应用2.0 -莱森光学2023-05-09 709
-
一文读懂生物医学领域的传感器(非常详细)2023-05-26 1344
-
生物医学超分辨显微成像技术领域取得突破性进展2023-06-21 407
全部0条评论

快来发表一下你的评论吧 !

