

基于电沉积法制备的纳米微针实现药物在原代细胞内的有效递送
描述
纳米微针是将外源性生物分子递送至细胞的有效工具。尽管纳米微针目前已被应用于多种疾病的治疗,但关于细胞如何与纳米微针相互作用的机制仍然缺乏研究。
近期,美国西北大学的Shana O. Kelley团队提出了一种生成纳米微针的新方法,并验证了它们在药物递送中的实用性,研究了其在药物递送过程中的遗传调节因子。研究人员首先基于电沉积法制造了纳米微针阵列,并使用荧光标记的蛋白质和siRNA量化了其递送功效。值得注意的是,研究人员发现该纳米微针会破坏细胞膜,增强细胞-细胞连接蛋白的表达,并下调NFκB通路转录因子的表达。这种扰动使得大部分细胞停留在细胞的内吞活性最高的G2期。该系统为研究细胞与高纵横比材料之间的相互作用提供了一个新模型。
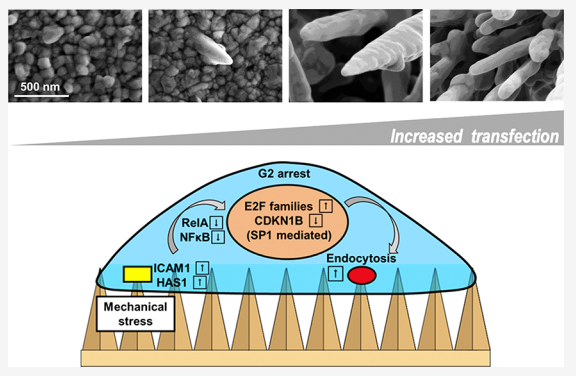
金纳米微针用于原代细胞或干细胞的细胞内递送示意图
将外源性生物分子递送到细胞中是基因组编辑和细胞治疗的基础。现有方法通常涉及使用危险、有毒或低效的病毒、电场或化学试剂。因此,有效且具有成本效益的细胞内递送方法且细胞毒性和细胞应激最小的策略尚未得到开发。 特征尺寸为100 μm~500 μm的微针已被证明具有细胞内递送的功能。然而,通过被动扩散为主的微针的递送效率通常很低(8%到20%)。
此外,人们开发出通过微针介导的电穿孔将质粒主动递送到细胞中。尽管效率提高到50%,但该装置需要高电压 (>50 V) 才能运行。 相比之下,高纵横比纳米材料,尤其是特征尺寸为100 nm~1000 nm的垂直纳米微针,在体外细胞内递送包括核酸、纳米粒子、治疗药物、蛋白质和代谢物中表现出广泛的实用性、高效率(高达95%)和较小的细胞毒性作用。此外,纳米微针已被引入用于原位基因/免疫治疗,并在动物模型和体内取得了令人鼓舞的结果。纳米微针已被证明是一种安全有效的细胞内递送工具。
尽管在实验室层面取得了成功,但纳米微针从实验室到临床的转化非常有限。其中有几个关键挑战仍未解决。事实上,纳米微针的制造通常涉及使用反应离子蚀刻(RIE),这是昂贵、不可扩展、劳动密集型的,并且需要集中的洁净室设施。RIE的使用极大地阻碍了纳米微针的大规模制造。
此外,先前的研究已经利用已建立的癌细胞系来评价递送效率,例如淋巴细胞癌。这些癌细胞系通常易于转染,因此不能很好地代表用作治疗的原代细胞或干细胞。 此外,目前已有的研究尚未系统地了解纳米微针介导的细胞内递送的原理。在一些研究中提出,纳米微针只是通过膜破裂穿透细胞膜,而其他人则认为渗透模型过度简化了细胞-纳米微针界面。纳米微针的存在可以通过细胞膜的动态生化和生物力学调节促进生物分子的摄取。
最近的一项研究还强调,纳米微针甚至可以通过机械转导调节核基因的表达。总之,这些发现表明需要深入研究细胞-纳米微针界面。
研究人员最近引入了用于研究细胞和纳米结构之间相互作用的电沉积电极。该电沉积方法高度可调,可以在模板介导或无模板的的情况下制造具有不同程度纳米结构。值得注意的是,具有高度可调的几何形状和密度的纳米微针可以通过简单的设置在几分钟内沉积到裸露的金表面。这促使该电沉积能够作为一种快速、无RIE制造纳米微针的方法。
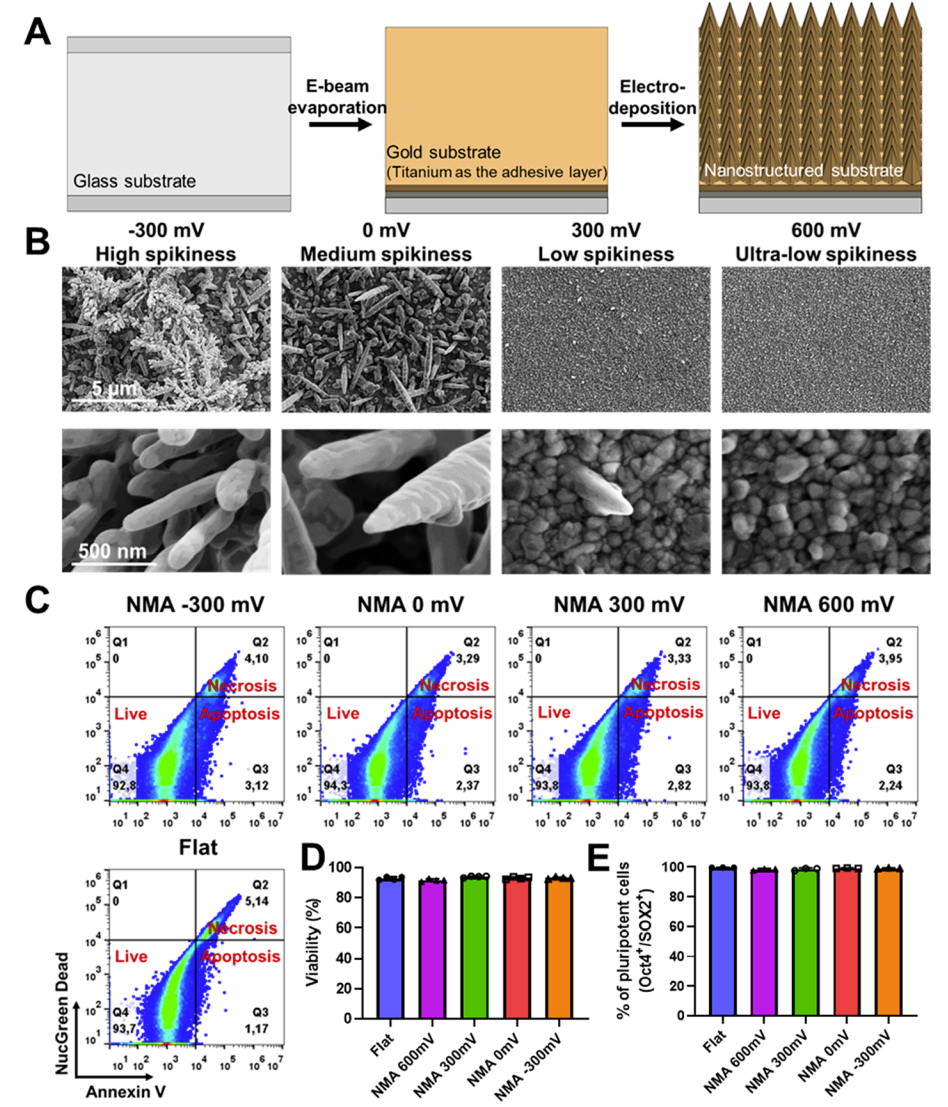
具有可调形态和纳米微针密度的生物相容性纳米微结构(NMA)的电沉积
在该项研究中,研究人员首次报告了使用电沉积来制造金纳米微针,用于难以转染的原代细胞和干细胞的细胞内递送。电沉积方法快速、无RIE、可扩展且成本相对较低。研究人员研究了纳米微针形态、递送效率和细胞毒性之间的关系。基于膜联蛋白V的染色,研究人员发现具有不同形态的金纳米微针对细胞的活力和凋亡影响最小。
在 0 mV和~300 mV的电压下沉积的高尖纳米微针具有更好的递送效率。在电沉积纳米微针的帮助下,各种外源性生物分子(葡聚糖、白蛋白、转铁蛋白、量子点、siRNA)被成功地递送至原代细胞和干细胞中,包括多能干细胞、间充质干细胞、内皮细胞和原代成纤维细胞。
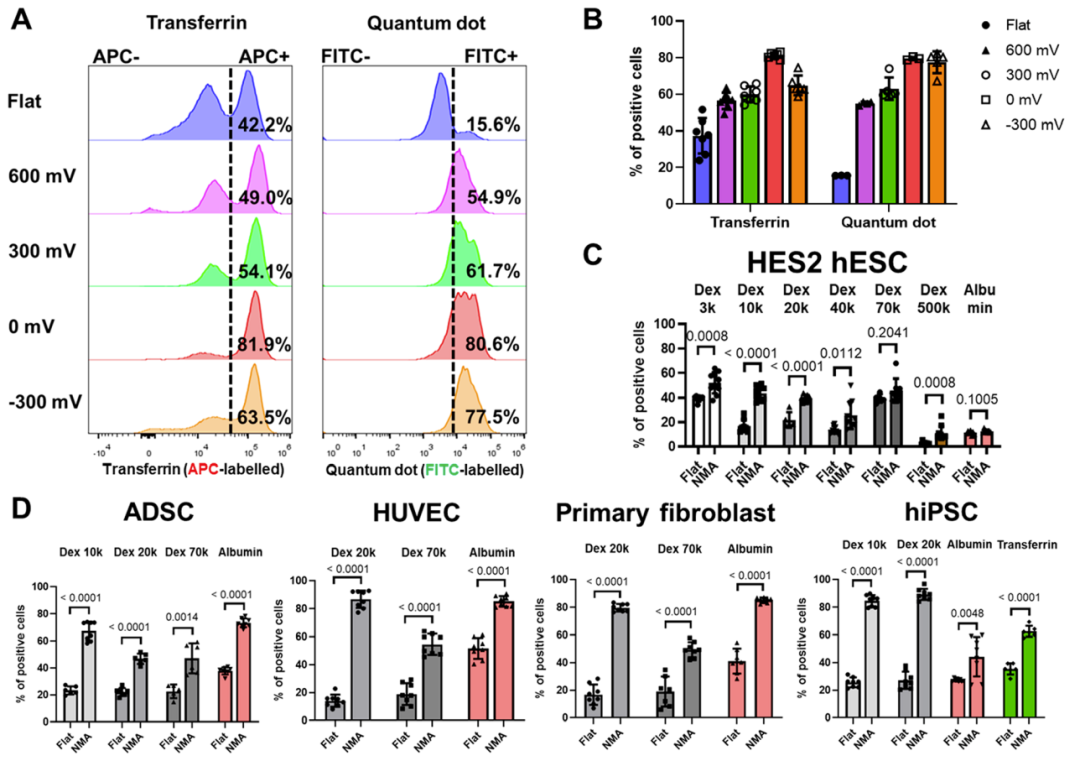
含有高密度纳米针的NMA促进各种生物分子在多个难以转染的原代细胞中的递送
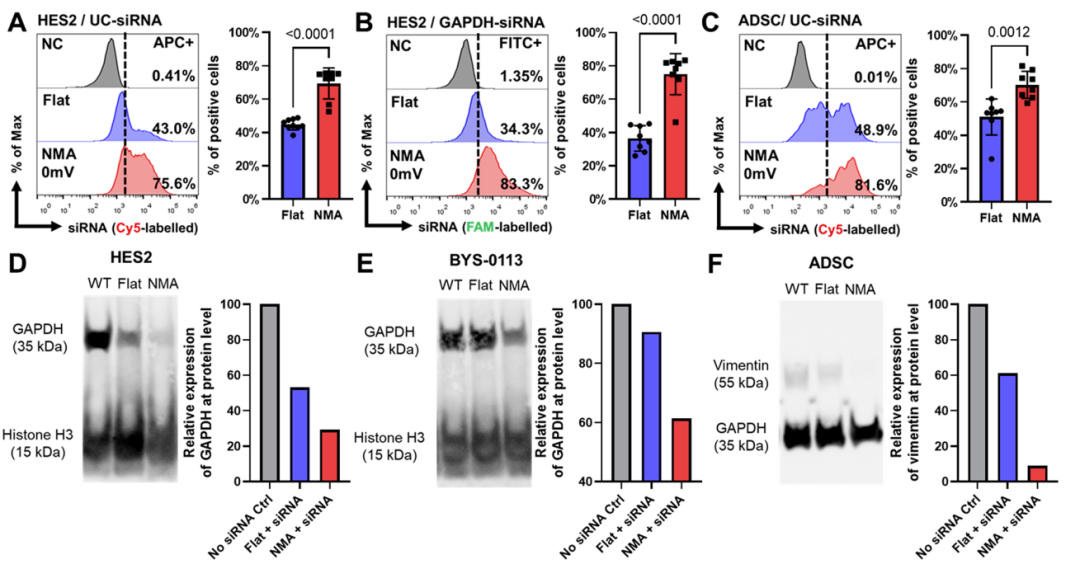
含有高密度纳米针的NMA促进siRNA的转染,并在蛋白质水平上产生显著的抑制作用
研究人员还研究了提高效率的潜在机制,并发现电沉积纳米微针通过阻止细胞进入G2细胞周期来促进生物分子的内吞作用。进一步的微阵列和质谱分析表明,这种细胞周期停滞源于细胞膜上的有限粘附,通过NFκB途径转导至细胞核,并通过调节细胞核中的E2F和CDK蛋白实现。综上所述,该研究结果证明了电沉积金纳米微针对于生物分子的递送的效用,并提供了复杂纳米结构与原代细胞之间相互作用的生物学原理。
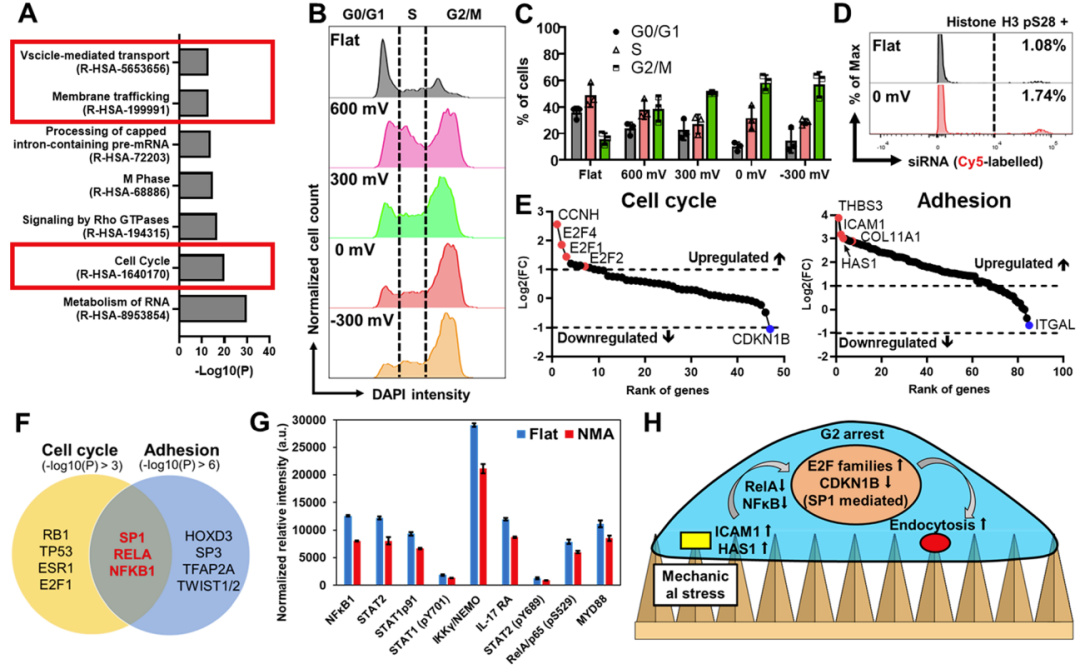
NMAs通过细胞周期停滞促进膜运输
综上所述,研究人员开发了一种快速、无RIE的策略来通过电沉积制造具有可调纳米结构的纳米微针(NMA)。NMA可显著促进原代细胞对蛋白质和siRNA的内吞作用,从而提高基因敲低的效率。研究人员对转录组和蛋白质组进行了全面分析,以揭示其潜在机制。结果表明,内吞作用是通过 NFκB通路从NMA转导到细胞核的细胞周期停滞的结果。总之,研究人员的研究结果表明,生物界面中高纵横比纳米结构的存在可以引起比膜变形更复杂的生物反应。与纳米结构的相互作用将改变多种细胞内过程,例如信号转导和细胞周期。重要的是,纳米结构诱导的细胞周期停滞可用于改善细胞内吞过程并产生有效的细胞内递送。在设计未来的多功能生物界面以进一步提高药物输送的效率时,具有广泛的应用前景。
审核编辑:刘清
- 相关推荐
- 高电压
-
生物技术药物学实验指导书2009-03-18 0
-
TEM制样、FIB切割、Pt沉积和三维重构2017-06-29 0
-
碳纳米管薄膜的制备及处理对场发射特性的影响2008-12-03 742
-
磁性纳米粒子的制备及其细胞分离方面的应用2009-10-26 449
-
单细胞内活性物质的准确检测对揭示其在生命活动中的重要作用2018-10-27 3721
-
一种新型智能量子点组装体通过负载化疗药物实现了肿瘤的高效治疗2018-11-12 2750
-
豆腐成为药物递送微载体2019-02-02 2287
-
科学家研发出可穿透细胞膜的药物递送纳米材料2019-10-22 2161
-
科学家研发可在癌细胞内释放药物的纳米颗粒2020-12-22 1956
-
基于SU-8微流道的SAW器件制备实现药物雾化2022-07-10 889
-
一种近红外光响应的脂质体纳米药物递送平台开发2023-02-06 985
-
自然存在的纳米拓扑系统如何启发用于药物递送的生物材料设计2023-02-09 769
全部0条评论

快来发表一下你的评论吧 !

