

在肝脏芯片上进行肝细胞三维培养取得重大进展
描述
肝脏芯片(liver-on-a-chip)细胞培养装置是药物发现、毒理研究和组织工程研究中的有吸引力的仿生模型。为了在实验室芯片上维持特定的肝细胞功能,必须具备充足的细胞类型和培养条件,包括三维细胞定位和持续的营养物和氧气供应。与传统的二维细胞培养技术相比,器官芯片(organ-on-a-chip)装置提供了多功能性和有效的仿生技术,适用于药物发现和医学上的高级应用。
在一项新的发表在Biofabrication期刊上的研究中,Jonas Christoffersson及其同事们证实了模仿胞外基质的水凝胶如何支持灌注肝脏芯片装置中的肝细胞功能和活力。这些研究人员设计了一种基于透明质酸和聚(乙二醇)(HA-PEG)聚合物的水凝胶系统。他们利用点击化学开发出这种水凝胶。为了做到这一点,他们让环辛炔部分和炔烃叠氮化物标记的反应物之间发生双正交反应(在生命系统内发生的化学反应,没有天然生物化学反应的干扰),即应变促进的炔烃叠氮化物环加成(strain-promoted alkyne azide cycloaddition, SPAAC)。
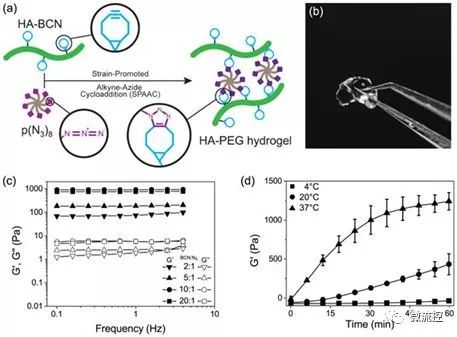
图片来自Biofabrication, doi:10.1088/1758-5090/aaf657
通过与现有的琼脂糖和藻酸盐水凝胶相比较,这些研究人员在细胞相容性(cytocompatibility)方面设计并表征了这种新型凝胶材料。对于生物功能化研究,他们使用了源自人诱导性多能干细胞的肝细胞(hiPSC-HEP)。为了改善这种生物材料的表面细胞相容性,利用叠氮化物修饰的细胞粘附基序改变HA-PEG水凝胶,从而促进有效的细胞-材料附着。在这种表面功能化的生物材料中,这些产生肝细胞的人诱导性多能干细胞(hiPSC)在三维空间中迁移和生长,并且具有增加的活力。与在其他水凝胶上培养的细胞相比,他们观察到在这种新材料上的白蛋白(一种特征性的肝脏蛋白)产量更高。这种灵活的对hipsC-HEP进行灌注三维细胞培养的SPAAC交联水凝胶系统是优化肝脏芯片装置的有前途的材料。
称为“器官芯片”的小型化生物反应器最近已成为一种替代性的细胞培养模型,可更好地模拟实验室中的体内生物微环境。鉴于在临床药物开发的所有阶段观察到药物肝毒性,肝脏是医学研究中的一种特别令人感兴趣的模型。之前的研究已详细介绍了使用器官芯片来预测药物在临床试验中的影响,并评估实验室中药物与肝细胞之间的相互作用。
鉴于生物反应器在学术和工业环境中的广泛应用,它们需要优化的材料和条件以便实现高通量制造。这些条件包括替换常见的原型材料聚二甲基硅氧烷(PDMS),将源自hipsC的细胞整合到柔软的生物材料上来促进它们的生长,并最大限度地减少由器官芯片装置中的微流体容器和管道系统引起的较大死区体积。
这项研究中制备的新型生物材料含有两种通过SPAAC交联在一起的主要成分:cycloocytne修饰的透明质酸(cycloocytne-modified hyaluronan, HA-BCN)和多臂叠氮化物修饰的PEG [p(N3)8]。HA-BCN中的BCN与末端为叠氮化物(N3)部分的8臂PEG聚合物上的N3发生反应,从而形成稳定的1,2,3-三唑类化合物。Christoffersson等人在生理条件下完成化学反应,这就形成粘弹性可调整的水凝胶。这种交联策略是制备用于三维细胞培养的水凝胶的理想选择,这是因为细胞能够被包埋在这种生物材料中而不会破坏它们的活力并且适合用于微流体装置中。他们在这种新型生物材料上使用了过量的SPAAC部分来连接不同的配体,包括促进在细胞-材料界面相互作用的RGD肽。
在此之后,这些研究人员通过振荡流变学技术(oscillatory rheology, 测量软材料的粘弹性行为的技术)来改变这两种主要成分的组成,以便了解所产生的粘弹性,比如这种水凝胶的储能模量(storage modulus, G')和损耗模量(loss modulus, G")。他们在升高的温度下控制了这种新型水凝胶的凝胶化动力学。这种新型生物材料的凝胶化动力学对细胞均匀分布来说足够慢,但对防止细胞沉降来说足够快。控制凝胶化动力学的能力让他们能够考虑微流体系统中用于器官芯片上的多种生物制造策略(比如生物打印)和水凝胶组装。
Christoffersson等人接下来将HA-PEG水凝胶与成熟的三维细胞培养支架---琼脂糖和藻酸盐水凝胶---进行比较。为了确定适合于三维细胞培养实验的最终粘弹性,他们使用振荡流变学技术来研究不同的聚合物浓度。他们通过使用扫描电子显微镜(SEM)图像分析了最终材料的组成。
肝脏芯片设计和设置必须满足这项研究中的两个关键标准:(1)允许灌注的细胞培养基通过这种水凝胶的表面,以便与包封的肝细胞进行稳定的营养培养基交换;(2)在正在进行的细胞培养期间,允许对灌注的细胞培养基进行取样用于实验分析,同时又不影响肝细胞和这种水凝胶。
为了满足这些标准,这些研究人员使用了一种商业化的三维细胞培养装置(μ-Slide III 3D Perfusion IbiTreat),它包含两个连续的腔室(2 x 30 μL)---每个腔室连接到培养基容器以便灌注液体。为了有效灌注,他们通过在含有这种水凝胶的腔室内反转灌注液流动方向将这种三维细胞培养装置安装在自动摇床上。这种实验设置允许灌注的培养基通过这种三维细胞培养装置,这就满足了第一个标准。为了满足第二个标准,与这些水凝胶腔室相邻的局部壁允许他们在不干扰水凝胶或细胞成分的情况下对灌注液进行取样。
在细胞培养3天、7天和9天后,这些研究人员首先用这种水凝胶包埋的HEPG2细胞(一种肝癌细胞系)来研究肝脏芯片装置的生物功能化。他们将这种水凝胶包埋的HEPG2细胞形态、活力和功能与琼脂糖和藻酸盐水凝胶进行了比较。这项研究包括活/死细胞测定以确认细胞活力,并通过检测细胞培养物上清液中的白蛋白和尿素分泌来进一步证实HepG2功能。
为了改善细胞的功能性(在材料表面上的附着力和迁移性),这些研究人员将细胞粘附基序---比如线性或环状RGD肽(线性linRGD或环状cRGD)---移植到这种水凝胶上。在这种情况下,将hipsC-HEP细胞(肝细胞干细胞)在不同的水凝胶组合物中培养13天,以研究细胞-材料相互作用后的形态和活力(活/死细胞染色)。他们在实验中使用了六种不同的基于水凝胶的生物材料表面,包括:二维生物材料表面(HEP涂层),琼脂糖,藻酸盐,HA-PEG,HA-PEG(linRGD)和HA-PEG(cRGD)。
在这种修饰的水凝胶中包埋和培养的hiPS-HEP细胞在二维构建体和真正的三维构建体内生长。为了测试这些体外培养的hiPS-HEP细胞的功能,这些研究人员定量确定了它们的白蛋白和尿素分泌。结果显示仅在二维HEP涂层上和在cRGD基序水凝胶存在下培养的hips-HEP上清液分泌白蛋白。
基于这些研究结果,这些研究人员将二维HEP涂层上较高的白蛋白数量归因于这种水凝胶中的白蛋白扩散速率;在二维HEP涂层上的扩散速度比三维构建体中的快。在结合着cRGD基序的水凝胶中较高浓度的白蛋白与这种在结合着cRGD的生物材料表面上观察到的细胞生长和活力增加相关联。因此,他们打算使用cRGD肽来协助hips-HEP在未来用于肝脏芯片装置的水凝胶上的培养。
通过这种方式,这项研究详细说明了在肝脏芯片装置中使用基于透明质酸-PEG的经过RGD肽修饰的水凝胶进行肝细胞三维培养(将近13天)的优点。作为这项研究的基准,Christofferfsson及其同事们使用了常用的藻酸盐和琼脂糖水凝胶。在未来,他们将优化这种HA-PEG水凝胶系统的粘弹性和细胞粘附基序的浓度,以便实现仿生细胞相容性。这种优化的水凝胶系统可与这种肝脏芯片装置相结合,从而有助于开发出生理上重要的肝脏芯片平台,用于药物毒理学、药物发现和再生医学方面的临床研究。
-
三维逆向工程的成果及应用案例2016-03-02 0
-
三维快速建模技术与三维扫描建模的应用2018-08-07 0
-
广西扫描服务三维检测三维扫描仪2018-08-29 0
-
三维设计应用案例2019-07-03 0
-
Handyscan三维扫描仪对户外大型灯箱三维扫描解决方案2020-07-15 0
-
基于STM32的三维旋转显示平台设计(立体成像)!!!2020-08-27 0
-
三维立体数字沙盘是是什么?2020-08-28 0
-
智能芯片的三维内存解析2020-12-24 0
-
安徽三维动画制作和二维动画有哪些区别呢?(一)2022-01-22 0
-
华芯通第一代服务器芯片研发取得重大进展 预计下半年正式投入市场2018-01-24 6787
-
光纤激光器市场前景广阔,有望在传感和医疗领域取得重大进展2018-06-21 2520
-
中科大在单颗粒或细胞捕获领域取得重大进展2018-04-28 4278
-
谷歌在自研芯片方面取得重大进展2020-12-07 2083
-
类器官和器官芯片的研究进展综述2022-05-25 4411
-
泰凌微电子、谷歌与和众科技的Matter联合项目取得重大进展2024-02-26 544
全部0条评论

快来发表一下你的评论吧 !

