

原电池正负极的判断方法
电池充电/放电
描述
原电池工作原理
原电池反应属于放热的反应,一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
但是,需要注意,非氧化还原反应一样可以设计成原电池。从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
组成原电池的条件
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极;
(2)电极材料均插入电解质溶液中;
(3)两极相连形成闭合电路;
(4)内部条件:能自发进行氧化还原反应。
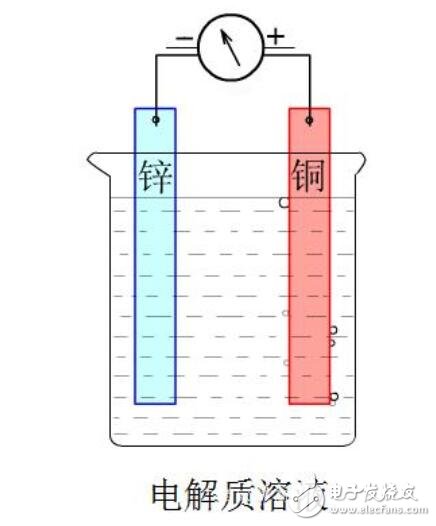
如上图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:Zn电极是负极,其电极反应为Zn-2e- = Zn2+,该反应是氧化反应;Cu电极是正极,其电极反应为2H+ +2e- =H2↑,该反应是还原反应。
(2)当电解质溶液为CuSO4溶液时:Zn电极是负极,其电极反应为Zn-2e- = Zn2+,该反应是氧化反应;Cu电极是正极,其电极反应为Cu2+ +2e- = Cu,该反应是还原反应。
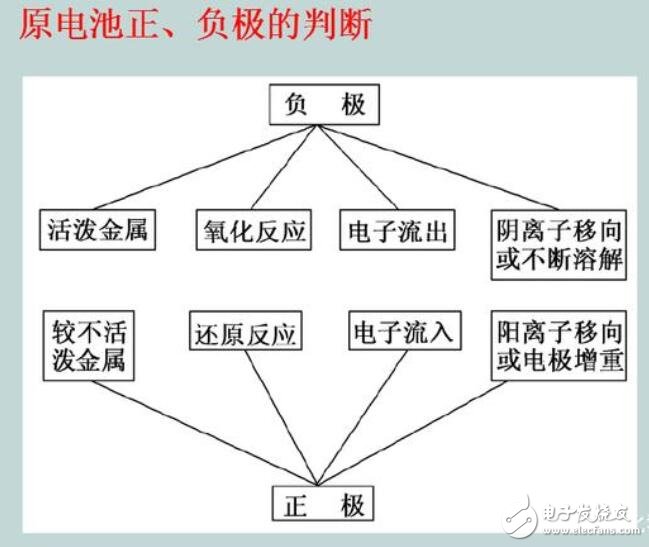
原电池正负极的判断
1.根据组成原电池的两电极材料判断。一般是活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断,电流由正极流向负极;电子由负极流向正极。
3.根据原电池里电解质溶液内离子的定向移动的方向判断。在原电池的电解质溶液中,阳离子移向的极是正极,阴离子移向的极是负极。
4.根据原电池两极发生的变化来判断。原电池的负极上总是失电子,发生氧化反应,正极上总是得电子,发生还原反应。
5.根据总的电池反应方程式中物质的化合价变化判断,化合价升高的反应在负极,化合价降低的反应在正极。
6.根据电极材料是否被溶解来判断。原电池的负极有可能被溶解,而正极一定不会被溶解;相反,增重或有气泡放出的一极为正极。
7.实验法:看电流表指针偏转的方向。先用已知电池验证电流表指针偏转的方向,再根据电流表指针偏转的方向确定原电池的正、负极。
推荐阅读:
-
二极管正负极的判断方法2021-06-21 22578
-
电解电容正负极怎么判断2019-07-01 0
-
如何判断电路中的正负极?2021-03-02 0
-
请问电解电容正负极是怎么判断的?2021-03-17 0
-
原电池正负极的确定2009-10-21 6686
-
镍镉电池正负极反极物质2009-11-05 2400
-
教你判断草帽led正负极2012-03-28 34561
-
cmos电池正负极判断_cmos电池放电有什么用2018-01-10 15563
-
led灯的正负极判断方法2019-07-10 46666
-
电池电路图正负极的判断2019-10-30 50277
-
复杂电路的正负极如何判断2020-01-11 9401
-
极性电容正负极的判断方法是怎样的2021-04-06 5457
-
极性电容正负极判断方法的详细介绍2021-06-09 5750
-
电流源正负极怎么判断2022-01-29 22384
-
法拉电容正负极怎么区分 电容器正负极判断方法2024-01-31 1991
全部0条评论

快来发表一下你的评论吧 !

