

一种结合了热朔型和热固型塑料二者优点的新型高分子材料-vitrimer
电子说
描述
自从1909年第一个热固型高分子材料Bakelite问世以来,热固型树脂因其在高温下优异的力学和抗腐蚀性能,在众多领域得到了广泛的应用,其中包括汽车轮胎、电子器件、武器制造等。毫无疑问,热固型材料的研发是20世纪高分子领域发展的一个重要分支。然而,由于其内在的交联特性,热固型材料的回收再利用非常困难,比如几乎所有的废旧汽车轮胎都无法被回收利用于制造新的轮胎。因此,热固型材料的循环利用是一直以来困扰工业界的一个亟待解决的重大问题。
塑料是生活中的常见的高分子材料。塑料可以分为两大类:热塑型和热固型。热塑型塑料是由非交联的高分子链组成。其中链与链可以互相滑动,很像一碗面条,所以具有加热后会软化,冷却后又硬化,再加热后又软化的可塑性。热塑型塑料的优点是加工简单,可加热后直接挤压到模具内冷却成型,而且还可以回收利用。
常见的热塑型塑料包括由聚乙烯制成的包装塑料袋、饮料瓶,由聚丙烯制成的衣物、容器、文具,以及由聚苯乙烯制成的泡沫材料等。但是热塑型也有缺点,那就是熔点较低,受力易形变等。热固型塑料和热塑型塑料恰好相反,高分子链和链间存在交联键(共价键),故链与链不可互相滑动,受热时不会软化或溶解。所以热固型塑料恰好弥补了热塑型塑料的缺点,具有刚性大,熔点高,尺寸稳定性好的特点。常见的热固性塑料有汽车轮胎(硫化橡胶),发泡海绵(聚氨酯),插座(酚醛树脂),玻璃钢(聚酯树脂)等。但是热固型塑料有一个重大缺点,那就是只能一次加工成型,无法回收利用,容易造成资源的浪费。比如以汽车轮胎为例,2017年美国的废旧轮胎几乎全部被烧掉或者变成建筑填充材料,几乎没有再回收经过处理作为轮胎使用。
2011年,法国巴黎高等物理化工学院(ESPCI Paris) Ludwik Leibler教授发明了一种结合了热朔型和热固型塑料二者优点的新型高分子材料-vitrimer。这种高分子材料内部高分子链之间存在交联的化学键。但在高温下,这种化学键可以通过和周围未反应的位点发生置换或者复分解反应,从而在保持交联键数目不变的情况下改变高分子网络的拓扑结构。这种性质使得材料不仅在低温下具有稳定的机械性能,在高温下仍可以回收重塑。在第一代vitrimer体系中[1],交联键的置换往往需要催化剂的协助,化学和热的耐受性较差,容易形成永久交联网络,也不能直接使用热塑性塑料的加工设备。所以在2017年,Ludwik Leibler教授又提出了第二代的vitrimer体系[2]。在这个体系中,高分子链并不是直接交联,而是通过与一种游离的双向桥接分子(cross-linker)发生复分解反应而实现交联。这种复分解反应会置换出另一种游离的副产物。由于桥接分子有两个反应位点,交联过程需要两步复分解反应,如图1a所示。最近中国科学院长春应用化学研究所的陈全教授对第二代vitrimer体系做了系统研究[3],他们发现实验中交联度会随着桥接分子的增加先上升后下降,从而出现奇特的 “折返融化”的现象。另外,实验还发现第一步和第二步的复分解反应尽管是同一种化学反应,但在同一体系中化学反应常数却差异巨大。这两个反常的物理现象显示我们对于第二代vitrimer体系中的物理机制还缺乏理解,给进一步设计和调控这种新型vitrimer及其在工业上的应用造成了很大困难。
就在最近,新加坡南洋理工大学倪冉教授课题组提出了一套简单的热力学理论框架并配合蒙特卡洛模拟,发现这两种反常现象都来源于体系特有的熵效应。根据理论,他们而且还预测体系在低温极限下的行为,发现交联度仍然可以通过桥接分子的浓度进行调控。相关工作发表在了近期的《美国科学院院刊》上。

图1. (a) 交联由两步复分解反应组成。在第一步中,桥接分子C从未反应的高分子前驱体P上置换出副产物B分子,形成处于半交联态PC。在第二步反应中,处于半交联态PC和另外一个前驱体P发生反应,置换出第二个B分子,同时形成一个完整的交联点。(b)第二步和第一步反应的化学反应常数之比K2/ K1 随着体系中高分子体积分数的变化。其中m为链上的交联位点数目。(c)低密度下,交联位点分布不均。(d)高密度下,交联位点均匀分布。虚线圈出了反应位点作为理想气体运动的空间。
理论框架
作者通过理论推导,发现在巨正则系综下第二代vitrimer体系的自由能可以写成如下形式:

其中第一项求和分别代表高分子链、副产物B、桥接分子C的理想气体平移熵;Ni 为i种分子的数目。第二项求和是对于不同状态下反应位点的,ni 代表分别是单条链上处于i状态下的反应位点(图1a)的数目。这里,作者把反应位点看成受限于体积Vp内的理想气体。其中Vp是每个高分子链占据的体积, 在低密度和高密度下具有不同的大小(见图1c,d)。通过这一项,交联导致的高分子链的构型熵变化就近似成了交联点的平移熵的变化。二者的差值作者用∆S表示。 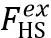 项表示的是体积排斥或者拥挤效应所导致的体系自由能的升高。∆G代表的是复分解反应的反应能。和μi 有关的项代表的则是巨正则系综下和外环境交换分子所引起的自由能改变。
项表示的是体积排斥或者拥挤效应所导致的体系自由能的升高。∆G代表的是复分解反应的反应能。和μi 有关的项代表的则是巨正则系综下和外环境交换分子所引起的自由能改变。
理论预测和蒙特卡洛模拟结果
基于该理论,作者首先证明了,由于在低密度和高密度下Vp的大小不同,交联反应的第一步和第二部的复分解反应常数之比K2/ K1 有两种形式。

在低密度下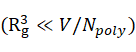 ,反应位点分布不均匀,K2/ K1反比于高分子的体积分数的,即,
,反应位点分布不均匀,K2/ K1反比于高分子的体积分数的,即, , 但在高密度下
, 但在高密度下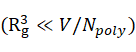 ,由于反应位点分布比较均匀K2/ K1≃1(∆S≃0)。
,由于反应位点分布比较均匀K2/ K1≃1(∆S≃0)。
图1.b的模拟结果很好的验证了理论的预约,因此实验上观察到的K2/ K1偏大很可能是体系反应位点分布不均匀所造成的。通过鞍点近似和自由能极小化,作者得到了体系处于全交联状下反应位点的占比fp2c,即体系的交联度,以及处于半交联状态的反应位点占比 fpc 的解析表达式:

其中

fpc 和 fp2c 的求解只需要模拟输入参数K2/ K1 。图2a-f给出了体系蒙特卡洛模拟的结果(实点)和理论预测(实线)。二者高度吻合。尤其是 fp2c出现了随着μc的增加出现了先升后降的现象。作者同时计算了体系中属于同一交联集群的反应位点的占比xp(图2g-i),发现xp 也会发生相似的非单调变化。由于xp≃0.5 代表了体系变成凝胶的转变点,所以体系确实会随着桥接分子的增加出现反常的“折返融化”的现象。
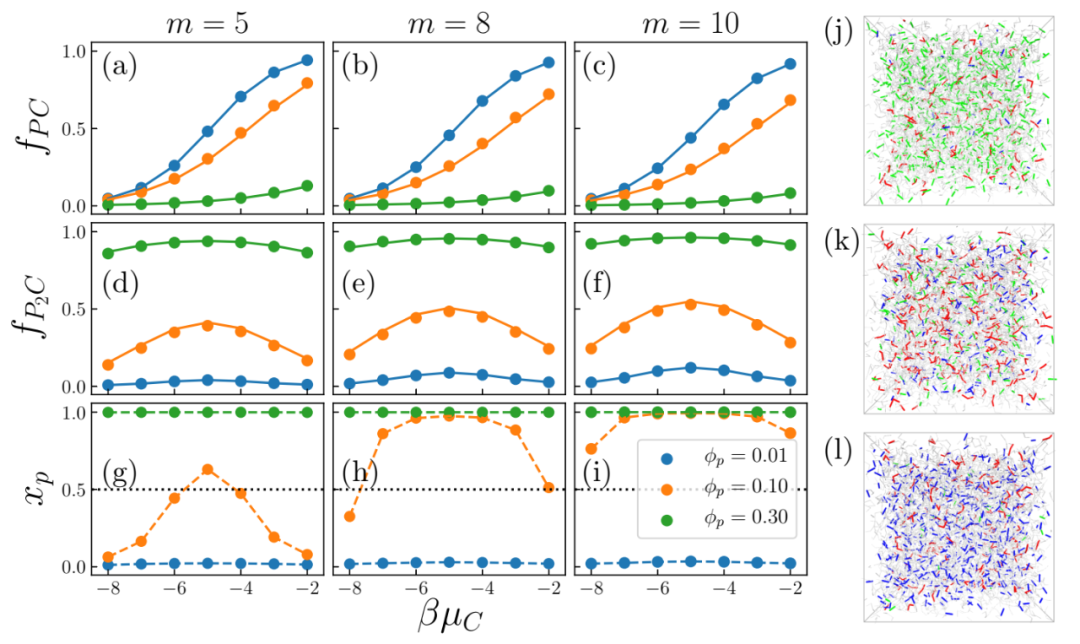
图2. (a-f)处于半交联态PC的反应位点占比 fpc (a-c)和处于交联态P2C 的反应位点占比 fp2c 随着桥接分子的化学势 μc的变化。其中fp2c 随着μc 的增加出现了先升后降的现象。(g-i)体系中属于同一交联集群的反应位点占xp比随着 μc 。xp大于0.5意味着高分子网络发生了“逾渗”(percolation),力学性质在这一点发生突变。xp的先升后降意味着体系会随着桥接分子的增加出现“折返融化”的现象。
不仅如此,该套理论还预言了体系在低温极限下的交联行为。在低温极限下,反应位点只能处于全交联态或者半交联态,二者能量相等。所以交联度 fp2c 的改变不会造成体系能量的改变。图3a,b中,理论和模拟结果都显示了β∆G在趋于负无穷时, fp2c 会变得饱和。不过,虽然 fp2c 在低温下饱和,但改变 μc 还是可以有效的调控 fp2c 的饱和值,使其在逾渗临界点上下变化(图3c,d)。
机理解释
为什么会出现上述的“折返融化”和低温下交联度改变的现象呢?其实这都是体系的寻求熵最大化导致的。由于体系中只有一种复分解反应,形成两个半交联的位点,和新成一个全交联点,能量上都是一样的。具体倾向于哪种状态取决于体系的熵。形成两个半交联态的位点比形成一个全交联点需要多用一个桥接分子,所以后者的平移熵会比前者大∆Strans。但是,形成一个全交联点也会降低高分子的构型熵∆Sconf 。在桥接分子比较稀疏的情况下, ∆Strans>∆Sconf ,所以体系倾向于形成全交联点。随着桥接分子浓度的增加,桥接分子的平移熵会降低,这就导致∆Strans<∆Sconf,这个时候如何一个全交联点被置换成两个半交联位点,体系的总熵会上升。所以体系fp2c 的会随着桥接分子的浓度或μc 的上升而下降。这种熵效应也解释为什么在低温极限下fp2c会随着μc 的上升而下降(图3c)。

图3.(a-b)fp2c和xp随着反应能的变化图,二者随着β∆G的降低趋近饱和。(c-d)饱和的fp2c和随着 μc 的变化图。即使在低温极限下,二者都可以通过桥接分子的浓度进行调节。
结语
作者通过一个简单的热力学理论,从熵的角度解释了第二代vitrimer体系中两个反常现象。相关的熵效应通过蒙特卡洛模拟得到了验证。作者发现体系反应位点不均匀,不会影响第一步交联反应,但却会使第二步交联反应的化学反应常数增加。类似的“自浓度”效应其实已被细胞质中的无膜液滴结构利用,来提高蛋白质和RNA的转录效率。作者发现的桥接分子浓度控制的高分子材料交联的新机制理论上不需要加热升温,有望大大降低vitimer材料的加工制备的能耗。同时,理论模拟预测了第二代vitrimer在低温下的一个重要特性,即仅靠降温并不会使体系交联度增加,相反,桥接分子的浓度起到了至关重要的作用。也将为第二代vitrimer的设计和相关应用提供有效的指导。
责任编辑:lq
-
高分子材料老化测试之氙灯丨老化试验2021-07-06 8129
-
高分子材料湿敏元件2009-11-12 1493
-
磁性高分子材料介绍及应用2010-03-11 1992
-
高分子材料成分分析方法2021-05-20 4908
-
基于智能高分子材料开发了一种通过光照就能产生电2022-07-13 1714
-
一种基于智能高分子材料的新型超双疏表面——PICS2022-08-22 2733
-
差示扫描量热仪在高分子材料行业的应用案例2022-11-03 923
-
四种特殊功能高分子材料2023-06-11 5070
-
什么是导电高分子材料?2021-12-31 11283
-
耐高温高分子材料2023-08-07 2722
-
高分子材料:构筑现代世界的微观奇迹2023-11-27 1762
-
三大电功能高分子材料介绍2025-01-22 3672
-
高分子材料热稳定性测试DSC解决方案2025-02-21 1080
-
差示扫描量热仪在高分子行业的应用2025-05-21 458
-
热重分析仪在高分子材料中的应用2025-05-27 366
全部0条评论

快来发表一下你的评论吧 !

