

荧光寿命显微成像技术(FLIM)技术应用综述
电子说
描述
在生物体中,细胞内的细胞间质及体液成分构成了细胞生存的微环境。稳定的微环境是保持细胞的正常增殖、分化、代谢以及其他功能活动最为重要的条件,细胞内或细胞间的信息传递也离不开其所处的环境。
此外,在一些疾病的治疗中,药物分子与病变组织分子间相互作用,也会改变其微环境,可通过研究细胞或组织的微环境来评价药物治疗效果。
因此,对细胞微环境的高分辨率、高灵敏度探测成为了生物医学的重要研究课题。
图源:中科院长春光机所,Light学术出版中心,新媒体工作组
光学显微技术可以将微米甚至纳米量级的微小物质及结构展现在我们面前,是我们打开微观世界大门,观察细胞组织和生物微环境的钥匙。
若成像基于荧光发光团的荧光强度进行数据分析,则可称之为荧光强度显微技术。此类显微技术通过显微镜的目镜收集样品各个位置的荧光强度,便可以得到生物组织的形貌,具有较髙成像空间分辨率,但受荧光团浓度的影响,其测量精度和定量分析能力都不理想。
幸运的是,在种类繁多的显微技术中,荧光寿命显微成像技术(FLIM)具有对生物大分子结构、动力学信息和分子环境等进行高分辨高精度测量的能力,因此其重要性日渐提升,被广泛地应用于生物学研究及临床诊断等领域。
近期,美国莫格里奇研究所的Melissa C.Skala【⏬拓展链接】课题组在Journal of Biomedical Optics发表了题为“Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications”的综述文章,详细介绍了FLIM的发展,总结了时域、频域两类荧光寿命探测方案,考察了对细胞异质性测量的图像算法,最后列举了FLIM在生物医学上的实际应用。文章证实了FLIM在细胞微环境观测领域的适用性,可被应用于疾病控制和药物疗效的监测。
荧光寿命
分子包含多个能态S0、S1、S2和三重态T1,每个能态都包含多个精细的能级。正常情况下,大部分电子处在最低能态即基态S0的最低能级上,当分子被光束照射,会吸收光子能量,电子被激发到更高的能态S1或S2上,在S2能态上的电子只能存在很短暂的时间,便会通过内转换过程跃迁到S1上,而S1能态上的电子亦会在极短时间内跃迁到S1的最低能级上,而这些电子会存在一段时间后通过震荡弛豫辐射跃迁到基态,这个过程会释放一个光子,即荧光。
此外,亦会有电子跃迁至三重态T1上,再由T1跃迁至基态,但是该过程发生几率较荧光辐射几率而言可以被忽略。
荧光的特性包含有:荧光激发和发射光谱、荧光强度、量子效率、荧光寿命等,其中,荧光寿命是指荧光分子在激发态上存在的平均时间(纳秒量级)。
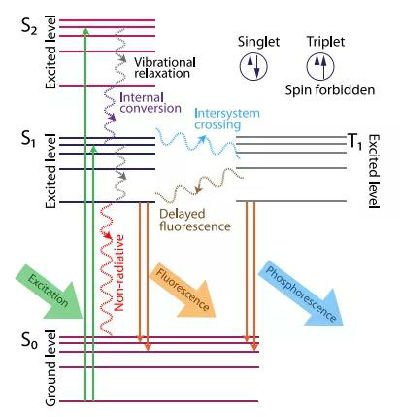
图1 荧光分子能级结构及跃迁示意图
图源:J. of Biomedical Optics, 25(7), 071203 (2020)。 Fig.1
FLIM测量方案
分子的荧光寿命在几纳秒至几百纳秒之间,因此,测量荧光寿命需要极快响应时间的探测器。如今主要存在两类方案:一是时域测量,由一束窄脉冲将荧光分子激发至较高能态S1,接着测量荧光的发射几率随时间的变化(图2a,b)。典型的时域测量方法有TCSPC和时间门(TG)两种。TCSPC利用快速秒表测量激发脉冲与探测荧光之间的时间差。使用高重复脉冲激发光激发样品,在每一个脉冲周期内,最多激发荧光分子发出一个光子,然后记录光子出现的时刻,并在该时刻记录一个光子,再下一个脉冲周期内也是相同的情况,经过多次计数可以得到荧光光子随时间的分布曲线。相似的,TG则探测不同时间窗口内的荧光强度,通过曲线拟合得到荧光寿命。二是频域测量,对连续激发光进行振幅调制后,分子发出的荧光强度也会受到振幅调制,两个调制信号之间存在与荧光寿命相关的相位差,因此可以测量该相位差计算荧光寿命(图2c,d)。
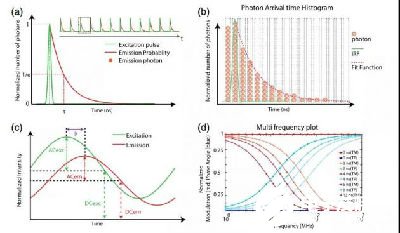
图2 时域和频域的FLIM测量方案原理示意图:a、TCSPC方案;b、荧光光子到达时间直方图;c、频域测量示意图;d、不同荧光寿命下,相位与频率的关系
图源:J. of Biomedical Optics, 25(7), 071203 (2020)。 Fig.4
各种FLIM测量方案的优缺点对比
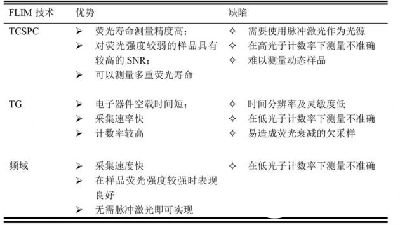
两类方法均存在各自的优缺点:
时域测量方法对于荧光强度较弱的样品可以得到更好的时间分辨率和更高的信噪比,并且测量方法更为简单,易于掌握。
而当样品荧光强度较高时,由于使用的电子器件处理速率限制,无法准确提取荧光寿命信息。
对于频域测量法,采集速度快,可以测量短时间内的生物细胞运动情况,一般用于荧光强度足够强的样品中。
FLIM显微装置
目前为止,FLIM已被应用在两种显微技术的装置结构上,分别为激光扫描共聚焦显微技术(LSM)和宽场照明显微技术(WFM)(图3)。
LSM采用激光作为光源,成像过程需要对样品进行扫描。其中,作者主要介绍了共聚焦荧光寿命显微成像技术(CLSM-FLIM)和多光子荧光寿命显微成像技术(MP-FLIM)。
CLSM-FLIM利用针孔滤去焦平面外的背景噪声,接着通过振镜对样品进行二维平面上的扫描,配合目镜对轴向的扫描,可以实现3D成像。
MP-FLIM则引入了多光子成像,以双光子成像为例,若两个光子能量值之和等于荧光分子基态S0与激发态S1的能级差,则荧光分子能同时吸收两个光子,使电子被激发至S1能态,并发生辐射跃迁产生荧光。MP-FLIM由于需要使用低光子能量、长波段的光源,所以受散射影响更小,多被用于大脑等深度成像领域。
总的来说,LSM具光学层析能力,并且有更高的信噪比和空间分辨率。
与LSM不同,WFM采用平行光照明样品,物镜收集整个视场内样品发出的荧光并利用相机记录。WFM-FLIM具有更快的成像速度,更小的光损伤,但是由于每个像素值均受其他像素位置的散射光影响,所以信噪比不如LSM。现今,TCSPC、TG等时域荧光寿命检测技术和频域解调荧光寿命的技术均已被成功应用于WFM,实现快速生物组织的成像。
图3 LSM-FLIM与WFM-FFLIM结构对比示意图
图源:J. of Biomedical Optics, 25(7), 071203 (2020)。 Fig.5
FLIM生物医学应用
FLIM在生物学上的应用根据荧光分子种类可以分为三种:分别为自发荧光FLIM、外源分子探针FLIM和FRET-FLIM。
自发荧光FLIM被广泛应用于非标记生物成像领域。所谓自发荧光,即生物细胞本身便包含荧光分子,称为内源性荧光分子团。FLIM通过对自发荧光分子团(如NAD(P)H和FAD)荧光寿命的考察,可以实现细胞代谢的监测(图4(a))。这种方案无需人为对样品加入荧光试剂便可以发射荧光,有效减少了荧光染料对样品的毒性、荧光分子与样品的非特异性结合及染料对生理性能的干扰影响。
外源分子探针FLIM借助于外部荧光染料的注入以产生荧光(图4(b))。如今,为了利用FLIM对物理条件(包括粘度、温度、酸度和氧化作用)的敏感性,已经开发出了许多适用于体内和体外应用的光学探针。
图4 FLIM生物成像结果:a、小鼠乳腺肿瘤的NAD(P)H荧光寿命成像结果;b、小鼠的红外荧光寿命成像结果
图源:J. of Biomedical Optics, 25(7), 071203 (2020)。 Fig9-10
FRET-FLIM,当生物供体荧光分子与受体相互作用时,会产生荧光能量共振转移(FRET),供体荧光淬灭,导致寿命减少(图5)。FRET已用于探测蛋白质中的构象变化,蛋白质之间的受体/配体相互作用、核酸链的杂交或分裂、膜脂质相互作用和分布、蛋白酶的活性、染色质结构和许多其他现象。因此,借助于FRET,FLIM可更好地捕获细胞外和亚细胞相互作用。
图5 FRET-FLIM原理示意图:a、供体受体相距较远,无荧光淬灭;b、供体与受体相互靠近,发生荧光淬灭;c、受体的光漂白可以确认供体荧光寿命的变化是由于FRET相互作用引起的
图源:J. of Biomedical Optics, 25(7), 071203 (2020)。 Fig.2
FLIM优势
作者主要分析了FLIM相比于荧光强度成像的优势。通过荧光强度成像可以获得荧光分子的空间分布,较为直接和简便,但是当荧光分子具有相似的频谱特性,或是同样的荧光分子在不同环境下时,依赖强度进行成像的方案便无法准确反映信息。
与基于光强的成像方式不同,FLIM成像适用于测量荧光分子环境的变化,或是测量分子的运动情况(图6)。其结果与荧光分子浓度无关,且不受影响光强的光散射或是光吸收影响,可以精确测量荧光淬灭过程,对生物分子微环境进行定量测量。
图6 荧光强度成像与荧光寿命成像对比
图源:Principles of Fluorescence Spectroscopy Chapter 22 Fig.22.1
FLIM技术与挑战
在装置上,FLIM搭建成本更高,并且为了准确地拟合荧光寿命,需要探测更多地光子,尤其是采用时域方案测量寿命时,采集速度较慢,限制了FLIM在快速生物成像中的应用。
在数据处理上,由于曲线拟合迭代过程的需求,计算成本较其他成像方案更高。
在成像原理上,荧光寿命受多种外界因素影响,这些因素包括分子相互作用、pH值、温度和粘滞阻力等,很难对这些参数控制变量,使得测量荧光寿命存在交叉干扰问题。此外,与普通光学显微技术类似,介质光散射影响成像信噪比及空间分辨率,成像深度受到限制。
特别地,对于内源性荧光分子,荧光量子效率较传统染料低几个数量级,使得自发荧光FLIM的发展受到限制,此外,当荧光寿命接近时,很难将多种内源性荧光分子区分。因此,实验中需要保持样本之间参数的一致性,并需要对每天的对照样本进行成像。此外,可以利用药物直接调节自发荧光分子的含量,例如已有研究表明杜醌可以调节NAD +与NADH的比例。
总结与展望
如今,FLIM已经在系统装置、荧光探针和数据处理算法等方面得到了较快的发展,这也使得FLIM在对细胞微环境成像和生物代谢监测发挥出不可替代的作用。
结合多种先进成像系统,如双光子成像、结构光照明等,可进一步提升FLIM的分辨率和测量精度。
另一方面,提升荧光寿命解调的算法性能,将压缩感知、深度学习等热点算法与FLIM结合,也同样对FLIM的发展起着至关重要的作用。
总的来说,FLIM的发展很好地弥补了基于强度成像的问题,对生物医学检测有着重要的意义。
责任编辑:PSY
-
VirtualLab Fusion案例:单分子显微镜高NA成像系统的建模2025-01-16 784
-
荧光显微镜2009-07-07 3337
-
科学领域新技术,打造高品质共聚焦显微镜2014-04-03 3654
-
基于LabVIEW软件的显微荧光光谱成像系统设计2019-06-04 4342
-
为什么激光共聚焦显微镜成像质量更好?2023-08-22 1468
-
多光子显微镜成像技术:用于体内神经元成像的多种技术2020-12-26 2398
-
荧光助力显微技术迎新突破2021-01-07 1868
-
双光子激发荧光显微成像原理2023-03-17 6737
-
基恩士 一体化荧光显微成像系统 BZ-X系列2022-10-26 2385
-
荧光寿命成像技术在微塑料识别中的应用2024-04-26 1684
-
扫描式荧光寿命成像技术简介2024-05-31 1134
-
光片寿命成像2024-06-26 613
-
什么是散射成像技术?2024-08-23 902
-
利用微型SPAD系统实现荧光寿命成像+ToF测距2024-10-22 1864
-
FYLA发布全新超连续谱激光器HORIZON,开启荧光寿命成像与微纳光学研究新篇章2025-02-24 923
全部0条评论

快来发表一下你的评论吧 !

