

锂离子电池的容量为什么会衰减变化?
描述
一、锂离子电池容量衰减现象分析正负极、电解液及隔膜是组成锂离子电池的重要成分。锂离子电池的正负极分别发生锂的嵌入脱出反应,其正负极的嵌锂量成为影响锂离子电池容量的主要因素。因此,必须维持锂离子电池正负极容量的平衡性,才能确保电池具备最佳性能。
通常来说,锂离子电池常用有机溶剂和电解质(锂盐)组成的电解质溶液,该电解质溶液应当具备足够的导电性、稳定性,并且能够与电极实现相容。对于隔膜来说,其性能是决定电池内阻及界面结构的主要因素,对电池容量衰减变化情况有着直接的影响。若隔膜的质量和性能优越,将会显著提升锂离子电池的容量和综合性能。一般情况下,隔膜在电池中主要起着分隔电池正极和电池负极的作用,避免正负极发生接触而导致电池短路,同时还能够放行电解质离子,以充分发挥电池效用。
锂离子电池中的化学反应不仅仅包括锂离子嵌入和脱出过程中的氧化还原反应,还包括诸如负极表面SEI膜的生产和破坏、电解液的分解以及活性材料的结构变化和溶解等副反应,这些副反应都是造成锂离子电池容量衰减的原因。
电池循环过程中发生容量衰减和损失是必然现象,因此,为了提高电池容量和性能,国内外各领域的学者充分研究了锂电池容量损失的机理。目前,可知引起锂离子电池容量衰减的主要因素包括正负极表面形成SEI钝化膜、金属锂沉积、电极活性材料的溶解、阴阳极氧化还原反应或副反应的发生、结构变化及相变化等。当前,对锂离子电池容量衰减变化及其原因仍然在不断研究的过程中。
二、过充电2.1 负极过充反应能够作为锂离子电池负极的活性材料种类较多,以碳系负极材料,硅基、锡基负极材料、钛酸锂负极材料等为主要材料。不同类型的碳材料具有不同的电化学性能,其中,石墨具有导电性能较高、层状结构优良、结晶度高的优势,较为适合锂的嵌入和脱出,同时石墨材料价格实惠、存量较多,因此,应用较为广泛。
当锂离子电池首次充放电时,溶剂分子会在石墨表面发生分解反应,并形成名为SEI的钝化膜,这一反应会引发电池容量损失,并且属于不可逆的过程。锂离子电池过充电过程中,负极表面会发生金属锂沉积现象,该情况容易发生在正极活性材料相对于负极活性材料过量的情况下。同时,若在高倍率条件下,也有可能产生金属锂沉积现象。
通常来说,形成金属锂导致锂电池容量衰减变化的原因主要包括以下方面:第一,导致电池中可循环锂量降低;第二,金属锂与电解质或溶剂发生副反应,形成其他副产物;第三,金属锂主要沉积在负极和隔膜之间,从而造成隔膜孔隙堵塞,导致电池内阻增加。石墨材料的不同,锂离子电池容量衰减变化的影响机理也存在一定差异。天然石墨的比表面积较高,因此,发生自放电反应将会导致锂电池容量损失,并且天然石墨作为电池负极,其电化学反应阻抗也比人造石墨要高。另外,循环过程中负极层状结构解离、极片制作过程中导电剂分散情况、储存过程中电化学反应阻抗的增加等因素,都是导致锂电池容量损失的重要因素。
2.2 正极过充反应正极过充电主要在正极材料占比过低的情况下发生,导致电极间容量失衡,致使锂电池容量发生不可逆的损失,并且正极材料和电解液分解出来的氧气及可燃气体的并存和不断积累,可能会给锂电池的使用带来安全隐患。
2.3 电解液在高电压下发生反应若锂电池充电电压过高,将会导致电解液发生氧化反应,并生成部分副产物,将电极微孔堵塞,阻碍了锂离子的迁移,从而造成循环容量衰减变化。电解质浓度和电解液的稳定性的变化趋势成反比,电解质浓度越高,电解液稳定性越低,进而对锂离子电池容量产生影响。在充电过程中,电解液会发生一定消耗,因此,需要在装配时进行补充,导致电池活性材料减少,并影响电池初始容量。
三、电解液分解电解液包括电解质、溶剂和添加剂,其性质会对电池的使用年限、比容量、倍率充放电性能和安全性能等产生影响。电解液中电解质和溶剂的分解都会引起电池容量发生损失。在首次充放电时,溶剂等物质在负极表面生成SEI膜会形成不可逆的容量损失,但这是必然情况。若电解液中存在水或氟化氢等杂质时,可能会使电解质LiPF6在温度较高的情况下发生分解,并且生成的产物与正极材料反应,导致电池容量受到影响。同时,部分产物还会与溶剂发生反应,并对负极表面的 SEI膜的稳定性造成影响,会造成锂离子电池性能衰减。除此之外,若电解液分解的产物不与电解液相容,将会在迁移过程中阻塞正极孔隙,从而导致电池容量衰减。总的来说,电解液和电池的正负极之间副反应的发生,以及产生的副产物,都是造成电池容量衰减的主要因素。
四、自放电锂离子电池在一般情况下,会发生容量损耗现象,这一过程被称为自放电,分为可逆容量损失和不可逆容量损失。溶剂氧化速率对自放电速率产生直接影响,正负极活性材料可能在充电过程中和溶质发生反应,导致锂离子迁移完成容量失衡及不可逆衰减,因此,可以看出减少活性材料表面积可以降低容量损失速率,且溶剂的分解会影响电池贮存寿命。另外,隔膜漏电也会导致容量损失,但这种可能性较低。自放电现象若长期存在,会导致金属锂沉积,并进一步导致正负极容量的衰减变化。
五、电极不稳定性充电过程中,电池正极的活性材料不稳定,会导致其与电解质发生反应,并影响电池容量。其中,正极材料结构缺陷、充电电势过高、炭黑含量都是影响电池容量的主要因素。
5.1 结构相变5.1.1 LiMn2O4尖晶石LiMn2O4在我国具有丰富资源,且价格低廉,具有较好的热稳定性,是电池正极的主要材料。LiMn2O4正极在高温环境下的储存及电池充放电循环过程中,都会导致电池容量发生衰减变化,其主要是由以下因素导致的:首先,在高电压条件下,电解液发生电化学反应,一般是高于4.0V;其次,LiMn2O4材料中含有的Mn在电解液中溶解,产生歧化反应,破坏了正极材料的晶相结构。
对于以LiMn2O4为正极,C为负极的锂离子电池,其会在高压状态下导致溶剂发生分解,并伴随着C负极的氧化反应,生成的氧化产物向正极发生迁移,并随着正极发生溶解反应。溶解后形成的二价锰离子将会在负极被还原,并与其他杂质共同沉积。而Mn的氧化物只会在负极靠近隔膜的方向发生沉积,而不会沉积在靠近集流体的方向,即Mn的氧化物仅沉积在SEI膜的表面,也正因为这样,才会导致电池容量发生衰减变化。将抑制剂加入电解液中,能够有效对金属离子的溶解状态形成抑制作用,并提升电池的循环性能。
除此之外,以LiMn2O4为正极,C为负极的锂离子电池在充放电过程中,随着锂离子的嵌入和脱出,可能会引起LiMn2O4的晶格常数变化,并在立方晶系和四方晶系间发生相转变。锂离子在正极材料内部的扩散速率比锂离子在正极表面的嵌入速率要低,当电位约为4V时,锂离子聚集于LiMn2O4表面,并发生Jahn-Teller效应,致使结构发生扭曲和转变,从而引起电池容量衰减。
5.1.2 LiCoO2LiCoO2在锂离子电池阴极材料中的应用具有较大优势,主要体现在能够可逆地实现锂离子的嵌入和脱离,并且具有较大的锂离子扩散系数、可逆插入量及结构变化程度,因此,对于提升锂电池充放电电流具有重要作用。同时,该材料结构稳定,锂离子的脱嵌可逆性较好,能够有效保证充放电的库伦效率及电池的使用年限。通过国内外相关学者对LiCoO2体系的容量衰减机理的研究,发现影响锂电池循环过程中容量衰减变化的因素主要是由于正极界面阻抗升高和负极容量的损失。
同时,相关学者还发现,循环次数越高,正极、负极的容量损失与全电池容量损失相比贡献降低,且活性锂离子迁移能力的下降,会对电池整体容量衰减产生更大的影响。并且由图1可知,电池循环次数>200次后,正极材料并未发生相变, 而LiCoO2层状结构规整程度降低,锂离子、铬离子的混排现象增加,使得锂离子难以有效脱嵌,从而导致电池容量衰减。另外,增加放电倍率会对锂、铬原子的混合产生促进作用,会导致 LiCoO2 原有的六方晶型转变为立方晶型,从而引起锂离子电池的容量衰减变化。
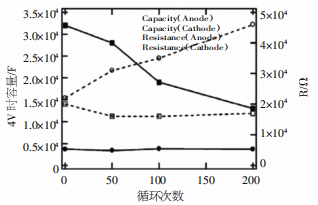
图1 循环过程中阻抗和容量变化曲线
另外,在LiCoO2体系中,通过对25℃(即常温状态下)和60℃中电池循环容量衰减规律的研究,可发现在150次循环前,60℃以下电池放电容量要比常温下电池容量和额定容量高,这是因为在高温状态下电解液黏度降低,使锂离子迁移速率提升,从而提高活性锂的利用率,电池表现出较高的充放电容量。当经过300次循环后,60℃下电池的极化容量损失要远高于常温状态下,可以看出温度升高加剧了锂离子电池充放电过程中电极的电化学极化,使得锂电池在充放电过程中容量损失更为严重。
5.1.3 LiFePO4LiFePO4的来源广泛、价格便宜,并具有良好的稳定和安全性能,能够达到170mAh/g的理论比容量,并且其比功率和比能量与LiCoO2相近,能够实现与电解质溶液的良好相容,因此,被广泛应用于锂电池正极。采用此种材料,对电池容量的影响因素主要包括以下两点:一是由于正负极之间发生副反应,致使可循环锂的减少,严重破坏了正负极之间的平衡;二是由于结构劣化、电极层离、材料溶解、颗粒离析等因素,导致活性材料产生损失,从而影响电池容量。
5.2 正极材料的炭黑含量由于炭黑本身是非活性物质,因此不参与放电反应,若正极材料中所含炭黑量过高,将会对正极材料的强度及容量产生影响,所以需要酌情添加。另外,传输载体在炭黑表面生成了具有催化性质的物质,其能够提升金属离子分解速率,并能够有效促进活性物质溶解。
六、总结综上所述,锂离子电池属于具有良好性能、污染较低的“绿色电池”,被广泛应用于我国各行各业之中,但锂离子电池的使用寿命会受到正极材料结构、炭黑含量、电极稳定性、自放电、电池内阻增加、电解质分解等因素的影响,导致电池容量衰减过快。为了提升锂离子电池的使用寿命,更好地为我国各领域的应用服务,需要重视对锂离子电池容量衰减变化及原因的分析,以促进我国各方面的可持续发展。
原文标题:锂离子电池容量衰减变化及原因分析
文章出处:【微信公众号:锂电联盟会长】欢迎添加关注!文章转载请注明出处。
责任编辑:haq
-
[讨论]讨论聚合物锂离子电池是否能替代锂离子电池2009-05-13 4926
-
锂离子电池的类型2013-05-17 4967
-
动力锂离子电池的安全性2013-05-25 3210
-
锂离子电池的性能2013-06-13 5486
-
锂离子电池的工作原理和使用注意事项2014-10-29 6319
-
锂离子电池和锂电池的区别2015-12-28 5686
-
【转】锂离子电池的维护和保存技巧分享2016-08-18 4769
-
锂离子电池的制造概述2017-02-27 4477
-
锂离子电池简介2020-11-03 2732
-
锂离子电池循环寿命影响因素及预测2021-04-22 3580
-
锂离子电池容量为什么会衰减?2016-12-01 12058
-
分析锂离子电池容量衰减的可能原因2018-03-26 13618
-
探索锂离子电池容量衰减之谜2018-07-30 10103
-
锂离子电池放电容量影响因素分析2022-09-27 7796
-
均匀化锂离子流解决锂离子电池“异常”容量衰减2022-11-28 2280
全部0条评论

快来发表一下你的评论吧 !

