

锂离子电池聚合物电解质导电机理是什么?
电池生产知识
26人已加入
描述
锂离子电池聚合物电解质导电机理是什么?
摘要:综述了锂离子电池聚合物电解质的导电模型,并介绍了近年来对聚合物导电机理的研究。
关键词:聚合物电解质;导电模型;导电机理
Ion conducting mechanism in polymer electrolytes for lithium ion batteries
SHAN Feng, LI Zhi-ming, YANG Jun, WANG Xin-ling
(School of Chemistry and Chemical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China)
Abstract: The ion conducting models for polymer electrolytes are illustrated. Additionally, the recent research progresses in polymer electrolytes for lithium ion batteries are introduced.
Key words: polymer electrolytes; conducting model; conducting mechanism
[1-5]。锂离子电池是指Li+经过电解质反复嵌入和脱嵌正极和负极材料的二次电池。它与传统的镉镍电池、镍氢电池相比具有以下许多优点:工作电压高、能量密度高、自放电率低及使用温度范围宽等。电解质是锂离子电池中的重要组成部分。聚合物电解质材料与传统的有机液体电解质材料相比有下列优点:其组装的电池质量比功率更高;安全性提高;形状可以进行柔性设计等。
[6]在上世纪70年代首次发现聚氧化乙烯(PEO)与碱金属盐络合物具有离子导电性以来,国内外学者对聚合物电解质进行了大量的研究,目前已经在聚合物电解质的结构、类型、分子设计和离子导电等方面取得了很大的进展。对于离子电导机理,特别是在聚合物单相及多相体系中的离子导电的基本理论问题,已经进行了大量的研究。
1. 聚合物电解质导电模型
1.1 VTF方程[7]
(1)
1.2 动态键渗透模型[8]
1.3 MN法则[9]
(2)
1.4有效介质理论[10]
(3)
2. 聚合物电解质导电机理
2.1 梳形聚合物电解质导电机理[11-17]
g,而且具有比单独主干结构的聚合物更大的运动自由度,可提供更强的链段运动,因而电导率较高。Borodin O等人[12, 18]通过对梳形聚合物Poly(epoxide ether)-LiTFSI体系研究认为,锂离子与氧化乙烯的相互作用既可以发生在分子内,也可以是分子间,如图1所示。分子间相互作用体系相对疏松,有利于离子快速传输。但是分子间相互作用的发生却会使Tg迅速增大。而分子内相互作用虽不会使Tg迅速增大,但形成的结构紧密,离子传输困难。因此它们之间的平衡对获得高的电导率是非常重要的。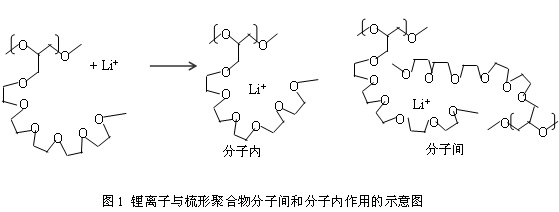

2.2超支化聚合物电解质导电机理[19, 20]
[21]对PEO基超支化SPE的研究发现,Tg与锂盐浓度的关系符合Di Marzio经典关系式,而且Tg-1与锂盐浓度的关系曲线斜率与Le Nest等人所作的PEO基交联SPE的斜率非常相近。这说明超支化聚合物虽然没有主链,但支化单元中的聚氧化乙烯链段也能够与锂盐发生相互作用,使锂盐解离并传输锂离子。超支化聚合物的Tg与支化单元数和末端单元数之间的平衡密切相关,末端单元数增加,Tg降低;支化单元数增加,则会由于核周围自由体积的减少,使Tg快速增加。所以超支化SPE的电导率受母体结构的影响很大。
图2 锂离子与聚合物分子间和分子内作用的示意图
[22]对多臂星形聚合物的研究认为,当“臂”中PEO链段较长时,如n=11.8,Tg较低,是由于锂离子与氧化乙烯的相互作用主要发生在分子内;而当“臂”中PEO链段数较少时,如n=3,Tg较高,则是由于没有足够的氧原子,锂离子与氧化乙烯的相互作用主要发生在分子间。与梳形聚合物电解质相比,长“臂”星形聚合物有更高的电导率。这是由于长“臂”星形聚合物是无主链大分子,臂的运动受限制较小,核的周围易于形成导电层。
2.3 两相聚合物电解质导电
[23]首先提出了两相聚合物电解质的概念(dual phase polymer electrolyte,DPE)。其中,一相以其优良的力学性能支撑整个聚合物电解质体系,另一相则为离子导电提供通路。最近,他们设计了一种拓扑结构的离子导电通路:混合乳胶DPE(mixed latex)。其结构示意图见图3。在混合乳胶中,极性乳胶粒、乳化剂共同形成离子导电区,其中富含锂盐溶液,这种DPE的离子电导率接近10-5 S cm-1。在核-壳结构的乳胶DPE中,极性聚合物稳定剂包裹在非极性聚合物核上,形成一层极性聚合物壳,当聚合物主体物形成后,乳胶粒崩溃,乳胶核部分地融合形成支撑聚合物相。另一方面,含浸锂盐溶液后极性壳层区域形成离子导电相。
图3 混合乳胶的拓扑结构的示意图
2.4 复合聚合物电解质(CPE)导电机理
[24-26]等认为这是因为加入无机粉末填料抑制了聚合物基体的结晶,同时聚合物链与粉末粒子存在某种特定的作用而造成的。研究表明,因为粉末填料尺寸小,比表面积大,其位阻效应抑制了聚合物(如PEO)链的结晶,所得CSEP无序度高,有利于离子迁移。未加纳米粉末的SEP其电导率随时间增加而逐渐降低,而加入纳米粉末的CSPE其电导率随时间增加还略有增大。这可能是因为纳米粉末粒子与SPE之间存在某种特定的作用。有研究表明,当温度很高时(高于70℃),CSEP的离子电导率比相应没有添加无机粉末的聚合物电解质的仍提高了很多。这不能仅仅归因于CSPE无序度提高,因为在此温度下,未添加无机粉末的SPE其聚合物本身结构已是无定型的。Croce. F[27, 28]等认为在PEO8LiClO4体系中具有路易斯酸性的无机粉末的极性表面基团可作为PEO链段与阴离子“交联”的中心,提高了体系整体的刚性,降低了PEO链的重结晶倾向。同时他们通过测定Li+迁移数以及对结晶动力学的分析研究,提出无机粉末极性表面基团作为路易斯酸碱作用中心,降低了离子的偶合,并通过形成“离子-无机粉末复合物”促进盐的离解,在粉末表面为Li+提供了导电通道。研究表明纳米无机粉末的加入可以改善聚合物电解质的迁移属性。研究发现,含有路易斯酸性最强的TiO2的体系室温电导率最高,可达10-5S/cm,而且界面稳定性好,与锂电极组成的电池循环效率可达99%。研究者曾认为纳米无机粉末在聚合物电解质中起到固体增塑剂的作用,但是最近的研究表明纳米粉末的作用并非如此,所观察到的增塑效应是来自聚合物电解质中残余的溶剂,并指出纳米粉末的存在使Li+与聚合物的作用减弱,Li+的迁移是在一个具有某种程度的连续的导电通道里进行的,导电通道是由无序的离子簇和分散的纳米粉末相互作用形成的,离子迁移与聚合物链的链段运动并无太大的关系。电导率的提高与形成的聚合物-无机粉末界面有关,在界面上存在着大量的晶体缺陷,这些缺陷可以形成离子导电通道,允许离子以较低迁移活化能通过,从而CPE体系有较高的电导率,这同时也能解释为什么无机粉末颗粒较细时有利于提高电导率。Sun,H.Y[29]等研究了加入铁电粉末BaTiO3制备的CPE,在25~115℃的温度范围内,加入粒径为0.6~1.2μm的BaTiO3粉末能提高电导率和迁移数。Sun认为电导率提高的原因是铁电材料的自发极化和与醚氧原子之间的相互作用使PEO链的偶极矩增加,从而使界面区电导率增加;同时,铁电颗粒的表面电荷与盐组分的静电作用能使自由离子稳定,使盐溶解平衡向解离方向移动;此外,BaTiO3颗粒的表面电荷还可在成核过程中充当成核中心,由于较高的成核速而使非晶的比例增大。因此,即使加入很少量的BaTiO3粉末,CPE的电导率然有较大幅度的提高。
2.5 不同盐的浓度对导电机理的影响
[30]从离子传导机理上对PEO-LiX体系EO与Li+的摩尔比与电导率之间的关系进行了研究。结果表明,在PEO-LiX复合物中当ELiCF3SO3的摩尔比为3:1时,从粉末衍射图谱上看,Li+和CF3SO3-都被螺旋形的PEO链缠绕,每个Li+与聚合物中三个氧原子和两个CF3SO3-络合,其中CF3SO3-与相邻的两个Li+络合,分子链间只存在范德华力,不存在交联,阴离子和阳离子都从EO螺旋线中的空间运动。当E LiCF3SO3摩尔比为6:l时,复合物晶体结构发生变化,PEO长链不再为螺旋形排列,而是两根PEO长链围绕成圆柱形通道,Li+在圆柱轴线上排列,每6个EO单元构成一个络合单元,每个Li+被五个醚氧原子络合,阴离子不参与络合,而是在圆柱体外排列成行。因此,Li+迁移不受阴离子束缚,且在圆柱形这种特殊的离子通道中,一个络合单元中只有五个醚氧原子被络合,剩下的一个自由氧原子可协助Li+在通道中跃迁,因此在6:1的结构中,离子迁移率比任何其它结构中都要高,但此时可供迁移的电荷载流子少,导致电导率不是很高。在E LiCF3SO3为1:1的晶体结构中,PEO链呈锯齿形排列,每个Li+与两个醚氧原子和4个阴离子络合,同时,每个阴离子又与4个Li+络合,这四个Li+可来自同一条PEO链,也可来自相邻的PEO链段,从而导致聚合物链间交联,聚合物Tg升高,这也即盐浓度过高电导率反而下降的原因。
4 展望
参考文献
3SO3-EC/DMC-PAN hybrid films[J]. Polymer-Korea, 1998, 22(5): 765-769.
3 suspension with inorganic salts[J]. Journal of the Ceramic Society of Japan, 2003, 111(2): 117-121.
4[J]. Journal of Polymer Science Part a-Polymer Chemistry, 1997, 35(9): 1839-1847.
4 based composite electrolyte-lithium electrode interfacial resistivity[J]. Journal of Power Sources, 2006, 159(1): 405-411.
4-lithium electrode interfacial resistivity[J]. Journal of Power Sources, 2006, 159(1): 438-442.
声明:本文内容及配图由入驻作者撰写或者入驻合作网站授权转载。文章观点仅代表作者本人,不代表电子发烧友网立场。文章及其配图仅供工程师学习之用,如有内容侵权或者其他违规问题,请联系本站处理。
举报投诉
- 相关推荐
- 热点推荐
- 聚合
-
[讨论]讨论聚合物锂离子电池是否能替代锂离子电池2009-05-13 4928
-
聚合物锂电池的生产2013-05-10 3917
-
锂离子电池的类型2013-05-17 4968
-
聚合物锂离子电池的构成2013-06-06 3348
-
聚合物锂电池工作原理表现2013-06-14 3838
-
聚合物锂电池和锂电池区别是什么?2017-09-14 4948
-
锂电池VS聚合物锂电池,谁才是未来的主角?2018-08-17 7070
-
聚合物锂离子电池详解2008-02-24 2545
-
聚合物锂离子电池有哪几类?2009-10-26 2075
-
什么是聚合物锂离子电池?2009-11-13 2298
-
锂离子电池聚合物电解质导电机理2009-12-09 2693
-
聚合物锂离子电池的特点介绍资料免费下载2018-11-26 1428
-
锂离子电池堆电解质的要求及对电池性能的影响2020-12-30 5382
-
锂离子电池和聚合物锂电池的安全性能一样吗?2022-12-01 2826
-
聚合物锂电池是什么 锂离子电池和聚合物锂电池的区别2024-03-07 3187
全部0条评论

快来发表一下你的评论吧 !
×
20


完善资料,
赚取积分
赚取积分
