

高压充不上去,循环不好究竟是为何?
描述
第一作者:Seongjae Ko
通讯作者:Atsuo Yamada
通讯单位:日本东京大学
【研究亮点】
1. 本文中作者报告了一个在高压离子电池中被忽视但却很关键的问题:阴离子嵌入到阴极导电碳中。
2. 作者提出了一种基于环丁砜(SL)的浓缩电解质,该电解质可通过两种机理防止阴离子的嵌入:
1) 通过其强大的阴离子-Li+相互作用来提供高的嵌入激活障碍;
2) 通过形成含硫,阴离子封闭的SL衍生的中间相。
3. 该电解质与具有氧化稳定性但通常易于阴离子嵌入的石墨化乙炔黑一起使用,可实现Li2CoPO4F/石墨全电池的稳定运行,容量保持率达93%,经过1000次循环后,平均库仑效率≥99.9%。这是在商业水平上增强》5V锂离子电池可逆性的关键策略。
【研究背景】
具有高能量密度的下一代锂离子电池对于开发先进的电子设备(例如移动电话和电动汽车)至关重要。
为此,许多研究人员致力于提高电池的工作电压,这是提高能量密度的最简单方法。然而,由于此类高压电池的循环稳定性差,目前为止尚未实现高压全电池。电池的循环性差在很大程度上归因于高压电池的阴极问题,即电解质的氧化分解和阴极材料的降解以及由此产生的过渡金属的溶解问题。
为了解决这些问题已经进行了许多研究。主要有两种解决方法:(1)通过形成钝化层(阴极-电解质中间相,CEI)来防止电解质与阴极直接接触;(2)通过清除可加速阴极材料降解和过渡金属溶解的HF酸来缓解阴极材料的降解以及由此产生的过渡金属的溶解问题。
尽管如此,也只有少数的全电池能实现》5V工作。此外,这些电池的循环性能离商业化的实际要求还很远。因此,仍然需要解决一些基本问题才能实现高压的稳定循环电池。
为了克服高压阴极的不良电子导电性,常常需要引入导电碳(例如,乙炔黑)作为添加剂或表面涂层剂。
但是,碳材料的表面积通常是正极活性物质的表面积的数十倍乃至数千倍。因此,它是电解质氧化的主要反应部位。更重要的是,电解质中的盐阴离子可以在大于4.5 V的高电势下插入碳的层间空间。重复的阴离子嵌入/脱嵌在充放电循环中不可逆转地破坏碳的层状结构(如图1a所示)。
这会产生大量的缺陷,这些缺陷会充当新的活性位点,从而加速电解质的氧化和碳的降解,并导致电极电子传导性的损失,从而导致循环稳定性差。特别是当碳的石墨化程度较高时,阴离子插层在碳中更容易发生。如图1b所示,高度石墨化的导电碳由于sp2-杂化的晶体结构良好排列,不仅可以提高电导率,而且还可以最大程度地减少表面寄生反应(电解质和碳的降解)。
图1 高电位阴极中导电碳上的寄生反应
尽管阴离子插层会带来严重的后果,但与其他众所周知的问题相比,很少有人研究这个问题,且它在高压电池容量衰减中的作用似乎被低估了。在本文中作者认为,阴离子嵌入导电碳中是高压锂离子电池的关键问题之一。
因此为了抑制阴离子的嵌入,作者使用了浓缩的LiBF4电解质,其中BF4阴离子与Li+强烈配位。由于BF4阴离子必须首先从Li+解离,因此这为阴离子插层提供了很高的活化势垒。此外,作者还采用了环丁砜(SL)作为电解质溶剂在导电碳上形成含硫,阴离子阻断的CEI。通过将浓缩的LiBF4-SL基电解质与石墨化乙炔黑结合使用,作者成功实现了具有极高的循环周期的Li2CoPO4F/石墨全电池。
【结果与分析】
抑制阴离子插层
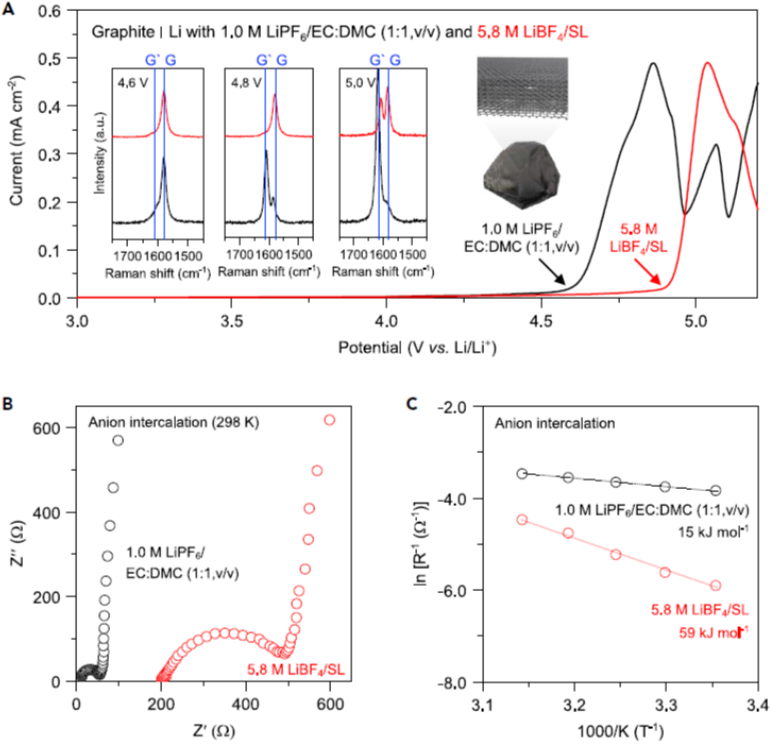
图2 浓缩的LiBF4/SL电解质中的阴离子碳插层延迟效应
阴离子的插入行为取决于电解质中盐和溶剂的组合和浓度以及碳的石墨化程度。首先,作者使用石墨电极作为导电碳模型,因为它极易受阴离子嵌入的影响,且其结构使我们能够轻松地分析插层反应。如图2A所示,作者使用石墨电极在具有不同浓度的SL型电解液中和商用1.0 M LiPF6 /碳酸亚乙酯(EC):碳酸二甲酯(DMC)进行了线性扫描伏安法(LSV)。
与商业的电解质相比,在1.0 M LiBF4/SL(4.78 V对Li/Li+)中,阴离子插层的起始电位略有上升,而在接近饱和的5.8 M LiBF4/SL(4.90 V对Li/Li+)中,阴离子插层的开始电位进一步上升(4.59 V vs.Li/Li+)。记录的原位拉曼光谱进一步支持了5.8 M LiBF4/SL在石墨电极的恒电流循环中抑制的阴离子嵌入(图2A)。
为了更多地了解电解质对阴离子嵌入的影响,使用三电极电池中的石墨电极进行了循环伏安法(CV)测试。1.0 M LiPF6/EC:DMC和1.0 M LiBF4/SL之间的嵌入电位差异不明显。相比之下,在5.8 M LiBF4/SL中插层势显着升高。
电位的这种上移与基于能斯特方程中负离子活性增加而引起的电位降低的预期相矛盾,表明存在动力学因子。电化学阻抗谱(EIS)分析结果表明,在高盐浓度下,阴离子插层到石墨中的界面阻力显着增加(图2b)。
尤其是,在5.8 M LiBF4/SL中界面阴离子转移的活化能为59 kJ mol-1,比1.0 M LiPF6/EC:DMC(15 kJ mol-1)和1.0 M LiBF4/SL(15 kJ mol-1)的活化能高近四倍(图2c)。这些结果表明高盐浓度可延迟阴离子插层。
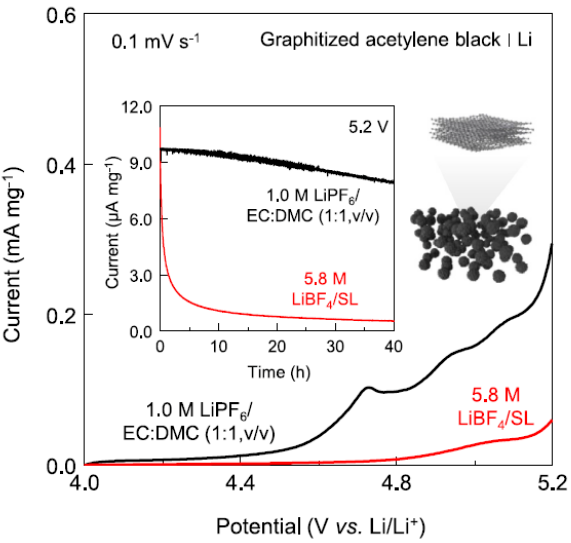
图3 通过抑制阴离子插层抑制石墨化乙炔黑上的寄生反应
此外,作者还对具有不同石墨化程度的导电碳粉(乙炔黑)进行了LSV和电化学浮动测试(图3)。在1.0 M LiPF6/EC:DMC中,石墨化乙炔黑中LSV中的阳极电流和5.2 V时的泄漏电流远高于非晶乙炔黑。这是因为阴离子插层随着石墨化程度的增加而活跃地发生。相比之下,5.8 M LiBF4/SL显示相反的趋势并且电流低得多,表明阴离子插层被成功压制。
阴离子延迟嵌入的机理
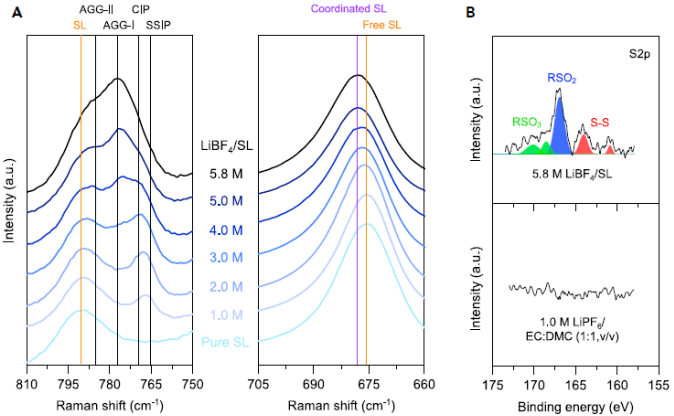
图4 溶液结构和表面化学解释了阴离子插层的延迟
为了阐明5.8 M LiBF4/SL电解质中阴离子延迟嵌入的机理,通过拉曼光谱分析了其溶液结构。如图4A所示,随着盐浓度的增加,BF4阴离子的拉曼光谱带从767 cm-1逐渐上移,表明从溶剂分离的离子对(SSIPs; BF4阴离子不直接与Li+配位)到接触离子对(CIPs;一个BF4阴离子与一个Li+离子配位)和聚集簇(AGGs; BF4阴离子与两个离子或更多的Li+离子配位)进行更广泛的离子对。
换句话说,在较高的盐浓度下,BF4-–Li+的配位作用增强。这意味着BF4阴离子从Li+离子解离并插入碳材料的层间空间需要更高的活化能,这与图2B,2C中所示的结果一致。因此,作者有力地表明了浓缩电解质独特的以AGG为主的溶液结构可出色地抑制阴离子的嵌入。
此外,已知SL溶剂会形成基于亚硫化合物的CEI,可防止阴极与电解质直接接触,同时实现阳离子交换。实际上,在5.8 M LiBF4/SL中循环的碳表面上检测到了含硫化合物(图4B)。这表明SL衍生的CEI还可以通过防止与电解质直接接触以及延迟阴离子向碳表面的扩散来稳定导电碳。
值得注意的是,与其他浓电解质和氟化溶剂(碳酸氟亚乙酯,FEC)基电解质相比,5.8 M LiBF4 / SL中的寄生反应实现了最小化。
与通常的看法相反,高压电池的循环稳定性可以通过确保电解质的氧化稳定性来实现,作者证明抑制阴离子嵌入碳材料中也是必不可少的。而且,这些结果表明碳表面设计对于防止阴离子不仅与电解质而且还与表面官能团,涂层剂和粘合剂的嵌入至关重要。
长期循环稳定性Li2CoPO4F/石墨全电池
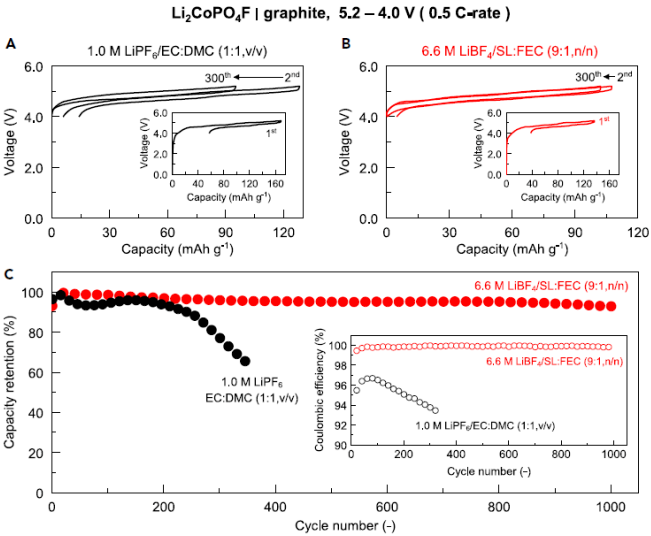
图5.具有超长循环寿命的Li2CoPO4F /石墨全电池
为了确保石墨阳极的高度可逆性,支持有效形成固体电解质相间(SEI)层的FEC作为助溶剂引入了5.8M LiBF4/SL电解质体系。
所开发的6.6M LiBF4/SL:FEC电解质改善了石墨阳极的库仑效率和循环性能,同时保持了5.8 M LiBF4/SL电解质的优点,因为它抑制了阴离子的嵌入并使Li2CoPO4F/Li半电池稳定循环。电压为4.8 V且能长期循环的Li2CoPO4F/石墨全电池如图5所示。
Li2CoPO4F/石墨全电池可达到高达5.2 V的截止电压,并且电池在1,000次循环后保留了93%的初始放电容量(每个循环仅损失0.007%的容量),平均库仑效率大于等于99.9%。这种空前的循环性能归因于抑制阴离子插入导电碳中,增强了氧化稳定性以及减少了过渡金属从Li2CoPO4F阴极中的溶解。
编辑:jq
-
串口究竟是什么呢?2023-04-12 23262
-
retain,copy与assign究竟是有什么区别呢2021-09-30 1544
-
无片外电容LDO究竟是什么?2021-06-22 3254
-
spec究竟是什么?有谁可以分享一下吗2021-06-21 2296
-
一文读懂eMMC究竟是啥?2021-06-18 3909
-
分贝究竟是什么?如何去理解它?2021-05-31 2201
-
真正软件定义无线电究竟是怎样的?2021-05-14 1648
-
电感饱和究竟是什么2021-03-11 2822
-
我们仿真DDR究竟是仿真什么2021-03-04 2273
-
S参数究竟是什么?2021-03-01 2696
-
图解:IGBT究竟是什么?2020-08-10 2661
全部0条评论

快来发表一下你的评论吧 !

