

一种基于液滴微流控系统的高通量功能型抗体筛选方法
描述
PD-1/PD-L1免疫检验点拮抗型抗体在肿瘤免疫治疗领域取得突破性进展,近年来双特异性抗体T细胞接合器(T Cell Engager)和靶向共刺激受体的激动型抗体迎来了开发的浪潮。然而,免疫激动型抗体的开发具有很大的挑战,需要综合抗体亲和力、表位、效价、簇形成、Fcγ受体相互作用、受体占用率等多方面的考虑。
生物科技支柱技术噬菌体展示技术巧妙的实现了蛋白表型和基因型的偶连,从而可以基于亲和力对上亿种分子进行高效筛选。激活型抗体的筛选只能依赖于对几千个抗体逐个纯化、表达和和检测,因此药物研发领域迫切需要开发一种高通量的激活型抗体筛选方法。
近日,南开大学张宏恺课题组与高诚生物医药有限公司、上海科技大学及上海交通大学合作在Science Advances期刊上发表题为High throughput functional screening for next generation cancer immunotherapy using droplet-based microfluidics的文章。

研究团队开发了基于液滴微流控系统的高通量功能型抗体筛选技术(图1),首先构建慢病毒抗体文库并用该文库感染细胞,每个细胞仅被一个病毒感染从而每个细胞分泌一种抗体;之后通过液滴微流控系统将单个抗体分泌细胞与单个报告细胞共包裹在同一个微液滴中,每一个液滴相当于一个独立的微型反应器,互不影响;细胞在液滴中培养后,通过荧光激活液滴分选(FADS)系统,分选出含有激活报告细胞的液滴,液滴微流控系统可以在数小时实现对数百万个液滴的生成和分选;随后,从液滴中回收抗体分泌细胞、扩增并进行下一轮筛选;经过多轮筛选后从富集细胞中提取抗体基因进行测序,从而确定活性抗体的序列。
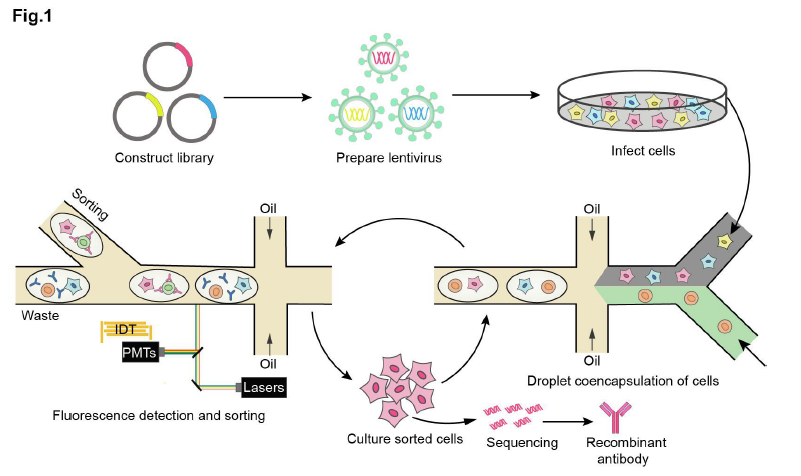
图1 基于液滴微流控系统的高通量功能型抗体筛选技术流程图
研究人员利用基于液滴微流控系统的高通量功能型抗体筛选技术筛选CD40受体的激动型抗体。经过两轮筛选后,研究人员对初始文库和两轮筛选后的抗体库进行三代测序及生物信息学分析,发现一些抗体实现了逐轮的富集,对富集程度最高的5个抗体进行表达纯化和验证发现5个抗体都是CD40的强激动型抗体。研究人员利用该方法筛选出了初始频率仅有0.02%的活性抗体,而初始文库中比例很高的无活性抗体在筛选过程中被逐轮淘汰。值得一提的是,基于该平台筛选出的CD40激动剂抗体C04,在小鼠模型中有效激活免疫系统并抑制肿瘤生长,未经任何优化的C04抗体的安全性和有效性均媲美临床试验中的CD40激动型抗体CP870893。另外,研究人员利用该方法经过一轮筛选即获得多个anti-Her2×anti-CD3双特异性抗体T细胞接合器。
该论文报道了一种基于液滴微流控系统的高通量功能型抗体筛选方法,有效实现了基因型和活性表型的耦合,使得从百万种多样性的抗体中快速筛选活性抗体成为可能,且节约了人力和资金的投入,将能够促进下一代肿瘤免疫疗法药物的开发。同时,该研究范式将能够应用于多肽和细胞因子改造、细胞间通讯和TCR与新生抗原配对等多方面的研究。
南开大学助理研究员王媛博士和博士生晋瑞娜为论文共同第一作者,高诚生物沈冰清博士和上海科技大学王玮博士做出了关键贡献。
责任编辑:lq
-
三站全功能型多用吸附仪3Flex高通量可同时进行2014-03-10 2847
-
微流控液滴芯片:应用于基础的材料筛选和材料筛选2018-01-10 5685
-
基于旋转圆台的非微流控高通量微液滴生成装置2019-06-10 3180
-
曙光计算服务:高通量材料计算和筛选的概念介绍2021-12-08 3893
-
电压放大器在液滴微流控芯片的功能研究中的应用2023-02-14 1430
-
用于超高通量筛选的荧光偶联液滴微流控策略研究进展2023-06-05 1746
-
用于高通量单液滴的操纵和生成的有源矩阵数字微流控芯片2023-08-14 3669
-
惯性微流控器件的微制造方法2023-11-02 1900
-
电压放大器驱动液滴微流控芯片关键功能实现研究2025-07-30 547
全部0条评论

快来发表一下你的评论吧 !

