

一种复制肺泡结构和功能的人类肺部芯片
描述
伴随呼吸产生的肺部不断扩张和回缩运动不仅仅保障基本的肺部功能,如促使空气交换增强液的产生以及维持肺部组织的结构,它还能产生针对入侵病毒的免疫反应。
据麦姆斯咨询报道,近期,哈佛大学威斯生物启发工程研究中心(Wyss Institute for Biologically Inspired Engineering, Harvard University,简称Wyss研究中心)开发了一种复制肺泡结构和功能的人类肺部芯片。进一步研究发现,应用模拟呼吸运动的机械力可以通过激活保护性的先天免疫反应来抑制流感病毒的复制。他们还发现了几种药物,可以用于减少肺泡感染过程中炎性细胞因子的产生,这可能有助于治疗肺部过度炎症。该研究的相关成果以论文形式发表在Nature Communications。
Wyss研究中心技术开发研究员Haiqing Bai博士表示:“这项研究证明了呼吸运动对人类肺功能如感染免疫反应的重要性,以及我们开发的人类肺泡芯片对于模拟肺部,尤其是更易受感染的肺部深处反应的有效性。该模型还可用于临床前药物测试,以确保候选药物确实能减少功能性人类肺组织中的感染和炎症。”
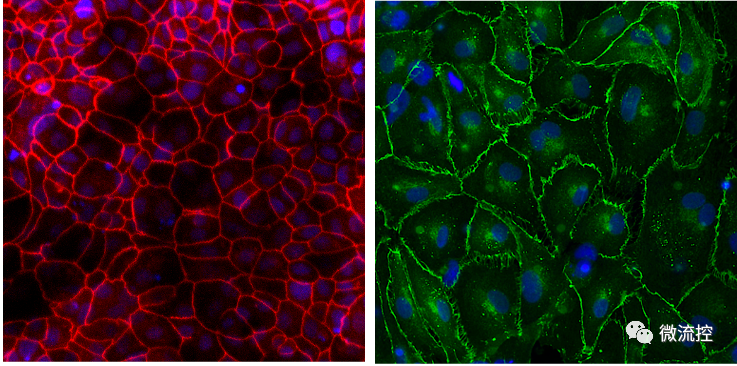
为了明确这些深肺空间如何产生针对病毒入侵者的免疫反应,研究人员在肺泡芯片中模拟了流感感染过程。其具体操作方法如下:首先在器官芯片的两个平行微流控通道中排列了不同类型的活人体细胞——上部通道中的肺泡细胞和下部通道中的肺血管细胞,以重建人体气囊与其血液输送毛细血管之间的界面。为了模拟肺泡在人肺中所经历的情况,将由肺泡细胞排列的通道充满空气,同时将血管通道灌注含有通常通过血液输送的营养物质的流动培养基。通道被一层多孔膜隔开,允许分子在通道之间流动。
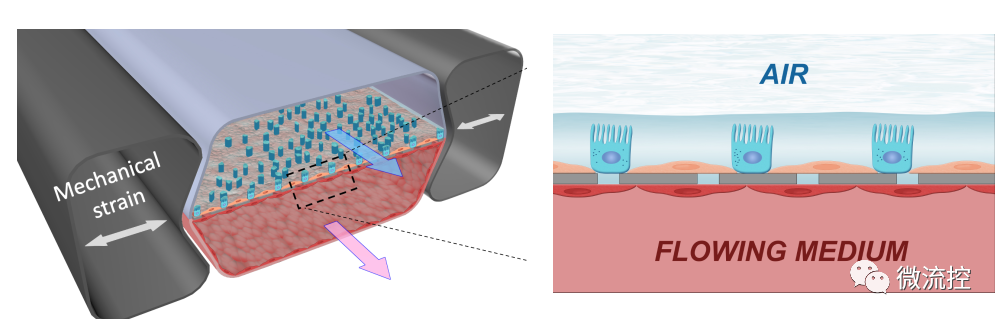
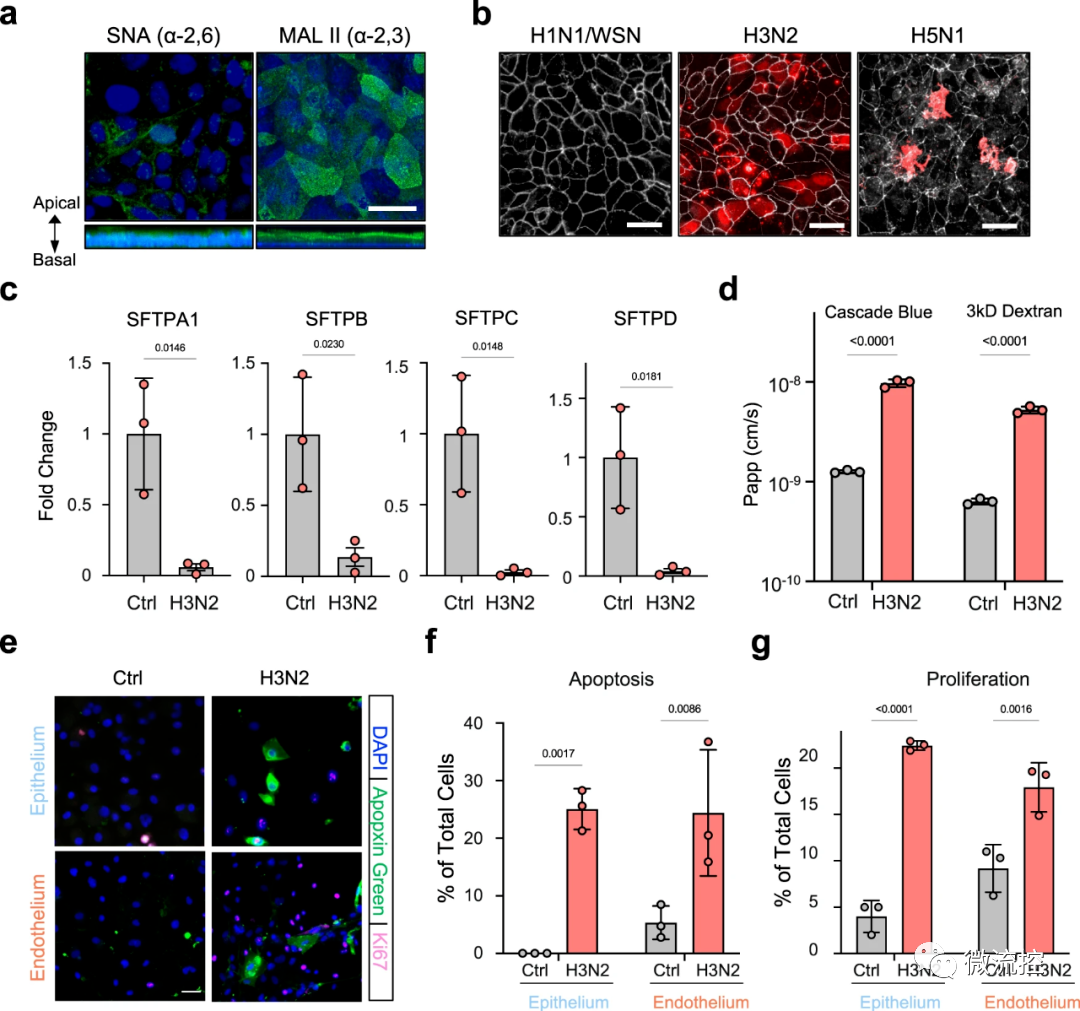
接着研究人员将H3N2流感病毒引入空气通道,以此来感染肺泡芯片,并成功观察到流感感染的已知标志的发展,包括细胞间连接的破坏、细胞死亡增加25%以及细胞修复程序的启动。感染还导致血管通道中多种炎性细胞因子水平升高,包括III型干扰素(IFN-III)——这是一种抵御病毒感染的天然防御措施,在体内出现流感感染时将被激活。
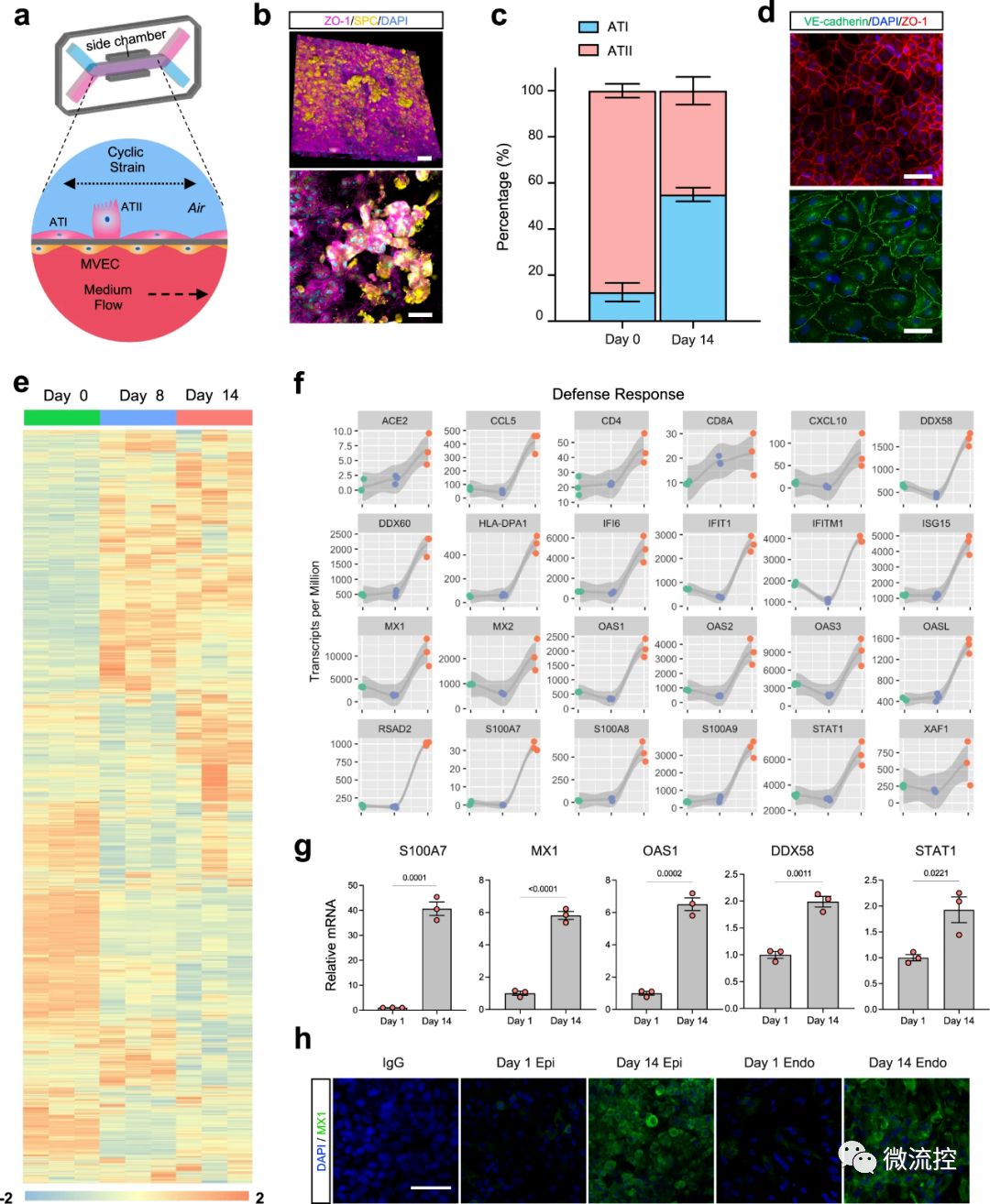
此外,受感染芯片的血管细胞表达了更高水平的粘附分子,这使得灌注培养基中的包括B细胞、T细胞和单核细胞在内的免疫细胞能够附着在血管壁上,以帮助抵抗感染。这些结果证实,肺泡芯片对H3N2产生了免疫反应,重现了感染流感病毒的人类患者肺部发生的情况。
然后,研究人员在没有机械呼吸动作的情况下进行了同样的实验。令他们惊讶的是,与静态芯片相比,暴露于呼吸运动的芯片在其肺泡通道中的病毒mRNA减少了50%,炎症细胞因子水平显著降低。遗传分析表明,机械应变激活了与免疫防御和多个抗病毒基因相关的分子途径,当周期性拉伸停止时,这些激活被逆转。
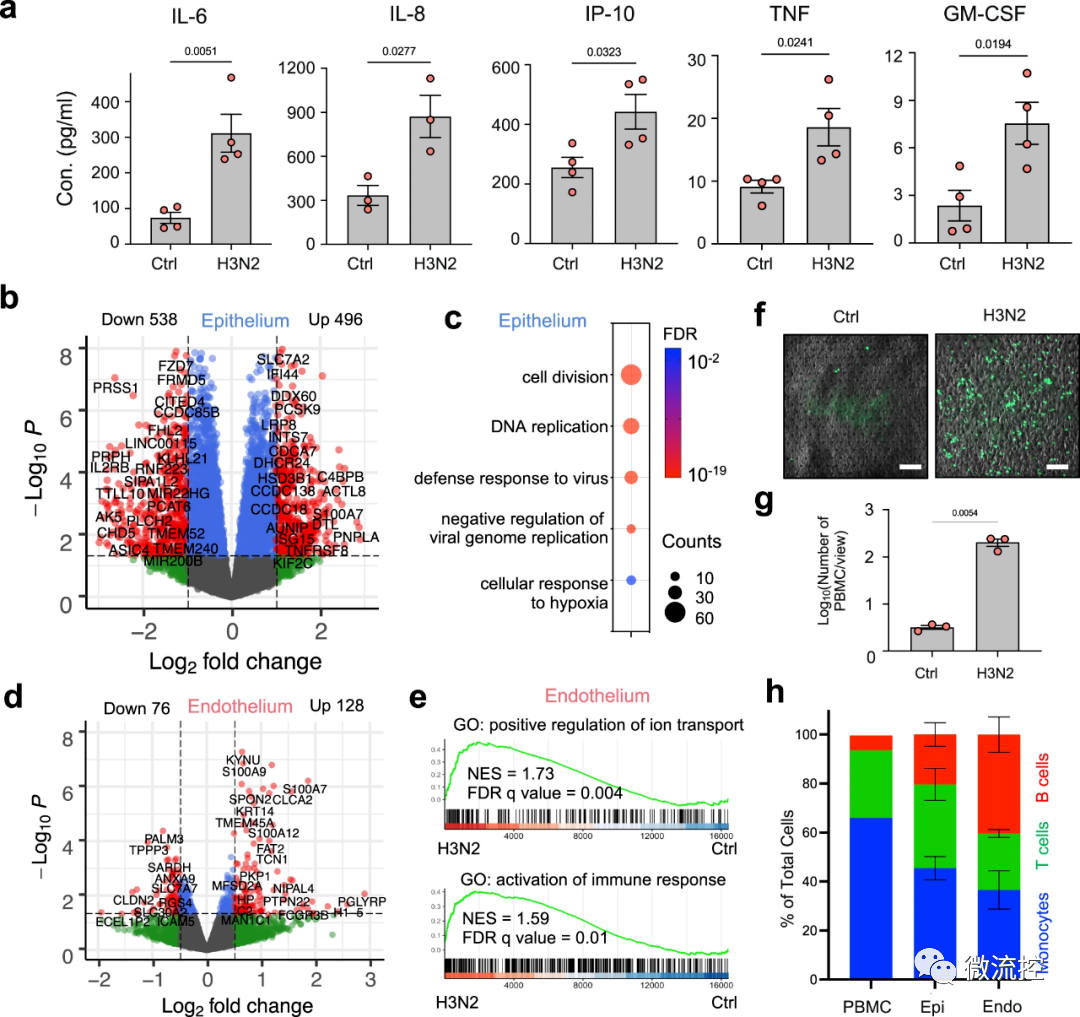
前Wyss研究中心技术开发研究员、现中国科学院深圳先进技术研究院教授司龙龙博士表示:“这是我们最出人意料的发现,单是机械应力就可以在肺部产生先天免疫反应。”
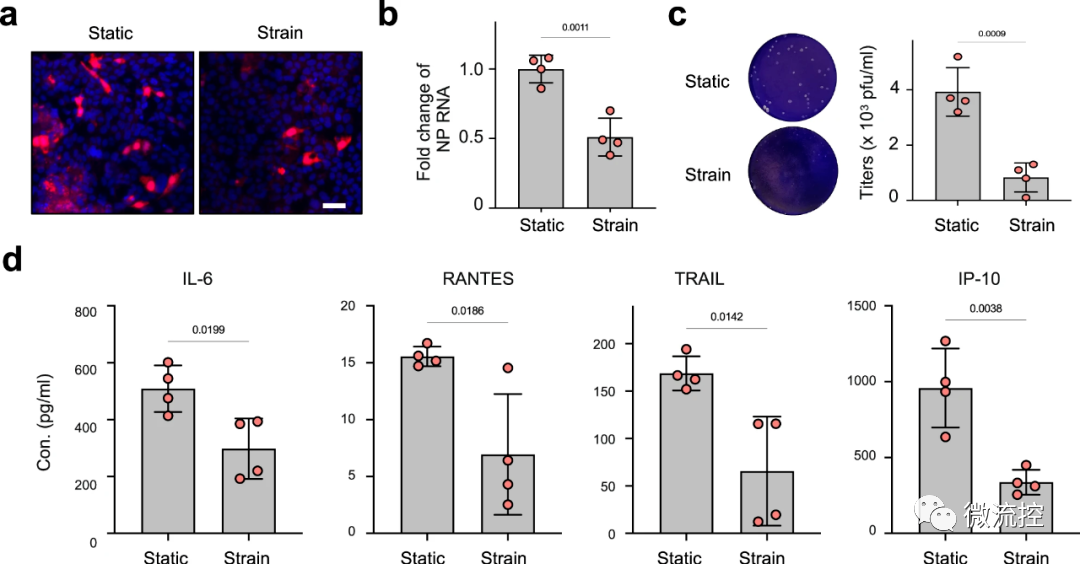
这也阐明了在一些病理状态下肺部炎症发生的原理,例如当患者罹患慢性阻塞性肺病(COPD)或使用机械呼吸机时,其肺部压力会增加到10%,从而导致先天免疫反应基因和过程的增加,诱导炎症细胞因子水平的提升,从而引起慢性炎症和肺损伤。
然后,研究人员进一步比较了应变和静态肺泡芯片中细胞中的RNA,以确定呼吸运动是如何产生免疫反应的。他们发现了一种钙结合蛋白S100A7,该蛋白在静态芯片中未检测到,但在应变芯片中高度表达,表明其产生是由机械拉伸诱导的。他们还发现,S100A7表达的增加上调了与先天性免疫反应有关的许多其他基因的表达,包括多种炎性细胞因子。
S100A7是已知与细胞膜上一种叫做晚期糖基化终末产物受体(RAGE)的蛋白质结合的几种相关分子之一。RAGE在肺中的表达通常显著高于在人体其他器官中的表达,并且被认为是几种肺部疾病的主要炎症介质。药物阿齐瑞格(Azeliragon)是一种已知的RAGE抑制剂,研究人员利用Azeliragon对应变肺泡芯片的血管通道进行为期48小时的灌注,然后用H3N2病毒感染芯片。这种预处理可以有效预防细胞因子风暴样反应,而联合给药莫纳皮拉韦(Molnupiravir,新冠口服药)可以增强这一效果。
这些研究结果引起了拥有Azeliragon专利权的Cantex Pharmaceuticals的注意,并于2022年初授权Azeliragon用于治疗新冠肺炎(COVID-19)和其他炎症性肺病。鉴于该药物在之前的III期临床试验中良好的安全记录,该公司已申请FDA批准在COVID-19患者中开始II期试验,并计划随后针对包括COPD和激素抵抗性哮喘在内的其他疾病进行额外的II期试验。
论文链接:
https://doi.org/10.1038/s41467-022-29562-4
审核编辑 :李倩
-
什么是基于Zynq的人类生理模拟系统?2019-08-01 1603
-
如何设计一种节能的人体感应开关?2021-03-10 2389
-
求一种基于FPGA芯片的高速智能节点的硬件结构和软件设计2021-05-06 888
-
为什么复制电路结构一定要用二极管连接呢2021-09-28 1001
-
一种系统芯片的功能测试方法2009-12-21 1083
-
一种多功能输出开关电源2009-07-15 1263
-
一种面向负载平衡的主动复制技术2012-04-18 662
-
一种VLD结构VDMOS终端设计2017-01-07 836
-
一种实用的人体接近探测器电路2017-01-22 899
-
一种帧内微块复制算法2017-12-15 963
-
一种复制和粘贴URL的新方法2020-12-21 4682
-
研究人员制造出一种复制人类的行为下棋的AI2021-02-23 2101
-
一种编码解码模式的肺分割算法2021-04-13 990
-
一种具有触觉、感官扩展和交互功能的人工智能角膜2023-11-15 1585
-
一种能够模拟人类手指触觉的人工感知系统可高分辨率识别精细纹理2023-11-20 1768
全部0条评论

快来发表一下你的评论吧 !

