

名为“miniJoint”的多组织膝关节器官芯片
描述
关节疾病拥有非常庞大的患者群体,仅骨关节炎(OA)患者在全球范围内就有3.43亿之多。关节疾病使患者行动力和灵活性受限,同时伴随着不同程度的疼痛,严重降低病人生活质量。随着中国以及世界人口的老龄化及肥胖人群的增加,关节疾病所带来的经济社会负担将持续加大。
目前,包括OA在内的很多关节疾病尚无有效的治疗药物。新药研发面临着超长研发周期、巨大研发成本和极低的成功率等挑战,其背后的原因包括现有测试模型的固有局限(如动物和人之间的种间差异)、对于病因的认知不足以及病人之间的个体化差异等。因此,建立具有临床相关性及高通量筛选能力的精准模型是药物研发面临的紧迫的任务。
据麦姆斯咨询报道,为解决以上问题,来自匹兹堡大学(University of Pittsburgh)的研究团队利用骨髓间充质干细胞(hBMSC),构建了名为“miniJoint”的多组织膝关节器官芯片。该研究的相关成果以论文形式发表在Advanced Science。
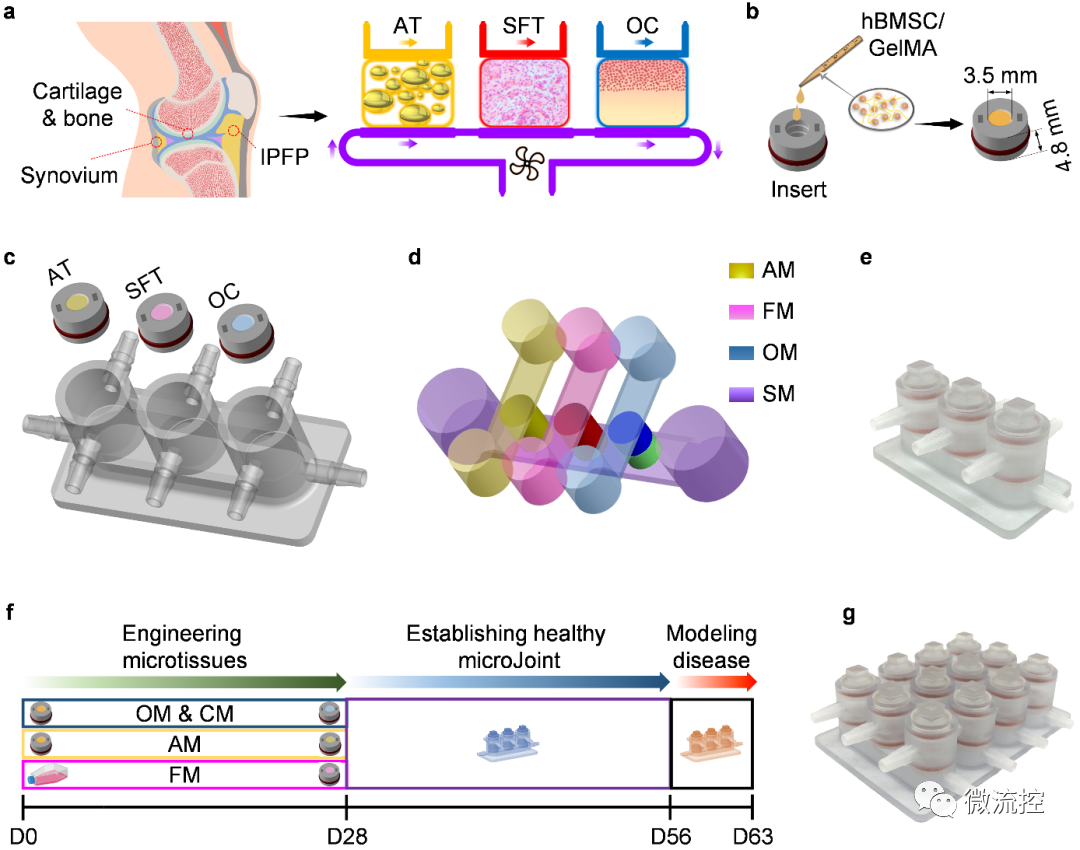
膝关节器官芯片miniJoint的构建流程
首先,研究人员收集了20名捐献者的hBMSC并将其包覆在水凝胶支架中。研究者利用组织工程原理诱导hBMSC进行21-28天的定向分化,获得了具有膝关节软骨-软骨下骨(cartilage-subchondral bone)、滑膜(synovium)和膑下脂肪垫(IPFP)表型的三维组织(组织名称分别为OC、SFT和AT)。为了在同一支架中获得软骨-软骨下骨这一双相组织,研究者利用3D打印制备了一个双通道生物反应器,对支架两端的hBMSC使用不同的生长因子进行刺激。经过28天的动态三维培养,形成了紧密接触、自然过渡、两相可相互交流的OC组织。
随后,研究者将各组织整合于3D打印的芯片腔体中,构建多组织的miniJoint器官芯片。在miniJoint芯片中,OC的软骨部分和AT、SFT共享“模拟关节滑液”的培养基,并以此共享培养基作为三种组织间相互交流的媒介。更为重要的,各组织在miniJoint芯片中能维持其各自表型与功能长达至少四周,显示了该培养体系的独特优势。
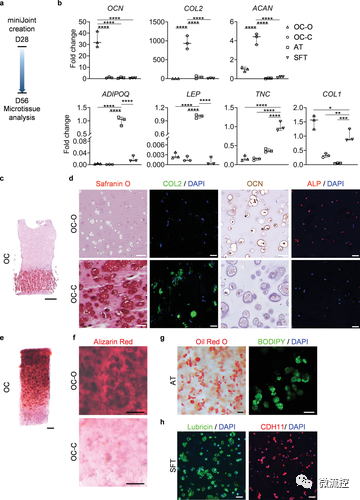
在miniJoint芯片中共培养 4 周后,OC、SFT和AT的表型和功能表征
为构建关节炎模型,研究人员利用白介素1β(IL1β)对SFT进行刺激以模拟滑膜炎。不同于目前常用的体外模型,软骨组织并未直接接受IL1β刺激,这样可以研究滑膜炎导致软骨降解的过程。
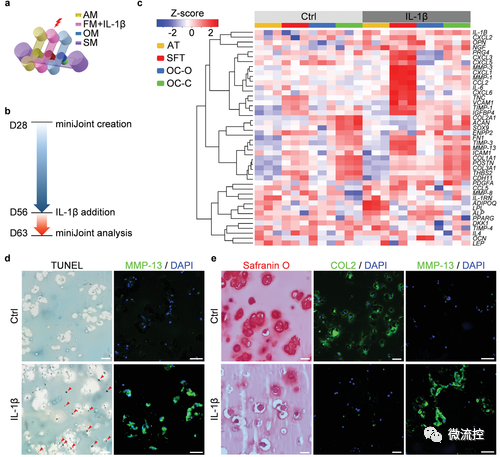
miniJoint芯片中发炎关节模型的构建和表征
经过7天的诱导,SFT以及芯片中其余组织均观测到病变。除了组织学染色、免疫组化/荧光,研究者也利用了RNA测序对关节炎指标进行分析,且将miniJoint中的软骨组织与人体软骨样本、小鼠(常用于构建OA动物模型)的软骨组织进行RNA测序数据的对比分析,证实了miniJoint具有很强的临床相关性。同时,通过对“模拟关节滑液”成分的分析,也阐明了miniJoint在探索关节炎生物标志物(biomarkers)的潜能。

来源于人与miniJoint的软骨组织中共同的显著富集通路
最后,研究人员利用miniJoint疾病模型测试了Naproxen、fibroblast growth factor 18(FGF-18)、sclerostin、SM04690和IL-1 receptor antagonist(IL-1RA)五种潜在的OA药物,并探究了模拟“全身给药”和“局部给药(关节腔注射)”两种给药方式的可行性,证明了miniJoint在关节炎药物开发中的巨大潜力。
目前,该团队在进一步优化miniJoint,包括引入其他的关节组织及模拟力学环境等。
论文链接:
https://doi.org/10.1002/advs.202105909
审核编辑 :李倩
-
芯片上的器官2013-07-12 3151
-
如何完成一个模拟人工膝关节的驱动电路?2021-04-20 1791
-
虚拟膝关节手术中的实时大范围形变方法2009-04-18 1178
-
膝关节唯一性凸显,或用作身份识别2013-01-30 1609
-
爱康医疗A3全膝关节系统实现了国产膝关节产品在FDA认证零的突破2018-07-12 10587
-
国产关节置换手术机器人投入使用2020-08-07 2740
-
膝关节治疗仪设计可以有效的减轻局部的疼痛感2021-05-18 1405
-
膝盖养护的膝关节理疗仪可有效减轻局部的疼痛感2021-05-26 4858
-
沙疗温度及血液灌注对人体膝关节等的影响2021-04-15 1083
-
膝关节护理仪的设计特点是什么2021-07-28 619
-
利用骨髓间充质干细胞构建多组织膝关节器官芯片2022-05-11 1821
-
虹科案例 | 新突破!虹科AR眼镜助力美国首例全膝关节置换手术2021-10-21 1106
全部0条评论

快来发表一下你的评论吧 !

