

一种新型的生物质核壳微囊
描述
骨组织工程克服了临床上骨缺损治疗方法的局限性,其中干细胞作为组织工程的重要组成部分受到越来越多的关注。尽管干细胞治疗已成为一种很有前途的临床方法,但将干细胞直接注射到靶组织可能会导致细胞存活率、保留率和植入率降低,这极大地限制了干细胞治疗的实际应用。细胞输送系统的开发有望克服上述限制。
南京大学附属鼓楼医院、东南大学的赵远锦教授利用全水相微流控电喷雾技术开发了一种新型的生物质核壳微囊,其中含有干细胞核心以及由纤维素纳米晶体(CNC)和海藻酸盐(ALG)组成的生物质壳。所设计的核壳微囊在培养过程中显示出较高的细胞活力。动物实验表明,含干细胞的核壳微囊具有良好的生物相容性和骨缺损治疗效果,在组织工程和再生医学领域具有广阔的应用前景。相关研究成果以“Biomass Microcapsules with Stem Cell Encapsulation for Bone Repair”为题发表在Nano-Micro Letters上。
首先,研究人员对干细胞包埋核壳微囊进行了制备。干细胞(骨髓间充质干细胞,BMSC)微囊由双乳液毛细管微流控电喷雾装置产生,如图1a所示。通过光学显微镜(图3a)和扫描电子显微镜(图2b-e)对干细胞微囊进行了表征。由于添加了CNC,微囊呈球形,表面粗糙,空隙小(图2a,e)。
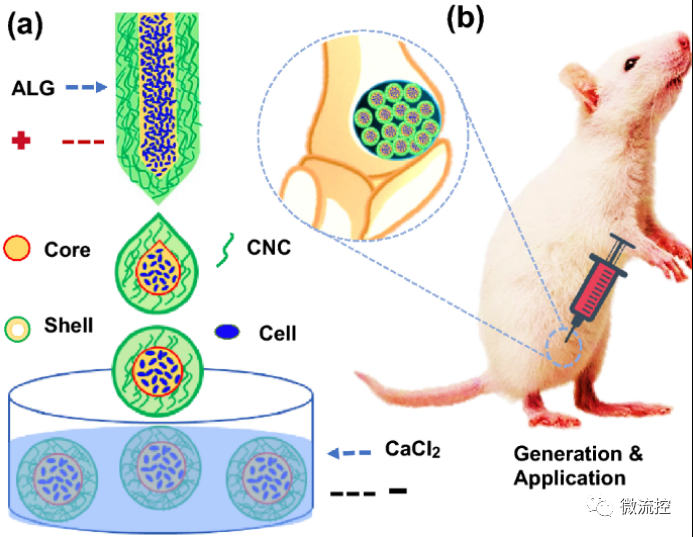
图1 载干细胞微囊的产生和应用示意图
a)微流控电喷雾制备微囊的过程;b)用于骨修复的核壳微囊示意图。
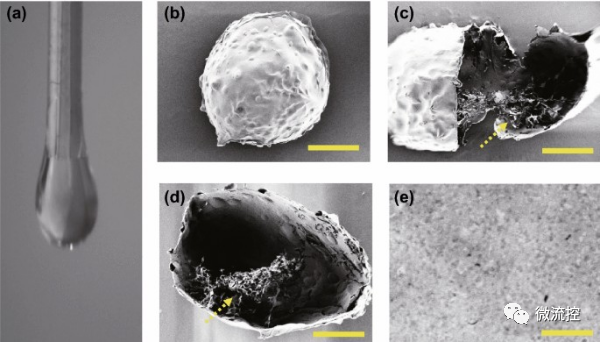
图2 载干细胞的核壳微囊的制备
a)微囊微流控电喷雾过程的实时图像;b-e)微囊(b)、干细胞微囊内部(c)、微囊内的干细胞(d)以及微囊表面(e)的放大图的扫描电子显微镜图像,黄色箭头表示微囊中的细胞,(b、c和d)中的标尺为100μm,(e)中的标尺为10μm。
接着,研究人员对微囊尺寸的影响因素进行了验证。生成的微囊具有很好的均一性,尺寸大小为351.1±16.3μm,其中核心直径为293±12.8μm,符合标准尺寸分布(图3a,b)。研究发现,影响微囊大小的因素包括脉冲电场电压、收集距离和生物质溶液的浓度。生物质浓度和收集距离与微囊的直径呈正相关。而微囊的直径大小随着电压的增大而减小。内相流速的增加导致核心直径的增加和外壳厚度的减少,以及整个微囊直径的略微增加(图3c)。同时,增加外相流速可以增大微囊的直径和外壳厚度,同时减小核心直径(图3d)。
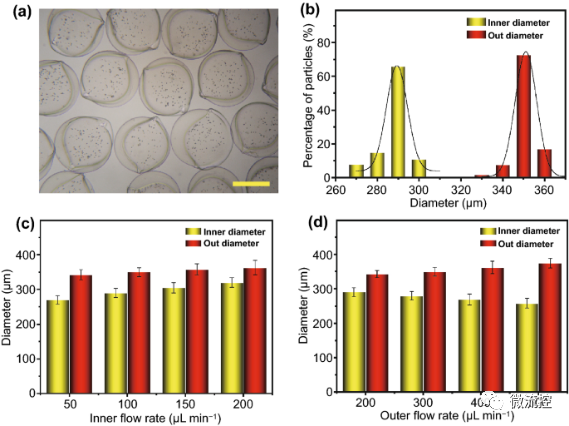
图3 控制微囊大小的因素
a,b)微囊的形态(a)和尺寸分布(b);c,d)内相(c)和外相(d)流速与微囊尺寸的关系,标尺为200μm。
随后,研究人员进行了细胞增殖和生物相容性试验。生物质微囊使细胞在1-7天培养期间快速生长(图4)。当生物质壳的浓度增加时,微囊中BMSCs的DNA数量减少,表明了细胞增殖减少(图4a)。基于机械强度和细胞增殖之间的平衡,选择2%的生物质用于以下实验。研究发现,随着培养时间的延长,细胞开始分散,然后聚集成细胞聚集体(图4b)。这可以归因于微囊的生物功能化和水凝胶的化学基团有助于细胞生长、粘附和迁移到水凝胶微囊。成骨细胞是骨组织的主要体细胞,BMSC是骨组织的主要干细胞。因此,将成骨前细胞系MC3T3-E1(图4c)和原代干细胞BMSC(图4d)用于体外成骨细胞和干细胞的生物相容性试验。结果表明,培养3天后,前成骨细胞和干细胞数量增加,不同组(包括对照组、胶囊组和胶囊BMSC组)之间没有明显差异(图4c,d)。同时,H&E染色研究发现,心、肝、脾、肺、肾等主要脏器未见明显异常。说明了水凝胶微囊在体内外均具有良好的生物相容性。此外,成骨分化能力的研究以及基因表达显示,微囊可以在体外支持BMSC生长和成骨分化。
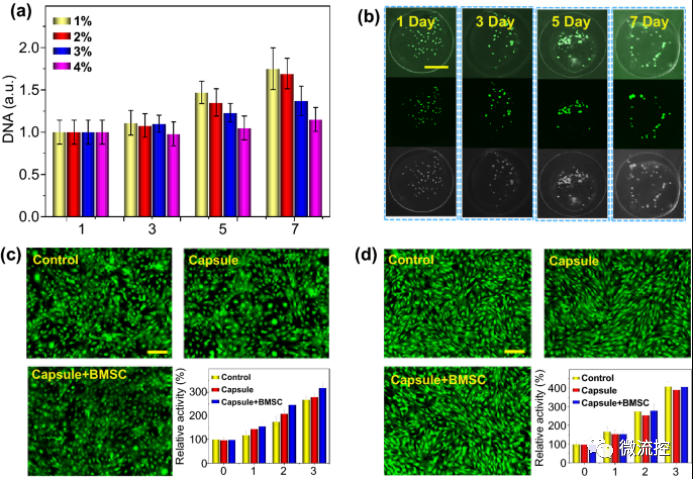
图4 体外细胞增殖和生物相容性试验
a)在不同浓度的生物质微囊中观察细胞增殖;b)分别观察微囊培养1-7天后细胞的形态学变化,比例尺为100μm;c)与MC3T3-E1共培养3天后进行生物相容性测试,比例尺为50μm;d)与BMSC共培养3天后进行生物相容性测试,比例尺为50μm。
接着,研究人员进一步进行了骨修复的形态学分析。在进行动物实验之前,首先研究了微囊的体外干细胞释放能力。研究发现,在生理盐水溶液中培养4周后,BMSC从微囊中完全释放。体内分布研究发现,微囊具有很好的骨损伤区域的靶向性。微计算机断层扫描(micro-CT)显示,与未加载微囊和对照组相比,微囊-BMSC治疗组显著地促进了骨再生(图5a,c)。同时,H&E染色结果显示微囊-BMSC治疗具有更大的新骨体积和面积,增加骨小梁密度,并加速骨再生(图5b,c)。此外,BMSC、微囊和微囊-BMSC组的骨密度(BMD)高于对照组(图5e)。这些结果表明,只有BMSC和微球具有基线成骨效果,并且含有BMSC的微球具有最好的骨再生能力。微球的基本成骨作用可能归因于其天然的生物活性和生物相容性支架,这有利于内源性干细胞的迁移和增殖。
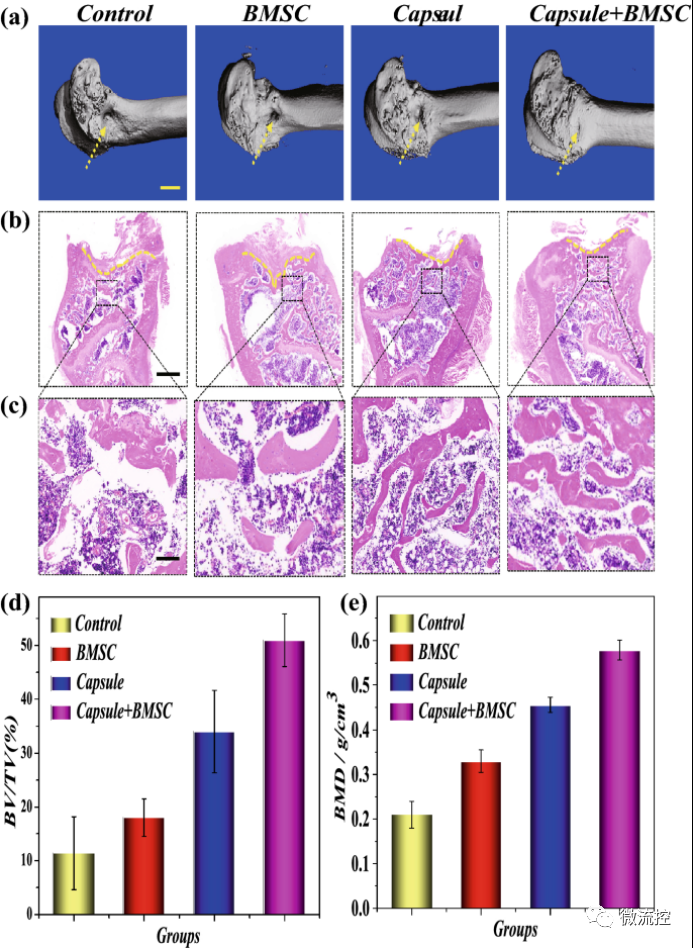
图5 a)显微CT重建图像,不同组(对照组、微囊组和微囊BMSC组)的BV/TV(骨体积)/总体积和BMD;b,c)H&E染色;d,e)定量统计,比例尺分别为5mm(a)、1mm(b)和200μm(c)。
最后,为了进一步描述骨再生过程,研究人员通过免疫荧光检测了不同组中OPN和OCN的表达水平(图6)。免疫荧光结果显示,微囊-BMSC组中OPN(绿色)和OCN(红色)的荧光强度显著高于对照组、BMSC和微囊组,表明微囊-BMSC可以通过促进OCN和OPN的表达有效地加速骨再生(图6a-c)。此外,与对照组相比,微囊组和BMSC组的OPN和OCN表达明显增强,表明BMSC和生物质微囊具有基线成骨效应(图6a-c)。这些结果表明,BMSC、微囊和微囊-BMSC可以通过增加OPN和OCN的表达促进骨修复,与micro-CT和H&E结果一致。
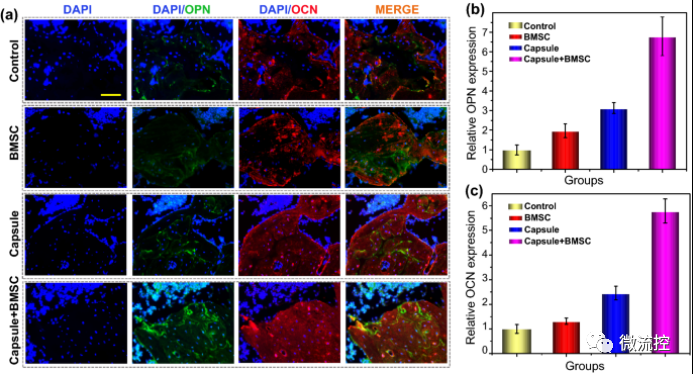
图6 成骨蛋白在不同组中的表达
a)不同组中有代表性的OPN(骨桥蛋白)和OCN(骨钙素)染色;b)不同组中OPN的相对表达;c)OCN在不同组中的相对表达,标尺为50μm。
论文链接:
https://doi.org/10.1007/s40820-021-00747-8
审核编辑 :李倩
-
巧妙构思实现可再充“生物质电池”联产高值化学品2023-06-16 3256
-
一种新型 JFET 微功率稳压器2022-11-14 513
-
怎样去设计一种基于FPGA的新型数字微镜芯片测试系统2021-11-10 1627
-
什么是生物质发电?2021-06-30 1209
-
生物质燃料大卡化验仪器 木颗粒热值检测设备2021-01-05 856
-
生物质燃料热值检测仪器—生物质颗粒大卡化验设备2020-12-28 826
-
检测生物质热量的仪器-化验颗粒灰分设备2020-12-15 778
-
生物质颗粒热量检测仪器有多少种?2019-12-17 809
-
生物质热值检测设备如何使用测颗粒灰分2019-09-15 698
-
检测生物质热值仪-化验木颗粒大卡都有哪些2019-09-06 992
-
生物质热值检测设备 生物质热值检测仪器2019-07-16 1309
-
生物质燃料颗粒热值检测仪器有哪些用途—测试生物质颗粒热值的设备怎么操作2018-03-05 2672
-
生物质能发电技术及其模式探讨2017-10-23 1029
-
风电光伏比生物质能源发展更快是为什么2016-01-20 4602
全部0条评论

快来发表一下你的评论吧 !

