

一种明场成像细胞术(BFIC)技术
描述
循环肿瘤细胞(CTC)是指一组从原发性肿瘤分离并在血液中循环的稀有癌细胞。大量证据表明,CTC是标记癌症转移进展的关键生物标志物。相关研究已发现外周血中CTC的数量与总生存期(OS)相关,可被视为癌症进展的指标。因此,准确识别和计数CTC在癌症诊断和有效监测中具有重要意义。
目前,分析CTC的一个主要障碍是它们相对于大量血细胞而言极为稀有。近年来,基于明场显微成像的细胞形态鉴定和分类方法因具有简单、无标记和易于获取的优点,在CTC鉴定中表现出极大的应用前景。然而,目前用于CTC鉴定的显微镜形态学方法主要依赖于载玻片上细胞的静止成像,由于通量的限制,通过“静止成像”方法测量的血细胞数量不足以检测数量稀有的CTC。
据麦姆斯咨询报道,来自郑州大学杨潇楠教授课题组与中科院微电子所张文昌副研究员课题组联合提出了一种明场成像细胞术(BFIC)技术,以及多帧图像关联(MFIC)算法,作为一种潜在的无标记CTC识别和计数方法。这种方法可以在连续记录宽微流控通道中流动细胞图像的同时确定细胞类型,并可以很容易地与大多数现有的CTC富集方法相结合,使其成为具有潜力的液体活检样本无标记分析工具。相关研究成果以“Label-free detection and enumeration of rare circulating tumor cells by bright-field image cytometry and multi-frame image correlation analysis”为题发表于Lab on a chip期刊,其中硕士生杜自强和郑大一附院李娅副主任医师、陈冰助理研究员为论文共同第一作者,张文昌副研究员和杨潇楠教授为共同通信作者。
为了实现高检测通量和检测精度,研究人员提出了BFIC(图1),并设计了一种具有长直通道(400μm × 30μm × 600μm)的微流控器件来引导细胞以层流方式通过。由于400μm的通道宽度远大于肿瘤细胞的大小,因此细胞可以平行通过,与单通道方法相比,可实现更高的通量和无堵塞操作,其吞吐量可高达每分钟5万个细胞,如果使用更高速度的相机、更大的视野可以进一步提高吞吐量。
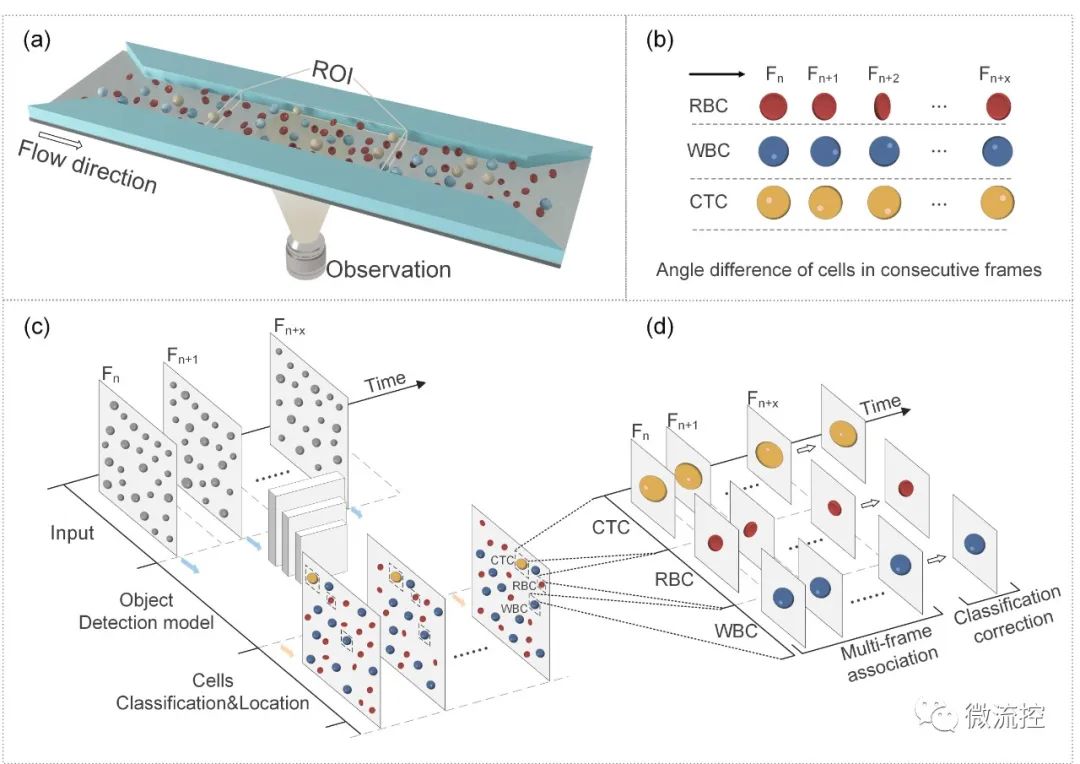
图1 (a)明场成像细胞仪示意图;(b)连续帧中细胞的运动状态;(c)连续单帧中的细胞分类和定位;(d)多帧关联和计数。
采集到的图像被传输到计算机上经过训练的神经网络YOLO-V4,结合每一帧的细胞类型和位置以及帧序列信息,得出细胞的初步分类决策(图1(c))。接着,研究人员通过执行基于细胞跟踪的MFIC算法以提高检测精度,如图1(d)所示。根据YOLO-V4模型给出的细胞类型和坐标信息,在细胞跟踪算法下将细胞的多帧检测结果关联起来。
在具体试验过程中,为了对该方法进行测试,研究人员选择了三种类型的细胞系,包括结直肠腺癌细胞系的HT29、肺癌细胞系的A549和食管癌细胞系的KYSE30。获得的红细胞(RBCs)、白细胞(WBCs)和肿瘤细胞的图像如图2所示。
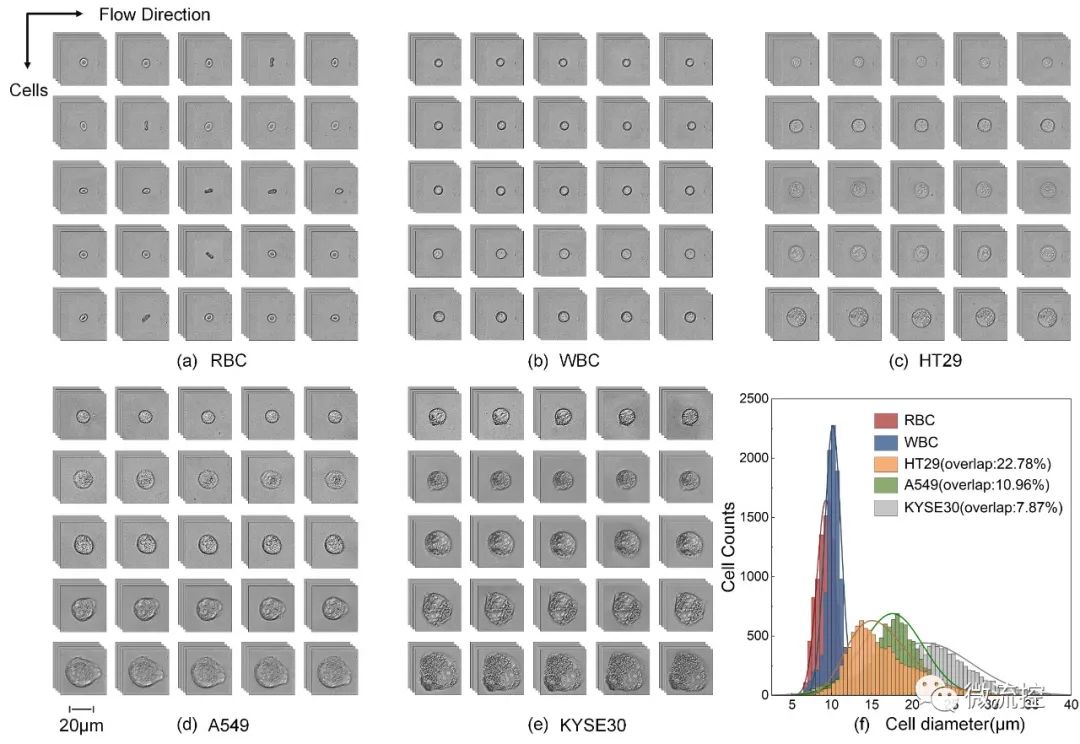
图2 (a-e)RBCs(a)、WBCs(b)、HT29(c)、A549(d)和KYSE30(e)的细胞图像,比例尺:20μm;(f)检测细胞的尺寸分布。
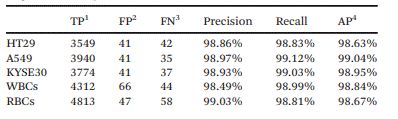
经过训练,细胞检测模型能够给出分类决策以及位置坐标。测试集上每一帧细胞的汇总结果如表1和表2所示。从表2可以看出,对于上述三种肿瘤细胞,单帧检测的平均精度(AP)可以分别达到98.63%、99.04%和98.95%。
表1 测试集的混淆矩阵
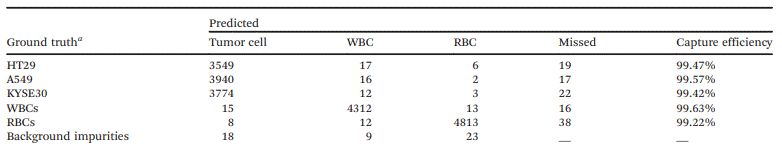
表2 YOLO-V4单帧检测在测试集上的性能评价
此外,为了定量比较单帧检测与多帧相关检测在识别效果方面的差异,研究人员采用了随机单帧模式和连续5帧模式检测每个细胞系的500个肿瘤细胞。如图3(c)所示,连续帧中CTC的识别主要表现在以下三种情况:True——CTC在每一帧中都被正确识别;False——非CTC(背景或其他细胞)被错误识别为CTC,表现出假阳性;Loss——CTC因在单个帧(例如WBC)中的错误识别或因细胞粘附而漏检而表现出假阴性。
在获得每一帧的所有细胞类型后,为了模拟单帧的检测结果(传统的静态细胞检测),研究人员随机地选择每个细胞连续5帧中的一帧,汇总了500个细胞的随机单帧结果后,得到一个“单帧AP值”。每个“单帧AP值”代表在单帧模式下执行一次CTC检测。这个过程重复了100次。图3(d)、(f)和(h)分别显示了100次随机试验中HT29、A549和KYSE30的“单帧AP值”分布。
而在多帧数据关联中,单个肿瘤细胞在连续帧中被正确识别的次数记为n(1≤n≤5)。然后,研究人员使用不同的n作为阈值,对跟踪的肿瘤细胞进行二次分类决策,作为多帧检测结果。之后,参考AP的计算方法,研究人员计算了多帧关联中不同阈值下的分类结果的AP。图4(e)、(g)和(i)显示了n值对三个细胞系AP值的影响。当阈值n取非端点值时,多帧检测的AP与单帧检测的平均AP相比有显著提高。
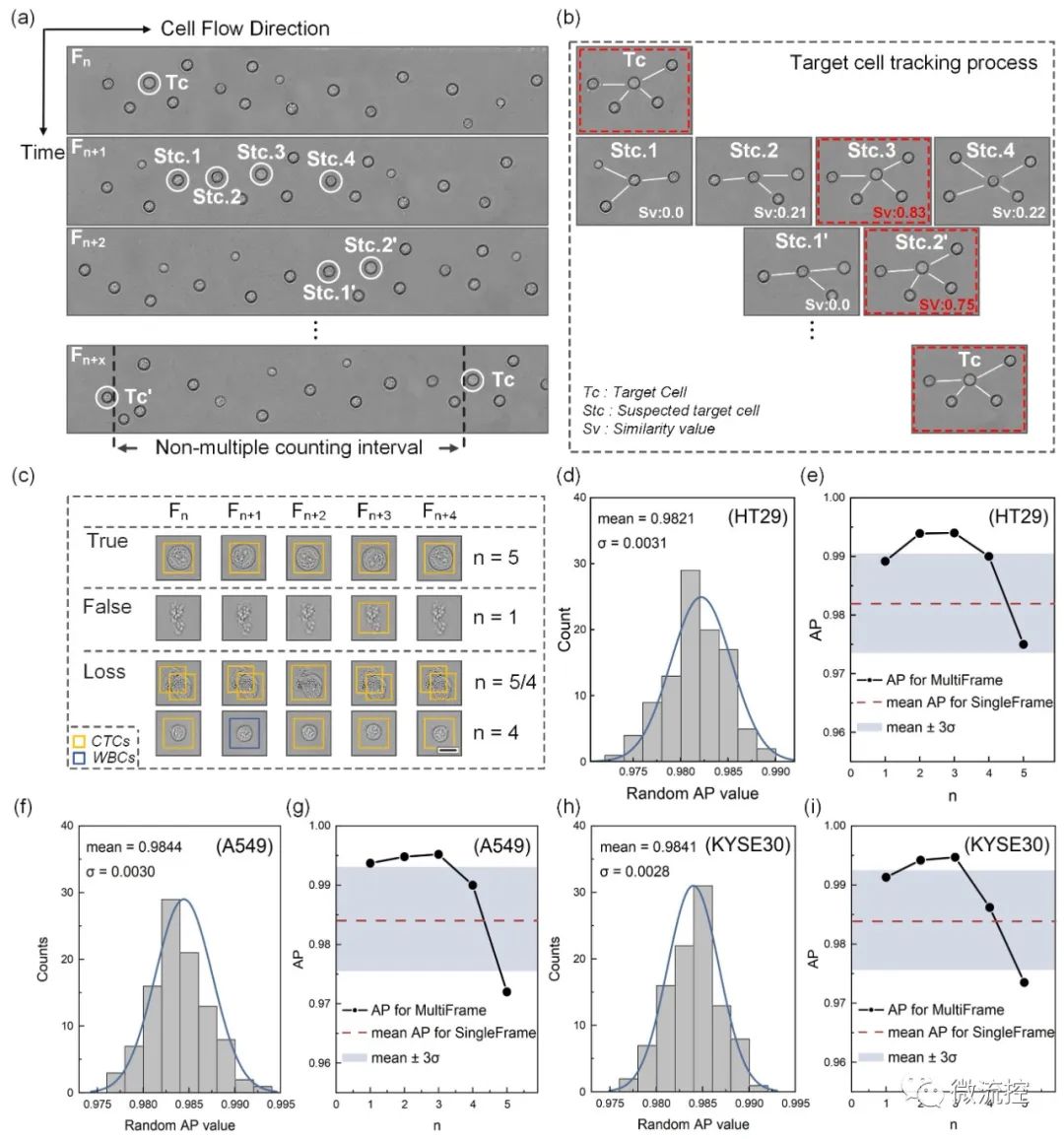
图3 (a)连续帧的细胞图像;(b)目标细胞从Fn到Fn+x跟踪过程示意图;(c)连续帧中的CTC识别案例;(d)、(f)和(h)100次随机试验中三种肿瘤细胞的“单帧AP值”分布;(e)、(g)和(i)阈值n对多帧关联分析模式下三种肿瘤细胞AP值的影响。
大多数可用的CTC检测技术依赖于CTC标记物的标记,例如上皮细胞粘附分子(EpCAM)和E-钙黏蛋白(E-cadherin)。然而,这些上皮生物标志物在上皮-间质转化(EMT)过程中会急剧减少,并会导致标记信号的丢失。为了评估EMT对上述CTC检测方法的影响,研究人员利用HT29细胞系对EMT前后的肿瘤细胞进行了检测。图4(d)和(e)的数据表明,基于明场动态显微成像与多帧关联算法的无标记循环肿瘤细胞检测方法在EMT后对CTC的平均识别精度为98.8%。因此,与依赖细胞表面特异性抗原表达的基于标记的检测技术相比,该无标记检测方法具有很大的优势,突破了仅适用于对上皮来源的CTC筛选的局限性。
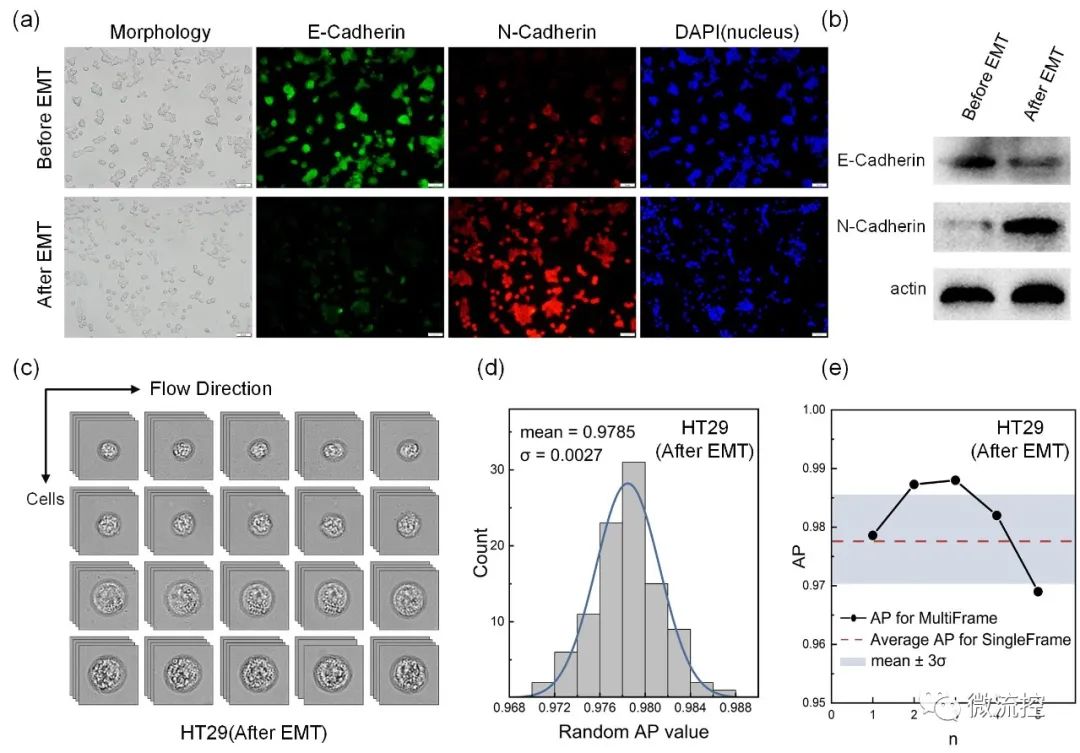
图4 (a)PMA诱导的HT29细胞形态和分子表达变化;(b)通过蛋白质印迹分析评估E-钙粘蛋白和N-钙粘蛋白的表达;(c)HT29(EMT后)悬浮成像示意图;(d)HT29(EMT后)在100次随机试验中的AP分布柱状图;(e)多帧关联模式下不同阈值下的AP分布。
最后,为了评估该检测系统的性能,研究人员评估了其检测限(LoD)。图5(a)显示了通过该细胞计数法检测到的样品中HT29细胞数与显微镜检测到的HT29细胞数之间的关系。值得注意的是,该系统检测到的HT29细胞与显微镜检查之间存在极好的线性关系(R²>0.99)。这种一致性验证了该方法量化真实样本中CTC数量的能力。同时,在HT29的比例低至0.01%左右时,曲线的线性度明显下降。因而该方法的检测限为每10万个WBC检测出10个CTC。
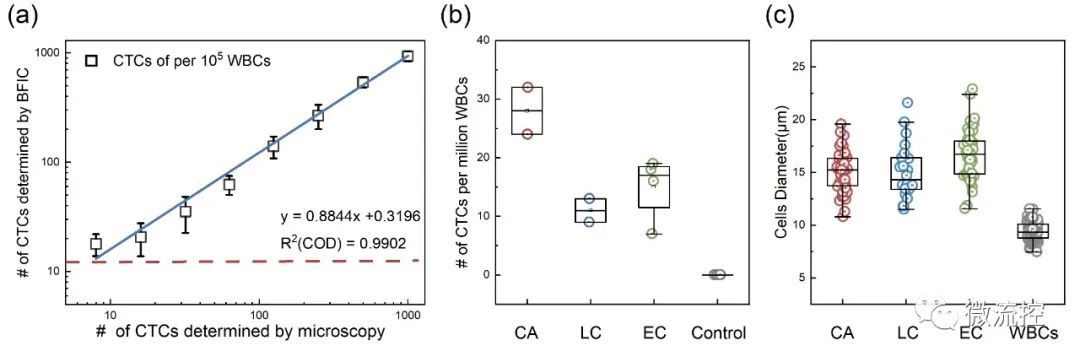
图5 (a)BFIC得到的检出限示意图;(b)从2例结直肠腺癌(CA)患者样本、2例肺癌(LC)患者样本、4例食管癌(EC)患者样本和6例健康供体(对照)样本中检出的CTC数量;(c)患者样本中CTC和WBC的细胞直径。
综上所述,在这项研究中,研究人员引入了一种基于明场动态显微成像与多帧关联算法的无标记循环肿瘤细胞检测方法。通过记录微流控芯片中宽通道内的细胞图像,并通过深度神经网络确定细胞类型,达到了50000个细胞/分钟的检测通量,并避免了通道的堵塞。通过多帧相关分析,纠正了单帧中错误或遗漏的细胞分类结果,在不同种类的肿瘤细胞系(HT29、A549、KYSE30)的检测中分别达到了高达99.40%、99.52%以及99.47%的AP。该检测方法能够较容易地从10万个白细胞中检测到多达10个肿瘤细胞,并且不受EMT的影响。另外,该方法也在8例癌症患者的血液样品中完成了验证,具有良好的临床应用潜力。
论文链接:
https://doi.org/10.1039/D2LC00190J
审核编辑 :李倩
-
一种可在线更新的PET实时查找表电路的设计与实现2010-04-26 1950
-
革命性创新测量技术——数字全息术带来实时3D形貌2017-11-07 4345
-
活细胞的同时AFM荧光成像应用简报2019-10-23 1791
-
一种沟槽型场限环VDMOSFET终端结构_石存明2017-01-07 726
-
非线性光学显微技术在定量细胞成像中的应用2017-10-21 1009
-
编码光片阵列显微术提高3D成像速度2020-05-04 2587
-
浅析Teledyne SP Devices医学影像成像流式细胞术2021-11-09 1388
-
一种对红细胞和白细胞图像分类任务的主动学习端到端工作流程2022-08-13 1984
-
微流控成像细胞分析技术MIC进展与突破2022-12-02 2288
-
介绍一种神经场成对配准的技术NeRF2NeRF2023-02-20 1226
-
心肌细胞搏动时钙离子浓度的变化与细胞收缩在时间上的先后分析2023-08-03 1183
-
如何利用电可调的双模超构透镜实现明场成像和边缘增强成像2023-11-09 1740
-
一种新型全光学复合场成像仪2024-08-06 680
-
活细胞的“聚光灯”——前沿活细胞成像的案例分享2024-10-24 1315
-
空间光调制抗衍射光片流式细胞术中的微流控芯片2025-02-08 564
全部0条评论

快来发表一下你的评论吧 !

