

一款可生物吸收的柔性微流控器件
描述
疼痛,是临床中需要特别关注的重要问题之一,通过局部冷却形成可逆性神经阻滞,不仅可以达到按需消除疼痛的效果,而且能够完全避免服用阿片类药物以及其他镇痛剂带来的成瘾性副作用。然而,传统的局部冷却技术需要借助大型医疗器件并在特定环境下实施,往往很难达到精准的冷却效果,在实际应用中存在着很大的局限性。
据麦姆斯咨询报道,近日,美国西北大学John Rogers教授、俄勒冈大学Jonathan Reeder助理教授、大连理工大学解兆谦教授等人在国际顶尖学术期刊Science上发表了题为“Soft, bioresorbable coolers for reversible conduction block of peripheral nerves”的研究论文。

该研究发明了一种一张纸厚度的、生物可吸收的柔性微流控器件,其通过液体汽化冷却实现了神经传导阻滞,可用于替代阿片类止痛药以达到无损伤的精准镇痛效果,对未来基于柔性医学器件的疼痛管理研究具有非常重要的指导意义。
该研究的通讯作者John Rogers教授表示,这个器件的技术原理与手指在寒冷天气里变得麻木有些类似,它可以通过重编程的方式直接对局部目标神经产生这种冷却带来的麻木效果。温度的下降由嵌入在器件中的微型传感器调控,该传感器将信息传输到外部接收器,患者或医生可以通过外部仪器对治疗进行调控,确保温度不会下降太多,不至于导致组织损伤。
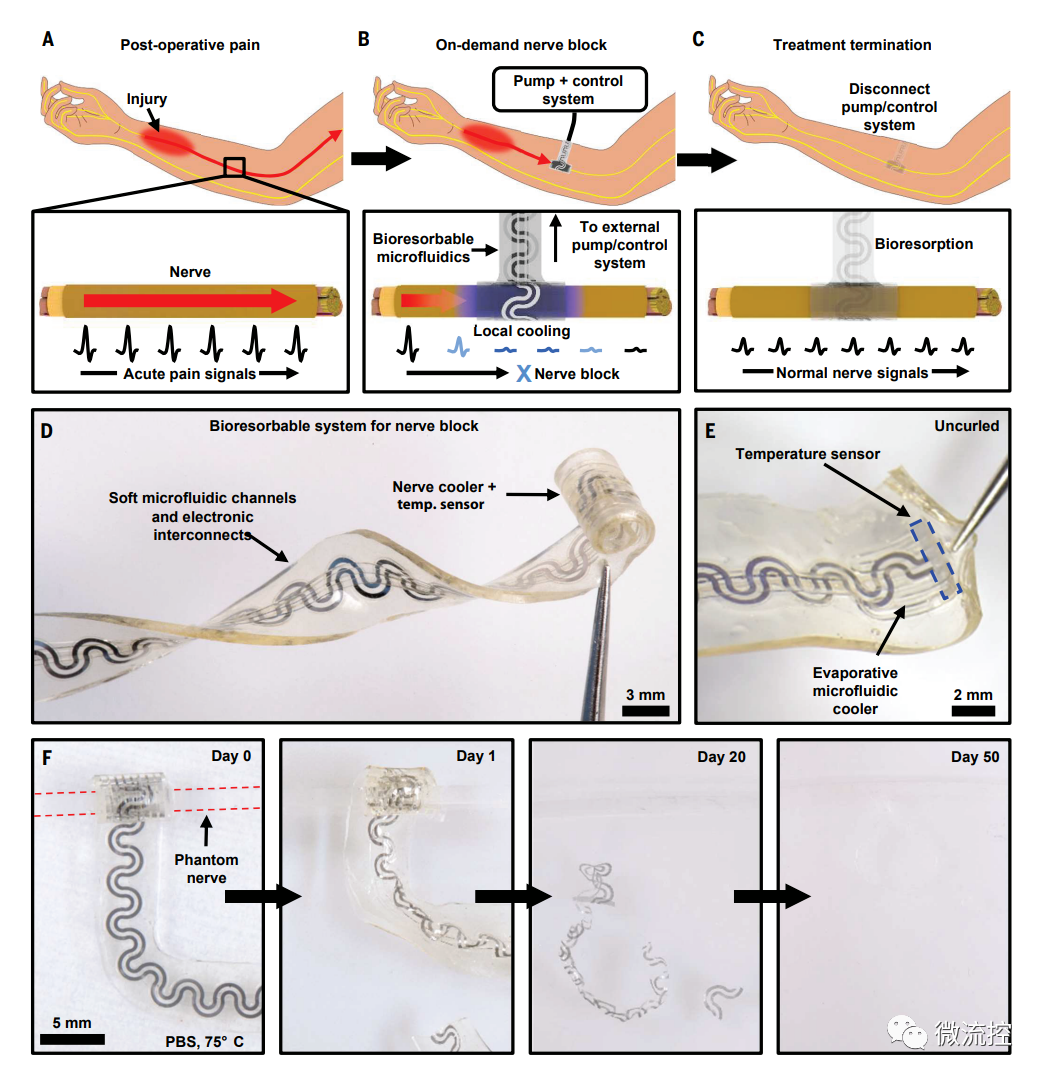
基于微流控、可精准阻滞神经的生物可吸收柔性冷却器件
具体来看,该柔性器件集成了微流控系统与电路系统,通过控制微流控系统中流体的流速与流量,同时借助全氟戊烷(PFP)液体的汽化吸热,实现了在特定部位提供精准且持续的冷却效果。此外,研究人员将具有蛇状形貌的镁线温度传感器分布在该器件末端,通过传感器电阻变化实时获得温度反馈,实现了对温度的精准调控。其具有预拉伸的多层结构力学设计使得该器件可以形成自卷曲结构,无需缝合便可紧密贴附至需要冷却的神经表面并可形成良好的力-热交界面。另外,该器件完全由水溶性材料构成,可依据个性化需求在规定的时间段内溶解于皮下组织的生物流体中,避免了额外的拆除手术给病人带来的痛苦,可以很好地满足患者在长时段内的镇痛需求,相比现有技术和产品具有显著优势。
利用大鼠模型进行的动物实验证实,该器件能在短时间内实现低温调控,并能很好地抑制神经活动。长期观察表明,复温后神经活动迅速恢复正常,且不会产生任何副作用。通过对大鼠模型进行相关组织学分析还发现,该器件在植入大鼠体内6个月后仍能与神经紧密接触,显示了极其优越的力学性能。此外,由于该器件的完全水溶性成分,因此在治疗期结束后,整个器件会在数周内被降解并安全吸收。
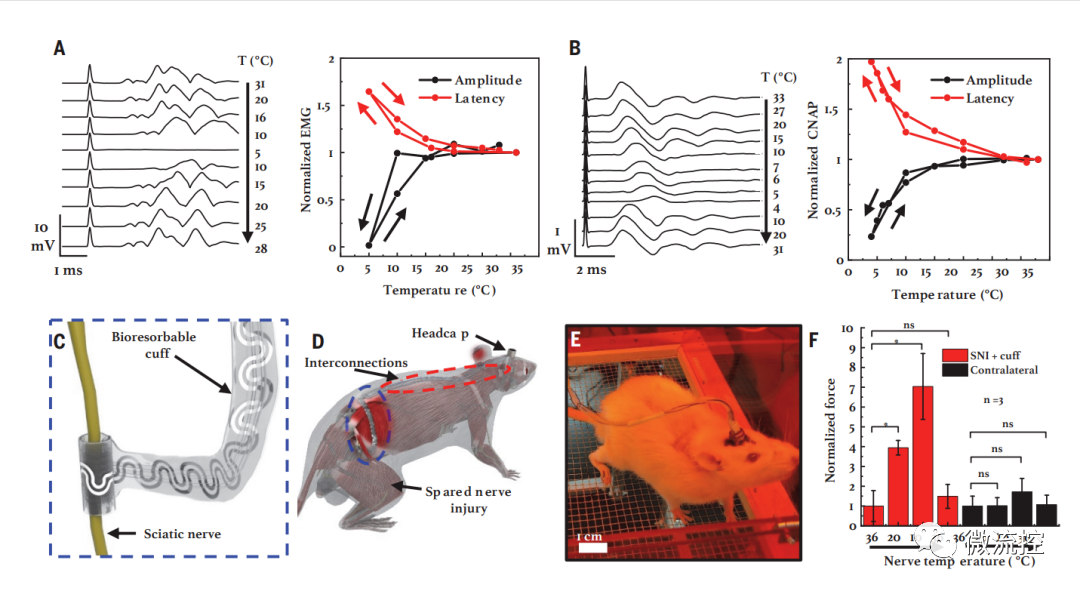
冷却诱导神经阻滞和镇痛的实验情况
综上所述,研究人员开发了一款可生物吸收的柔性微流控器件,该器件能够在活体组织的任意深度通过实时温度反馈控制提供精准、微创的冷却能力。其水溶性、生物相容性材料的结构可在治疗结束后被溶解和生物再吸收,从而消除不必要的器件负荷和对患者造成的风险,而无需进行额外的手术。数周的体内试验证明了该器件能够快速、精准地冷却周围神经,从而在大鼠模型中为神经性疼痛提供局部、按需镇痛。
论文链接:
https://www.science.org/doi/10.1126/science.abl8532
审核编辑 :李倩
-
柔性微流控电子技术的应用介绍2016-11-25 3958
-
如何设计一款基于单片机的肌电生物反馈仪?2022-02-14 1090
-
用新型薄膜开发可弯曲全柔性电子器件2022-04-15 5906
-
微流控生物芯片的磁场仿真及实验对比2010-01-11 1007
-
微流控芯片技术详解_微流控技术在生物医学上的应用2018-05-28 47734
-
微流控和液态金属结合 助力柔性电子器件大规模制造2018-07-27 7744
-
浅析微流控技术在生物传感检测领域的应用2018-10-04 7630
-
新型非接触微流控回路 可按需喷射印刷微流控器件2020-12-23 2818
-
基于液态金属的柔性微流控传感器2022-07-07 2051
-
点成生物展出微流控芯片、压力泵等产品,分享微流控芯片技术应用方案2022-08-01 2778
-
微流控芯片不同基体材料生物相容性对比2022-08-19 3639
-
一种基于仿生材料的微流控微波生物传感器2022-10-09 1324
-
微流控器件的设计策略2022-10-21 1556
-
优可测推动微流控技术革新,精准助力生物医学等行业的发展2024-01-19 1116
-
微流控技术的生物学应用2024-12-01 861
全部0条评论

快来发表一下你的评论吧 !

