

微流控芯片在显微镜下追踪细胞群体的动力学
描述
人工构建基因回路有两种常用的策略。第一种是基于理论设计的“即插即用”模式,研究者利用已被定量刻画的基因元件,结合理论计算模型来构建基因回路,以使之产生特定功能。第二种则是基于高通量筛选的定向进化,或“突变-筛选”模式,在此模式下,研究者往往需要对回路中重要的原件构建规模庞大的突变体文库并随后进行筛选,以获得所需的表型。
对于后者而言,尽管大规模的建库-筛选技术近年来已经得到了长足的发展,然而对于一些复杂的表型,特别是涉及到时间依赖的动力学行为时,同时记录大规模突变体库的动力学表型是困难的。近期,美国加州大学圣地亚哥分校Jeff Hasty课题组在Cell Systems上发表以“Design, mutate, screen: Multiplexed creation and arrayed screening of synchronized genetic clocks”为题的研究论文,介绍了其新开发的微流控芯片,基于此芯片可以在显微镜下同时记录大量细胞群体的动力学行为。
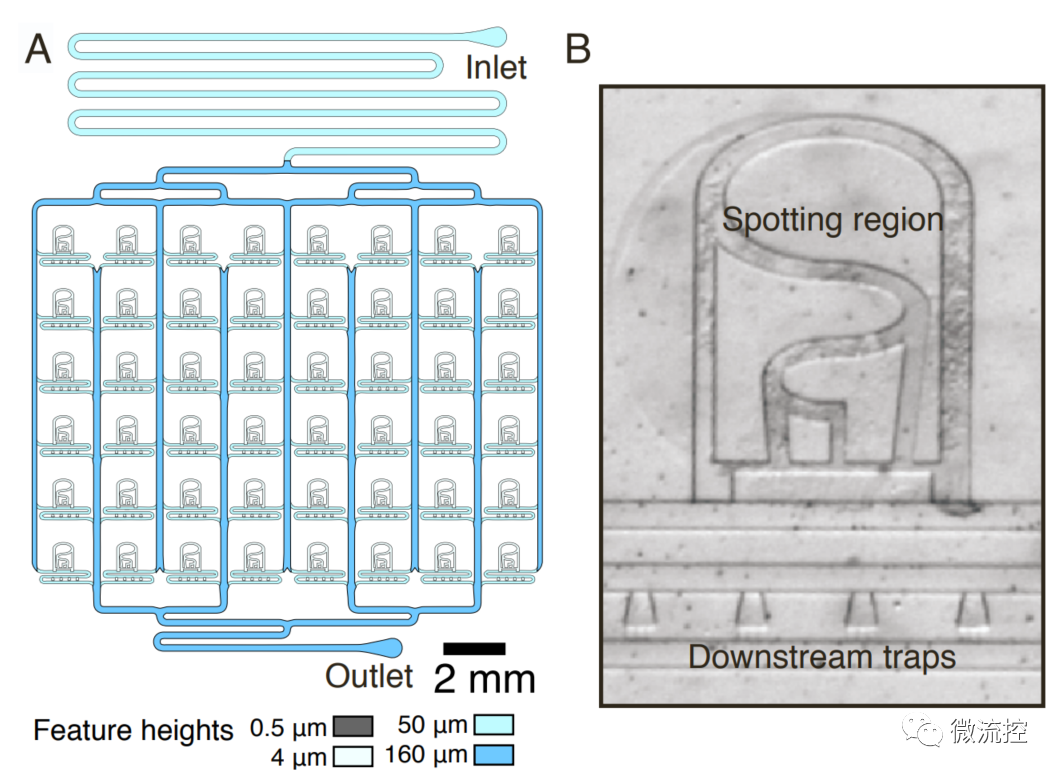
图1 Hasty实验室开发的微流控芯片,可以同时追踪48个细胞群体的动力学。
应用这一微流控系统,研究人员对实验室已有的群体振荡基因回路进行了突变-筛选。该基因回路利用细菌的群体感应系统,通过AHL分子进行细胞间通讯,使细胞群体以共同的节律表达细胞裂解相关蛋白,从而产生群体的同步化振荡(如图2所示)。研究人员首先对裂解蛋白的核糖体结合位点(RBS)序列中的五个位点进行了突变,并随机选取其中24个分别用96孔板和微流控系统进行筛选。结果表明,在96孔板中生长的细菌群体无法表现出规则的振荡行为,而在微流控筛选系统中则可以表现出周期性振荡。研究人员进一步定量测定了不同突变体在不同条件下的振荡周期和振幅,并展示这一系统可以用于精确调整振荡系统的动力学性质。
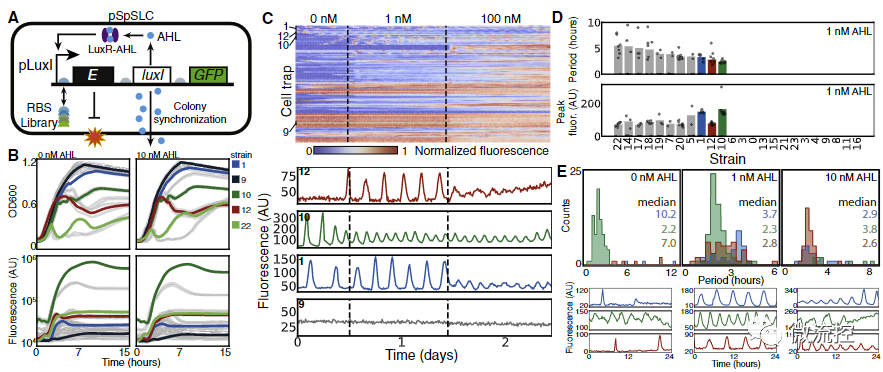
图2 应用微流控系统规模化筛选具有不同振荡周期的菌株
接着,研究人员挑选筛选所得的两个菌株(pSpSLC₀和pSpSLC₁₀,以下简称0号和10号)进行了深入分析。相比而言,10号菌株的振荡更慢,振幅更高。研究人员首先在无反馈的菌株内刻画了两种RBS的强度,并画出了两种RBS下细胞裂解对AHL的剂量响应曲线,发现0号菌株(快振荡)的EC50要显著小于10号菌株(慢振荡)的EC50值,这一结果与数学模型定性地吻合。
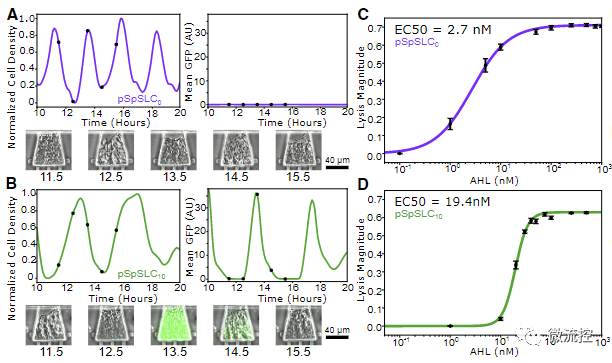
图3 更慢的振荡周期对应更强的AHL响应
此外,研究人员应用前任发展的RBS计算器对这两个筛选得到的RBS序列进行了强度预测,但结果显示二者并没有明显区别(在误差精度范围内)。研究人员分析产生这一结果原因可能在于下游裂解蛋白浓度与细胞裂解之间的非线性关系,即微小的RBS强度改变也可能带来细胞裂解水平的很大变化。这进一步说明了规模化文库筛选的重要性——即便是在很大程度上可以被理性设计的基因回路中,也会有潜在的、未被充分考虑的复杂性。
最后,研究人员应用这一筛选平台构建了一个不依赖于细胞裂解的新型群体振荡回路。该回路由简单的负反馈构成:细菌表达产生的AHL可以诱导tetR的表达,而tetR又可以抑制AHL的表达。初始构建的菌株并未表现出明显的振荡特征,研究人员随后对tetR的RBS构建了突变体文库,并选择其中在分批培养条件下具有脉冲式动力学现象的菌株进行了微流控平台筛选,最终得到了具有稳定振荡表型的菌株。相比初始菌株而言筛选得到的菌株明显具有更稳定的振荡周期。
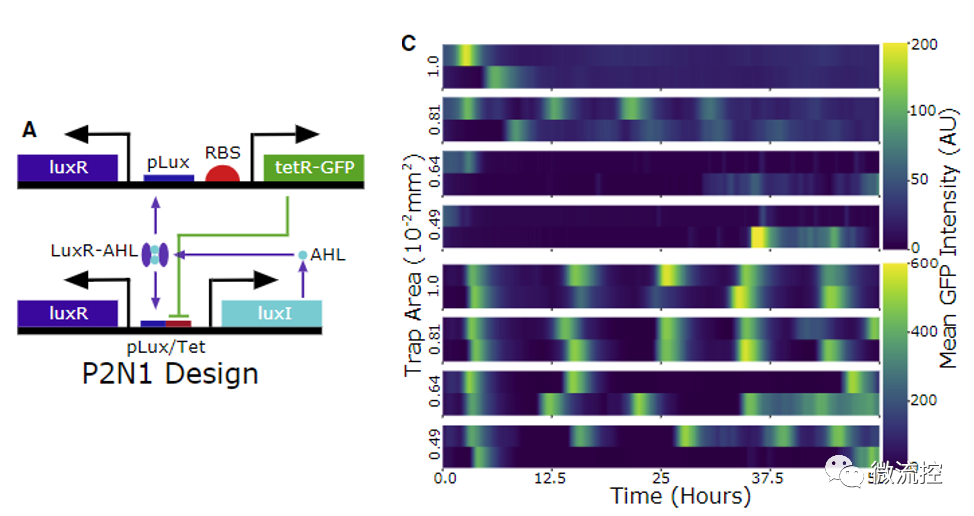
图4 筛选前后细胞群里动力学的对比(c图上半部分为筛选前的细胞群体动力学,下半部分为筛选后的群体动力学,可以看到发生了规律的周期振荡)。
综上所述,研究人员开发了一种可以规模化筛选细胞群体动力学的技术平台,应用这一平台可以有效地获得具有预期的定量表型的菌株,并可以用来筛选产生全新动力学行为的菌株(从衰减振荡到持续振荡),为复杂基因回路的规模化筛选与定向进化提供了新的思路和工具。
原文标题:基于微流控芯片的分子钟基因回路的高通量设计与筛选技术
文章出处:【微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1100
-
显微镜下芯片PAD面发蓝2024-08-23 4817
-
显微成像与精密测量:共聚焦、光学显微镜与测量显微镜的区分2024-05-11 1891
-
什么是共聚焦显微镜?2023-02-17 7034
-
显微镜放大倍数是怎么得出来的?2020-04-26 3677
-
如何计算显微镜的放大倍数2020-02-11 5719
-
显微镜倍率如何计算?2020-02-06 7223
-
显微镜的成像原理图2019-07-24 3084
-
芯片上的扫描电化学显微镜2019-03-22 4796
-
Cyclops Micro高清数字显微镜2018-10-31 2207
-
简易显微镜制作方法2018-09-12 38495
-
选购显微镜的一些常见问题2016-08-31 3854
-
科学领域新技术,打造高品质共聚焦显微镜2014-04-03 3654
-
荧光显微镜2009-07-07 3337
全部0条评论

快来发表一下你的评论吧 !

