

基于微流控系统开发单细胞生物芯片平台
描述
超声基因转移比其他细胞转移技术更有优势,因为超声不直接作用于细胞,而是通过声孔效应将细胞周围的基因片段推入细胞。据麦姆斯咨询报道,近日,一支由中国广西大学和中国科学院智能机械研究所的研究人员组成的团队在Micromachines期刊上发表了题为“A Microfluidic System of Gene Transfer by Ultrasound”的论文。该论文提出的微流控系统对于开发用于癌症早期诊断和癌症治疗评估的单细胞生物芯片平台具有重要意义。
从外源向细胞的基因转移是一项基本的生物工程技术,也是表征基因结构和功能的有力工具。目前用于裸基因转移的被动方法包括:脂质体介导法、微注射法和病毒载体转染法等。裸基因转移的被动方法具有无需外部供能、设备简单等优点,但载体,尤其是病毒载体,存在局限性和安全缺陷。虽然脂质体、高分子材料和纳米基因转运蛋白等非病毒载体没有病毒毒性或免疫原性等缺陷,但它们的传输效率非常低。
裸DNA转移的主动方法包括:微注射、粒子轰击/粒子枪、电穿孔和光学方法。微注射和粒子轰击都是介入方法;也就是说,细胞膜必须穿孔才能将DNA导入细胞。电穿孔基因转移也需要细胞膜穿孔,它利用高压电击(10–20kV/cm)将DNA质粒通过细胞膜后转移到细胞内。目前,电穿孔是最常用的一种方法,因为电穿孔具有转染效率高和适用于大型DNA质粒的优点,但其操作需要低离子水平的培养基和高电压,这可能导致细胞死亡。此外,高聚焦激光还可用于在细胞膜上产生直径约1μm的穿孔,这是光学基因转移的原理。然而,激光束很容易损伤细胞,这大大限制了该方法的应用。光学基因转移特别适用于一次仅处理一个细胞的单细胞转染。

图1 超声DNA转移机理的示意图
超声介导的基因转移,也被称为声孔效应,是近年来开发的一种细胞膜渗透技术,已被应用于细胞内的DNA和药物转移。该技术基于超声波的空化效应。当超声波在液体溶液中传播时,路径中的液体将经历交替压缩和膨胀。如果超声强度足够大,液体在压缩和膨胀过程中会形成气泡,并能在膨胀到一定程度后破裂。从气泡产生到破裂的时间通常非常短,通常在1μs以内。该过程被称为超声空化。超声空化产生的局部高温高压冲击波可以在细胞膜上形成有效直径小于100nm的微孔。这些微孔可以持续几秒钟,让较大的分子从培养基进入细胞。在优化的条件下,细胞可以在空化效应下存活,且无明显损伤。基于自修复机理,基因转染后细胞膜可以自行桥接。以上是超声介导的基因转移的原理。图1显示了超声介导的DNA转移机理和DNA质粒转移到细菌细胞内的典型步骤。
该技术目前被认为是将DNA质粒或片段转染到细胞内的理想方法。它具有以下优点:(a)理论上,DNA或RNA可以被转移到任何类型的细胞,包括细菌细胞、植物细胞和哺乳动物细胞;(b)它不要求培养基是无离子的,并且可用于在自然环境或人体内生长的细胞;(c)它是非侵入性的,不需要与细胞直接接触;(d)人们可以很容易控制转移的时间和位置。超声可以被限制在特定的区域或时间段,以改善基因转移的效果。
现有的超声介导的基因转移技术都是在宏观体积下使用大型超声设备(例如喇叭形超声辐射器或超声浴)进行的。相关研究仅在宏观尺度(10⁵–10⁷个细胞)上进行,并得出平均数据。由于细胞反应的不均匀性和不同的生命或代谢周期,平均数据往往难以解读。为了解决这个问题,需要开发单细胞操作、高精度分析和高灵敏度检测的新技术和新装置。有趣的是,利用微流控技术,生物芯片——“芯片实验室”(lab-on-a-chip)的尺寸与细胞尺寸是兼容的,适合单细胞操作。
与宏观和大体积分析技术相比,集成生物芯片技术具有试剂消耗小、残留物少、反应时间短、精度高、成本效益好、一次性使用等优点。微流控装置的使用有利于细胞的分离、捕获、定位和观察。此外,人们可以控制附着细胞的器件表面物理和化学参数,例如局部pH值和温度,以精确控制细胞周围的局部环境。
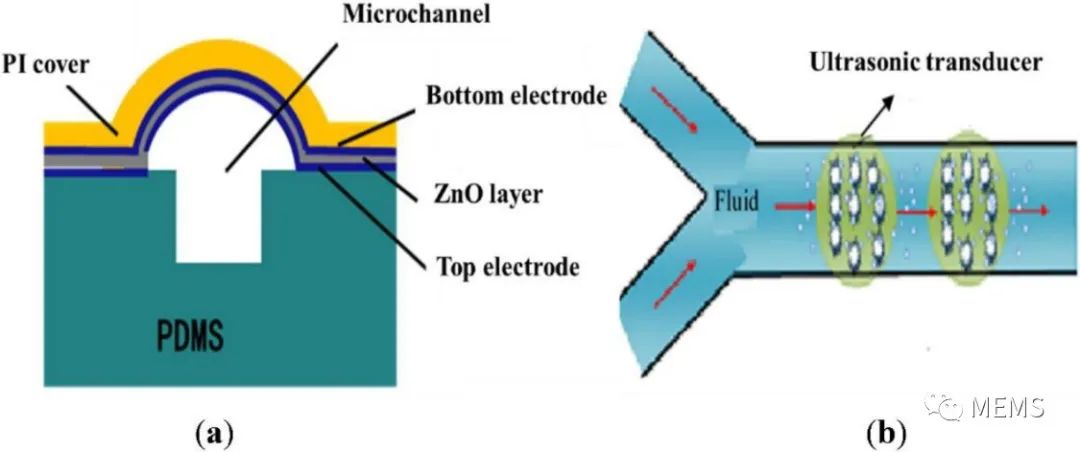
图2 微流控超声基因转移系统示意图
在本论文研究中,作者们将基于柔性基底压电薄膜的MEMS聚焦超声换能器与微通道集成,提出了一个能够满足高精度分析和单细胞操作要求的微流控超声基因转移系统。该系统的核心部分是一个碗形弯曲的压电薄膜结构,其功能是自动聚焦超声波。低输入电压和功率可以在微通道局部区域获得超过空化阈值的声压,以减少对细胞的损伤。他们通过有限元仿真验证了该系统的可行性,开发了MEMS超声器件和微通道集成的微流控系统,成功开展了HeLa细胞的超声基因转染实验。实验结果表明,超声换能器越多,转染率越高。

图3(a)PI基底上自聚焦超声换能器阵列的制备流程图;(b)微流控转染生物芯片。
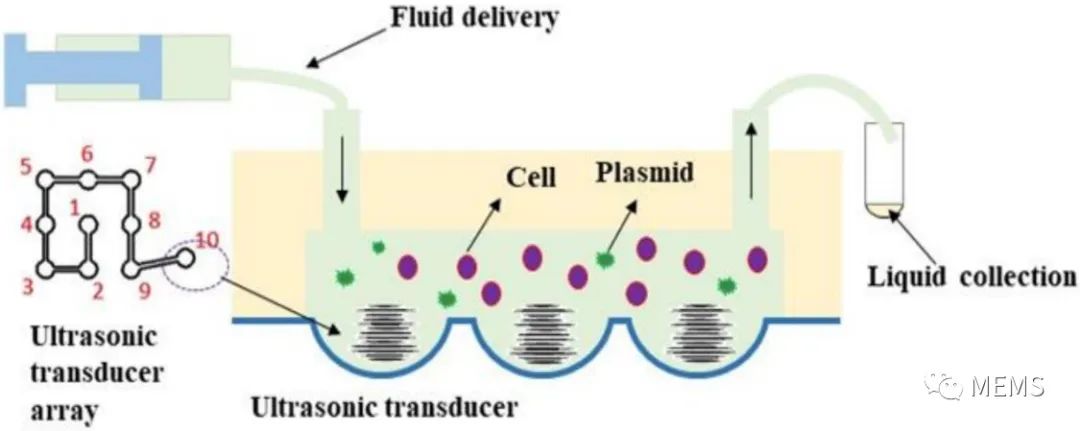
图4 超声基因转染实验示意图

图5 HeLa细胞中绿色荧光蛋白表达结果(×200):(a)仅添加质粒;(b)添加质粒并用2 号换能器超声处理20s;(c)添加质粒并用4号换能器超声处理20s;(d)添加质粒并用2号和4号换能器同时超声处理20s。
审核编辑:郭婷
-
什么是生物芯片2021-01-19 1894
-
微流控生物芯片的磁场仿真及实验对比2010-01-11 1007
-
生物芯片分类及应用2017-11-10 23132
-
微流控芯片在单细胞捕获中的应用2019-04-08 9274
-
可穿戴生物芯片在单细胞传感和基因转染中的应用2019-04-12 5856
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6383
-
厦门大学研发出全新高通量单细胞转录组测序方法2020-06-02 4271
-
一种低成本的单细胞(single-cell)微流控芯片2020-10-13 5191
-
基于微流控平台的单细胞通讯研究进展2022-11-29 1657
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1703
-
北京基因组所开发出新型高通量单细胞多组学技术2023-04-20 1924
-
基于载酶金属有机框架的微流控平台实现单细胞代谢物分析2023-05-10 1584
-
一种用于测量单细胞瞬态响应的封闭式微流控芯片2023-08-03 753
-
用于单细胞谱系追踪图像引导的微流控系统2023-08-18 2010
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1084
全部0条评论

快来发表一下你的评论吧 !

