

一类新的钌基催化剂,采用原位制备技术
电子说
描述
01 导读
氨作为各种含氮肥料的前驱体和主要组成部分,在滋养全球人口方面发挥着重要作用,同时,氨生产占全球能源消耗和碳排放量的1%左右。在大型集中设施中,通过高温高压Haber-Bosch (HB)工艺合成氨。为了实现可持续的氨合成工艺,该工艺尽可能在低得多的温度下运行,从而缓解当前HB工艺中对高压的需求。因此,需要发展全新的催化剂,降低制造氨的资本需求和能源消耗。
02 成果背景
在此,丹麦技术大学Jens K. Nørskov团队提出了一类新的钌基催化剂,采用原位制备技术,钌/碳催化剂在高压推流式反应器中由金属铯蒸汽直接促进,同时保持O2和H2O的内部分压非常接近零。开发的原位促进催化剂的速率比350℃以下的常规原位促进催化剂的速率高出1个数量级以上。高活性归因于活化能大大降低,使催化剂更适合在低温下进行氨合成。相关工作以“Enhanced promotion of Ru-based ammonia catalysts by in situ dosing of Cs”为题发表在Energy & Environmental Science上。
03 关键创新 该工作提出了一种原位制备技术,用金属铯促进的新型钌基催化剂。采用这种新技术制备的催化剂的活性高出约10倍。原位促进的催化剂具有较小的表观活化能,并且对H2中毒不敏感。
04 核心内容解读
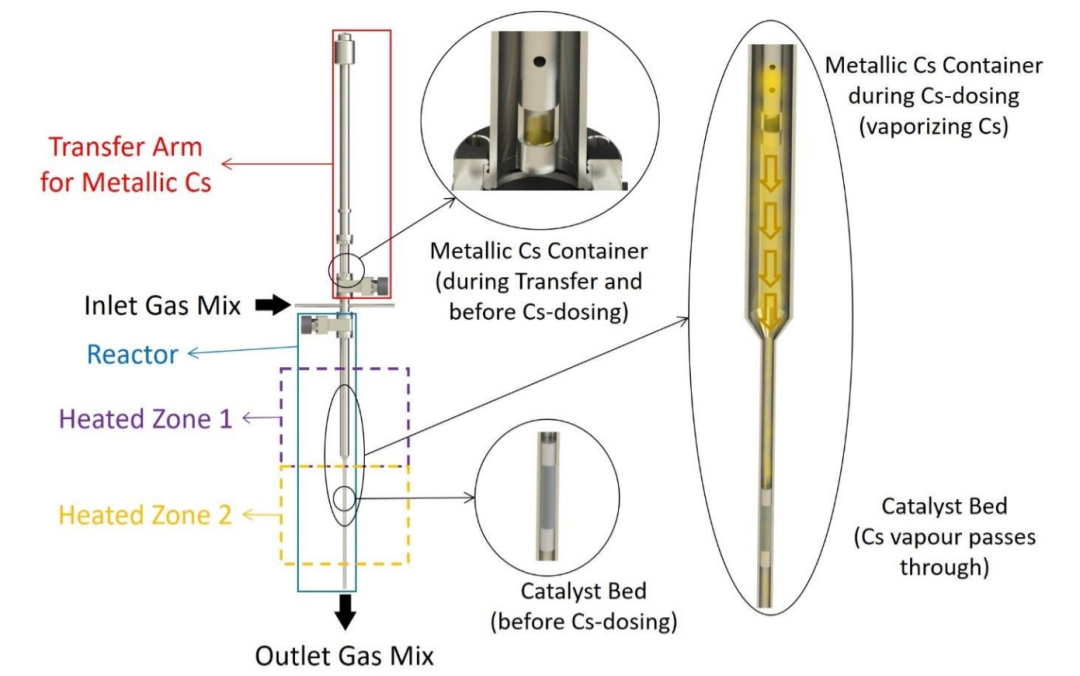
图1 原位金属蒸汽剂量器和固定床反应器示意图。@RSC
在本工作中,Ru/C样品直接用金属Cs蒸气促进,并在不暴露于空气的情况下进行测试。为此,设计了用于将金属Cs原位投加到催化剂中反应器装置的附加装置(图1)。该系统由一个超高真空兼容的转移臂组成,该转移臂配备一个用于装金属Cs的小杯。转移臂在Ar手套箱中装金属Cs,然后将臂连接到装置上,允许装有Cs的杯在催化剂床附近的反应器内移动。然后,将系统抽真空并用Ar吹扫数次,确保系统中没有氧气。为了使Cs蒸发,装金属Cs杯的温度独立于催化剂床温度进行控制。在10 bar的Ar流中将Cs加入催化剂,装Cs的杯保持在 450 ˚C,催化剂床在400 ˚C。几小时后,将流量切换到N2+H2混合物进行不同条件下的反应测量。
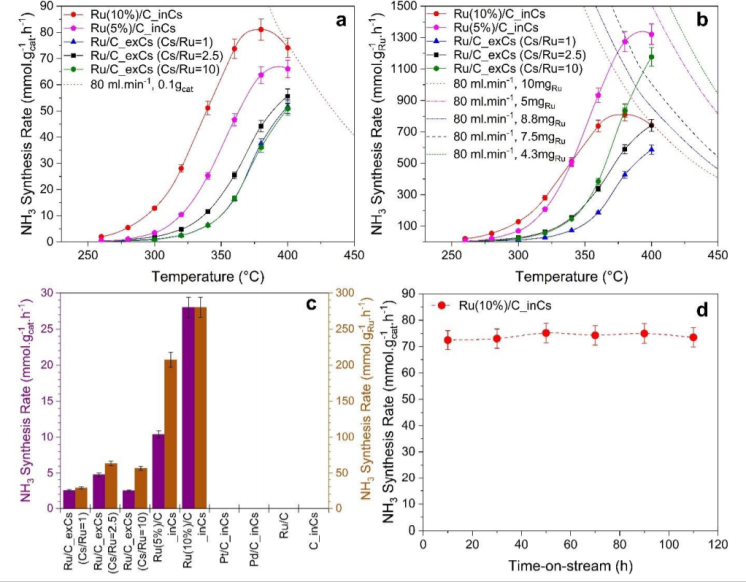
图2 通过非原位或原位促进技术用Cs促进的不同Ru/C催化剂上的氨合成速率:(a)基于负载催化剂的总重量归一化,(b)基于负载的Ru总重量归一化。a和b中的虚线/点线表示氨合成的平衡速率;(c)不同催化剂在320 ˚C下氨合成速率的比较;(d)原位促进催化剂在400 ˚C的运行时间活性测量。(反应条件:0.1 g催化剂,10 bar,总流量80 ml.min-1,H2/N2=3,WHSV=48,000 ml.g-1.h-1)@RSC
为了研究无氧促进(Ru/C_inCs)的催化效果,并将其与传统的空气中非原位促进(Ru/C_exCs)进行了一系列催化剂活性测量。图2a和图2b中的点划线表示氨合成的平衡速率。在远离平衡(<360 ˚C)的温度下,动力学占主导地位,与非原位促进的催化剂相比,原位促进的催化剂的活性比非原位高约10倍。图2a-c的结果表明,原位促进催化剂的较高氨合成速率不能简单地归因于较高的Cs/Ru比。如图2d所示测试了原位促进催化剂的稳定性。当实验停止时,催化剂可以具有长达110小时的稳定性能。原位促进催化剂性能稳定的一个重要原因是不含含氧化合物的超洁净系统。
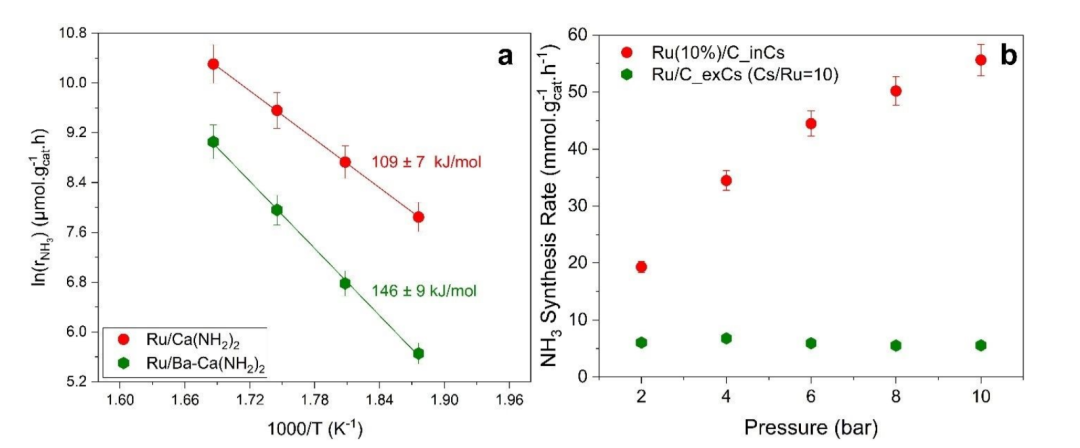
图3 (a)Ru/C_inCs和Ru/C_exCs在10 bar时的Arrhenius图和活化能;(b)使用0.1 g催化剂在340 ˚C、2至10 bar、总流量为80 ml.min-1、H2/N2 = 3和WHSV=48,000 ml.g-1.h-1时氨合成速率与总压力的关系。@RSC
图3a是通过原位和非原位技术,用Cs促进的Ru/C催化剂的Arrhenius图和计算的表观活化能。这些催化剂的活化能之间存在显著差异。两种催化剂都观察到轻微的NH3抑制效果。尽管,原位和非原位Cs促进催化剂的NH3和N2级数大致相同,但H2反应级数显著不同(图3b)。与非原位促进的催化剂相比,原位促进的催化剂的H2抑制作用要小得多。当压力从2 bar 增加到10 bar时,原位促进催化剂的活性增加约3倍,而非原位促进催化剂的性能不会随着反应压力的增加而减弱的H2抑制作用。
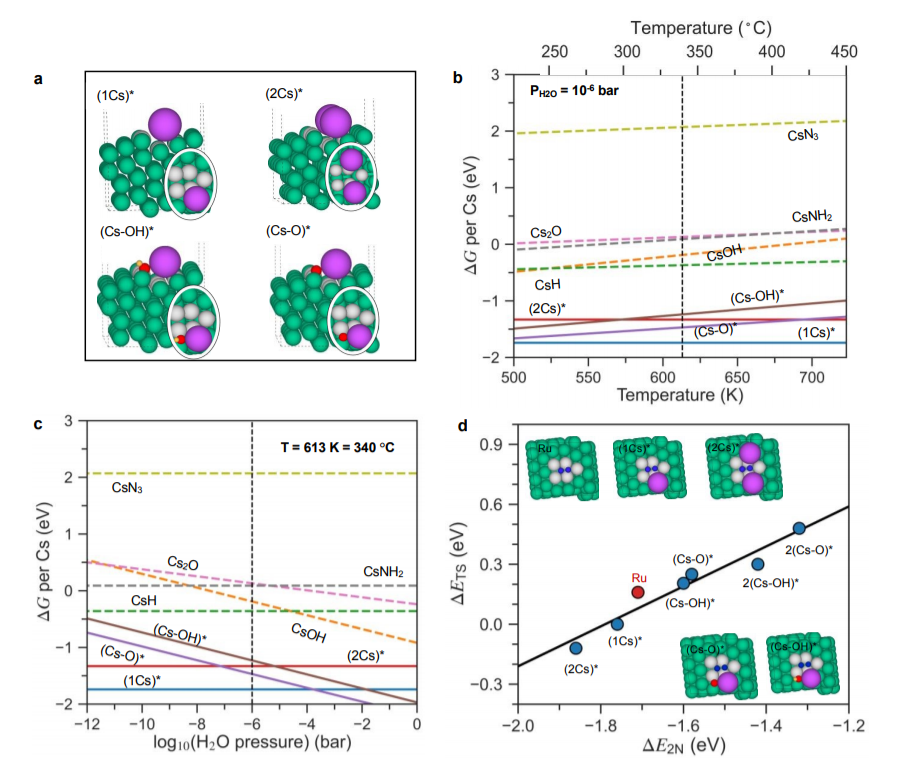
图4 (a)共吸附1Cs*、2Cs*、(Cs-O)*和(Cs-OH)*物种在Ru表面步骤的侧视图和俯视图(椭圆形);(b-c)在反应条件下促进Ru与其氧化物、氢氧化物、氢化物、酰胺和氮化物平衡,作为温度和H2O压力的函数。b的反应条件为PH2= 7.125 bar,PNH3=0.25 bar(N2 转化率为5%),PH2O=10-6bar,选择用于模拟极其干燥的反应气体;c的反应条件是T=340 °C,PH2=7.125 bar,PNH3=0.25 bar(N2转化率为5%;基于N2转化率2%和10%的相图也计算并呈现在图S9中)。游离物种显示为虚线,而吸附的物种显示为实线并由*标识。所有能量都是每个Cs原子相对于体相Cs;(d)N2解离势垒(ΔETS)与N2解离能(ΔE2N)之间的比例关系。绿色、紫色、红色、黄色和蓝色球体分别代表Ru、Cs、O、H和N原子。活性位点的Ru原子用灰色标记。@RSC
图4a为计算的表面相图来探索活性相。该图比较了不同前体化合物(即本体Cs2O、CsOH、CsN3和CsH)中的Cs在典型氨合成条件下的自由能。如图4b和c所示,高度促进的原位样品比非原位、低Cs覆盖率的系统更容易发生氧中毒。图4d证明,Cs*是N2解离的良好促进剂,对于高Cs覆盖更是如此。高Cs覆盖率催化剂促进较好的原因如下:吸附Cs的促进作用与表面外Cs诱导电场与过渡态N2分子诱导的偶极子之间的吸引力相互作用有关。在高Cs覆盖率表面下,过渡态分子接近两个Cs原子(图4d),这意味着吸附平面是约两倍大,因此过渡态的稳定性更大。
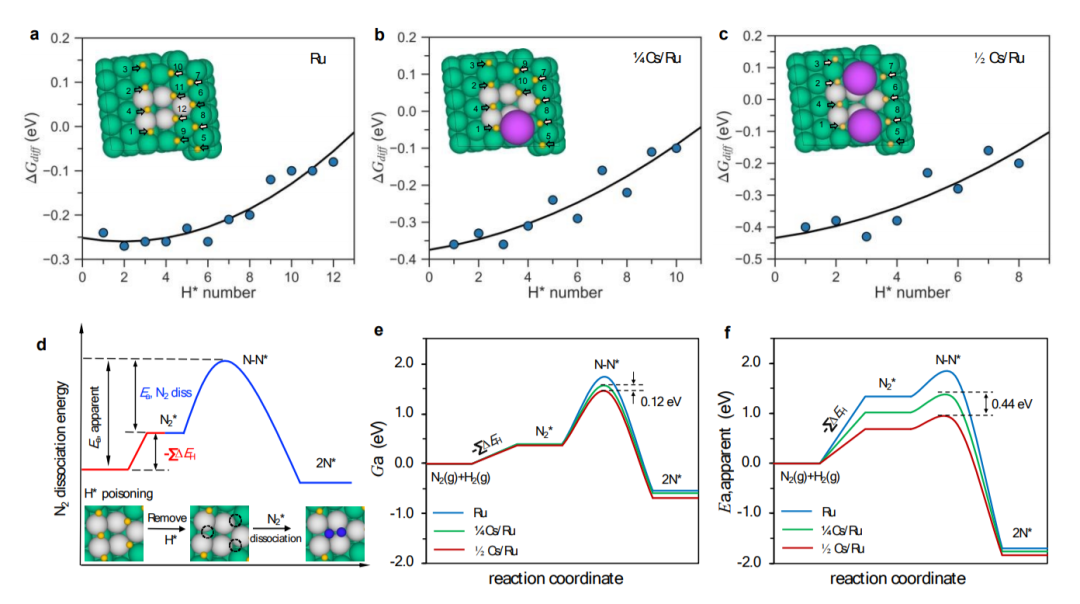
图5 (a-c)在Ru、1/4Cs/Ru和1/2Cs/Ru表面吸附H的覆盖率依赖的微分结合能与吸附H原子数的关系。灰色阴影区域表示在T=340 °C和PH2=7.125 bar时的放能吸附;(d)H*毒化钌表面上的N2解离。绿色、蓝色和黄色球体分别代表Ru、N和H。活性位点上的Ru原子用灰色标记;(e-f)Ru、1/4Cs/Ru和1/2 Cs/Ru表面上N2解离的自由能垒和表观势垒—低覆盖率情况模拟非原位促进,高覆盖率情况模拟原位促进。@RSC
如图5a-c所示,在实验条件下,N2解离位点周围所有H原子的自由能均低于0 eV,这意味着活性台阶位点都被非促进Ru上的氢完全覆盖,以及在¼和½Cs覆盖范围内。这意味着需要在N2解离之前需要除去共吸附H*物种。如图5d所示,活性位点周围的三个H*原子需要在原始Ru表面上的N2解离之前去除。在低Cs覆盖率的模型中,一个Cs原子取代了较低台阶上的一个阻塞H*吸附位点(图5b),因此另外两个H原子位点必须被去除。对于高Cs覆盖模型,H2的级数应为-0.5,在解离之前,只有一个具有负吸附自由能的H原子需要去除。观察到测得的活化能发生较大变化,而速率变化相对较小,这就是所谓的补偿效应。
05 成果启示
本文深入研究了Cs的促进作用,并表明纯金属Cs的原位投加对于氨合成来说,比常规制备的用Cs促进的非原位Ru催化剂的活性好得多。尽管高活性原位促进催化剂无法达到理想的温和条件标准(即<200˚C),但这项工作的主要优点之一是提供了对促进效应的深入探究,为发现高活性催化剂开辟了道路。该方法可以用于制备在温和条件下合成氨的活性催化剂,用于可持续的HB工艺。此外,原位促进催化剂表明,通过原位促进技术提高已知高活性氨催化剂的性能具有巨大潜力。这项技术及其潜力可以帮助氨催化剂研究领域摆脱使用稀有元素和复杂的前体化合物来合成新的催化剂。
06 参考文献 Vahid Shadravan, ANG CAO, Vanessa Jane Bukas, Mette K. Grønborg, Christian Danvand Damsgaard, Zhenbin Wang, Jakob Kibsgaard, Jens Kehlet Norskov and Ib Chorkendorff. Enhanced promotion of Ru-based ammonia catalysts by in situ dosing of Cs, Energy & Environmental Science, 2022. https://doi.org/10.1039/D2EE00591C
审核编辑 :李倩
-
网关助力催化剂产业升级,解决痛点问题!2024-08-14 771
-
石墨烯负载金属氧化物催化剂的制备方法2023-08-11 2072
-
可回收光催化剂的结构调控与催化性能研究2023-08-09 1633
-
构建提高酸性水氧化催化剂稳定性的氧扩散路径2023-08-02 1729
-
催化剂分离和循环利用问题2023-05-23 1577
-
应变效应对催化剂活性的影响2022-10-26 3226
-
Mo配位FeCoNiMo碳负载高熵电催化析氧催化剂图文解析2022-09-20 3152
-
低结晶和异质结构AuPt-Ru@CNT像高效多功能电催化剂2022-05-31 653
-
Nature:助力燃料电池催化剂!2018-09-15 6600
-
CH4与CO检测气敏元件中催化剂的制备与反应性能研究2016-12-17 759
-
可基于铁产生氢气发电的新型催化剂面世2013-02-19 1718
-
碱性醇类燃料电池新型催化剂的研究2011-03-11 1910
-
新型锌-空气电池阴极催化剂的制备和研究2009-11-07 774
-
酸催化剂浓度对钌络合物/ 溶胶2凝胶薄膜的发光氧气传感性能的影2009-07-06 767
全部0条评论

快来发表一下你的评论吧 !

