

Ru1Cu单原子合金促进HMF电催化加氢
电子说
描述
01
研究背景
将生物质分子(一种可用且丰富的可再生有机碳源)转化为有价值的有机化学品是减少化学工业碳排放的有效方法。在各种生物质分子中,由C6 糖水解产生的5-羟甲基糠醛 (HMF) 可以被催化还原制备2,5-二羟甲基呋喃 (DHMF),它是生产聚醚、聚氨酯和聚酰胺的重要前驱体。目前,它是由HMF在高压和高温下加氢制备的。因此,需要开发在温和条件下不使用H2将HMF氢化为DHMF的可持续方法。最近的进展表明,电化学驱动是替代加氢过程的一种可持续方式。对于HMF加氢生成DHMF,它可以通过直接电还原途径进行,其中羰基参与电极处的电子转移,或者通过表面吸附 H(表示为 H*)进行电催化加氢 (ECH)。然而,HMF加氢活性通常比析氢反应 (HER) 低,导致DHMF的法拉第效率 (FE) 降低。为了克服这个问题,HMF氢化最好在具有高HER过电位的电极上进行,例如Cu和Ag。之前的大多数报告都是基于对低浓度HMF(通常为 20 mM)的研究。高浓度的HMF(》100 mM)通常会导致FE和DHMF的选择性降低,这是由于严重的HMF二聚化。近年来,由位于主体金属基体中的外来金属的孤立原子组成的单原子合金(SAA)催化剂引起了较大的关注。除了最大限度地利用单原子的特点外,SAA还表现出独特的双金属协同效应。
02
成果简介
清华大学段昊泓教授制备的Ru1Cu单原子合金在用于HMF电化学还原中表现出比铜合金更出色的性能,在-0.3 V(vs. RHE)下DHMF的产率为0.47 mmol cm-2h-1,FE为85.6 %。Ru1Cu单原子合金也可以在高浓度下发生HMF二聚反应,DHMF的FE在高浓度(100 mM)时基本保持不变。该工作“Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst“为题发表在《Angewandte Chemie International Edition》上。
03
研究亮点
1. 单原子Ru在促进水解离中起着关键作用,增加了H*的表面覆盖率,减少了HMF的羰基覆盖率;
2. 通过电催化加氢(ECH) 机制获得了DHMF。
04
图文导读
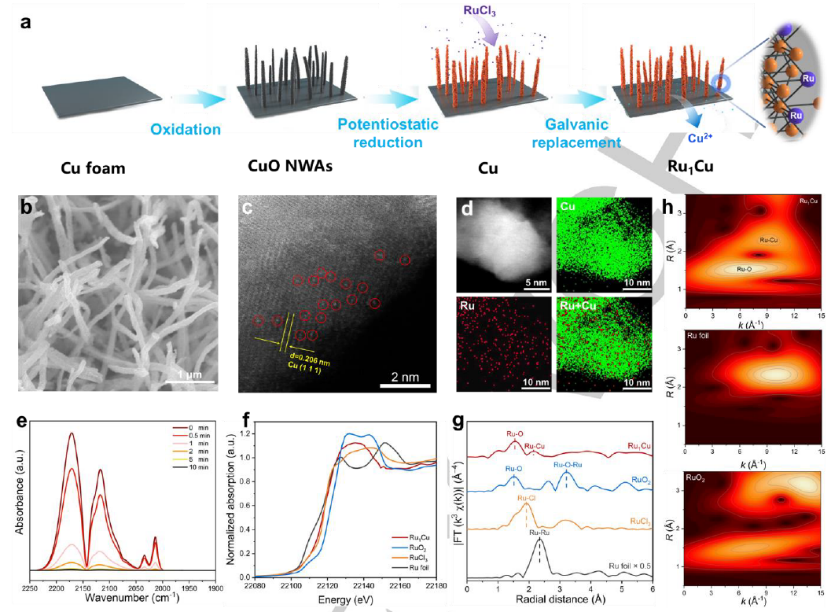
图 1. (a) Ru1Cu SAA合成示意图。Ru1Cu SAA的 (b) SEM。(c) RHAADF-STEM,其中红色圆圈显示单分散的Ru原子。(d) STEM-EDS映射。(e) 在室温下用He吹扫的Ru1Cu SAA的CO-DRIFTS光谱。(f) Ru K-edge的XANES 光谱。(g) Ru K-edge的傅里叶变换EXAFS光谱和 (h) Ru箔、RuO2和Ru1Cu SAA的小波变换EXAFS光谱。
合成过程如图1a 所示。通过在碱性条件下用 (NH4)2S2O8对Cu泡沫进行简单的化学氧化,然后在空气中煅烧来制造CuO纳米线阵列 (NWA)。通过在电化学系统中在阴极电位下还原母体CuO纳米结构,获得了Cu NWA。然后,通过电流置换法将单原子Ru引入Cu NWAs中,获得Ru1Cu SAA。SEM(图 1b)显示了Ru1Cu的纳米线阵列形态,这表明原始的Cu结构被保留。如图1c所示,HAADF-STEM与EDS相结合显示了Ru原子在 Cu NWA 中的孤立分散,没有观察到Ru簇或纳米颗粒。EDS-mapping(图 1d)证实了 Ru 物种在整个Cu NWA中的存在和均匀分布。通过CO-DRIFTS证实了Ru 在Ru1Cu SAA中的分离(图 1e)。图 1f 显示了Ru1Cu的Ru K边的X射线吸收近边光谱 (XANES)。Ru1Cu的吸附边缘位于Ru箔和RuO2之间,靠近RuCl3,在扩展的 X 射线吸收精细结构光谱(EXAFS,图 1g)中,1.50 Å 处的Ru1Cu的第一层归因于Ru-O,2.17 Å归因于Ru-Cu。图 1h 中的小波变换 (WT) 进一步证实了 Ru-Cu 散射的存在。Ru-Cu键(2.17 Å,9.1 Å-1)存在于Ru1Cu中,明显不同于Ru箔和RuO2,表明形成了分散在铜纳米线上的原子级钌原子。
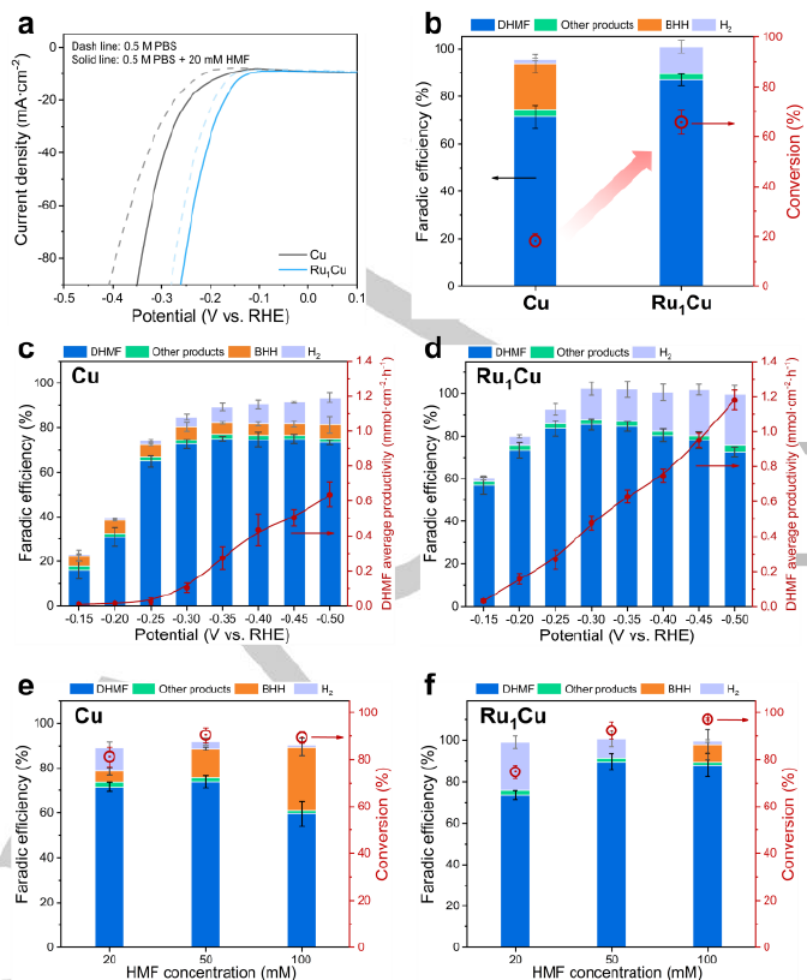
图 2.Ru1Cu SAA 和Cu的电化学性能。(a) 含和不含20 mM HMF的0.5 M PBS中Cu和Ru1Cu的LSV曲线。(b) Cu和Ru1Cu的产物分布及相应转化率。DHMF 在 (c) Cu 和 (d) Ru1Cu上的产物分布和生产率。不同浓度的HMF 下,HMF在 (e) Cu 和 (f) Ru1Cu上的产物分布和相应转化率。
图2a显示,添加20 mM HMF后,Ru1Cu SAA和Cu均表现出增强的电流密度,表明HMF的电化学还原比HER更有利。图2b显示,Ru1Cu SAA 比Cu表现出更高的转化率和DHMF的更高FE。如图 2c-d所示,在不同的电位下,与Cu相比,Ru1Cu SAA显示出更高的DHMF生产率和FE。Cu在HMF 浓度增加时显示DHMF的FE降低(图 2e),这主要是由于BHH的形成。相比之下,Ru1C在高HMF浓度下显示抑制HMF二聚化(图2f),导致DHMF 的FE更高。
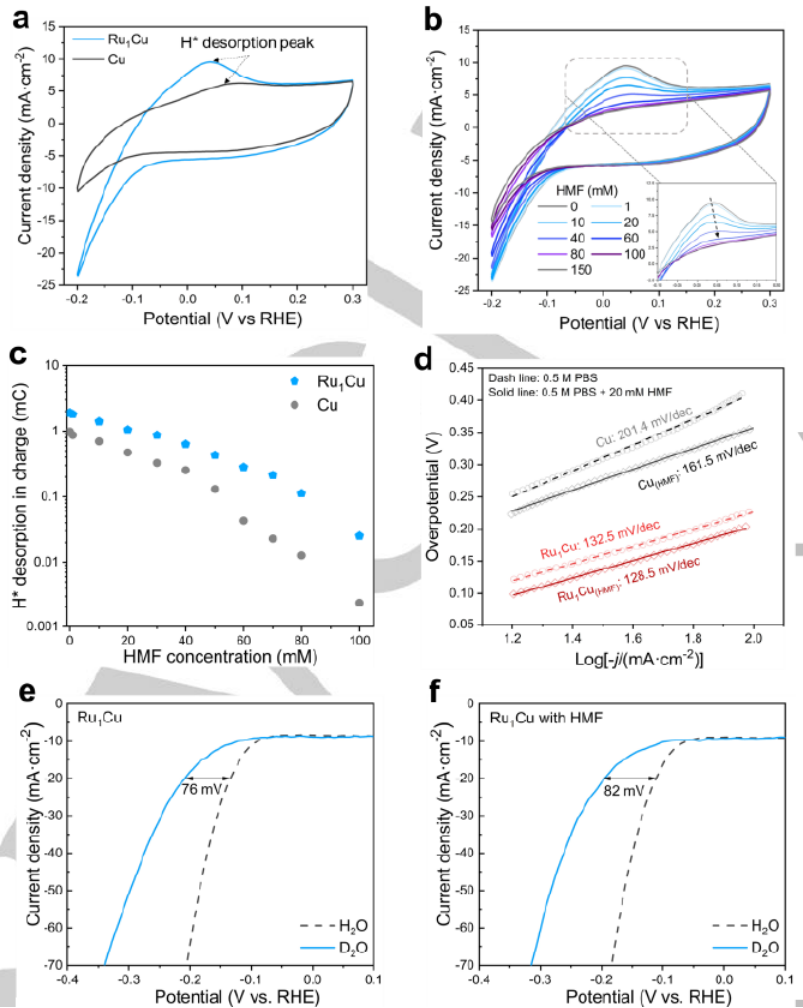
图 3. (a) Cu和Ru1Cu在 0.5 M PBS中的CV曲线,扫描速率为 100 mV·s-1。(b) 添加不同浓度HMF的Ru1Cu的CV曲线,插图显示放大的H*解吸峰。(c) 不同HMF浓度下 Cu和Ru1Cu上的H*解吸电荷。(d) 在HMF存在和不存在的情况下,HER在Cu和 Ru1Cu上的Tafel图。(e-f) 在不添加和添加20 mM HMF的情况下,在pH 7.0或pD 7.0电解液中Ru1Cu的LSV曲线。
纯电解液中的循环伏安图(CV)在Cu和Ru1Cu的阳极扫描中显示 0.09 V 和 0.03 V的峰值,分别归因于 H* 解吸(图 3a)。H*解吸峰明显大于Ru1Cu,表明电极上存在更多的H*。之后,随着 HMF 的加入,两个样品的 H* 解吸峰变得更小并被完全抑制(图 3b)。通过对H*解吸峰的面积进行积分,然后计算不同HMF浓度下的相应电荷(图 3c),Ru1Cu显示出更高的H*解吸电荷量,从而反映了更高的H*覆盖范围。通过Tafel图评估HER和电化学还原的动力学(图 3d)。Cu和Ru1Cu的HER的 Tafel 斜率分别为 201.4 和 132.5 mV dec-1,这表明Volmer步是两种样品的速率决定步。随着 HMF 的加入,这两个样品的 Tafel斜率表现不同。与 HER (201.4 mV dec-1) 相比,在 HMF存在下,Cu的Tafel斜率降低,这意味着HMF的电化学还原在动力学上比HER优于Cu,并且 RDS也相应变化。与HER(132.5 mV dec-1)相比,Ru1Cu在HMF存在下表现出相似的Tafel斜率,这表明在Ru1Cu上电化学过程的 RDS 受引入HMF的影响较小,即 RDS可能仍然是HMF电化学还原中的Volmer步骤。在LSV中,HER 和电化学还原反应都揭示了动力学同位素效应 (KIE)(图 3e)。对于 HER,在 Cu上观察到明显的阴极位移,表明氘释放 (DER) 的动力学比HER更缓慢。然而,与Ru1Cu相比,阴极位移不太显着(图 3e),这意味着单原子Ru在促进水分解中起着至关重要的作用,可能是通过促进产生H*的 Volmer 步骤。对于 HMF的电化学还原,在Ru1Cu上观察到类似的KIE阴极位移程度(图 3e,f),表明电化学还原的 RDS 保持为 Volmer 步骤,这与HER的几乎相同的 Tafel 斜率值和HMF的电化学还原一致(图 3d)。因此,推断HMF在Ru1Cu上的电化学还原可能遵循ECH机制,其中H*通过Volmer步骤产生,用于随后的HMF加氢。对于通过ECH过程进行HMF还原,即H*生成后HMF加氢,它将遵循 Langmuir-Hinshelwood (L-H) 机制,表明HMF和H2O之间存在竞争吸附。因此,可以预期在更高的 HMF 浓度下会出现负反应顺序。相比之下,对于HMF的电还原,它将遵循 Eley-Rideal (E-R) 机制,这表明HMF和H2O之间存在非竞争性吸附,这在较高的HMF 浓度下由零反应级揭示。相比之下,Cu 显示0.2级,接近零级。
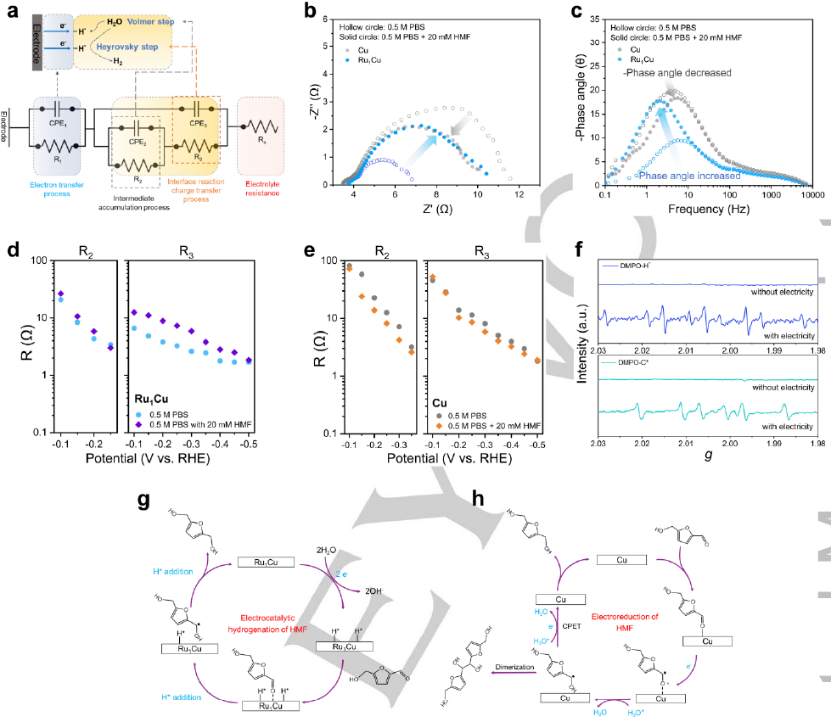
图4. (a) 电化学阻抗谱拟合中使用的等效电路模型和所提出的Cu和Ru1Cu的HER机理示意图。在-0.3V(vs. RHE)下Cu和Ru1Cu上(b) 奈奎斯特图和 (c) HER 波特图。在存在和不存在HMF的情况下,在从-0.1 V到-0.5 V的电位窗口下 (d) Ru1Cu 和 (e) Cu中间积累的等效电阻 (R2) 和界面反应电荷转移过程电阻 (R3) 的相关性。(f)Ru1Cu上碳和氢自由基的准原位EPR谱图。HMF在 (g) Ru1Cu和 (h) Cu上的电化学还原机理。
引入HMF来评估电化学还原行为。在相同的施加电位下,随着 HMF 的加入,Cu 上中低频的半圆(图 4a,b)和相位度(图 4c)下降,但在Ru1Cu上观察到相反的趋势,表明随着 HMF 的加入,Ru1Cu和Cu上的电荷转移过程以不同的方式发生了变化。比较了不同电位下有或没有HMF的中间积累过程 (R2) 和界面反应电荷转移过程 (R3) 的等效电阻(图 4d-e)。对于Ru1Cu,R2(图 4d,左)没有明显变化,因为Volmer步骤是HER和ECH在Ru1Cu上的常见步骤。而 R3(图 4d,右)在从-0.1 V到-0.45 V的电位窗口下随着HMF的添加而增加,这意味着在HMF存在下,Heyrovsky步骤在动力学上是不利的。至于Cu,R2(图4e,左)随着HMF的添加而降低,这表明HMF的电还原更倾向于通过CPET工艺而不是Volmer步骤进行。R3(图4e,右)仅略微降低,这可以通过CPET在HMF的电化学还原和HER中的Heyrovsky步骤显示出比较电阻的相似动力学来初步解释。图4f显示在纯电解质中观察到H自由基超过Ru1Cu,这意味着水可以被还原为H自由基。当随后引入HMF时,碳自由基被检测为六重体。基于上述组合电化学技术,提出在Cu中制备单原子Ru改变了HMF的电化学还原机制。在Ru1Cu 上,水在单原子Ru上被活化,伴随着电子转移和解离成H*物种,然后是两个H* 物种通过ECH机制与HMF的羰基反应生成DHMF(图 4g)。而 Cu 通过电还原机制进行,其中HMF的羰基接受来自电极的电子并通过CPET工艺与邻近的质子相结合。生成的自由基中间体通过另一个CPET过程进一步转化为DHMF,或者可能通过与另一个自由基的C-C偶联发生二聚化(图 4h)。
05
总结与展望
作者合成了一种Ru1Cu单原子合金,它对HMF的电化学还原比Cu表现出更好的性能,实现了更高的DHMF生产率(0.47 mmol·cm-2·h-1)和 FE(85.6%)。在高HMF浓度(100 mM)下DHMF的FE为87.5%。通过使用各种电化学技术表征的动力学结果表明,Ru1Cu和Cu对应物的电化学还原机制不同。单原子Ru促进水的离解产生H*物质,这些物质通过ECH机制与HMF有效反应生成DHMF,而Cu遵循CPET工艺。这项工作为实现生物质升级的高效电催化加氢提供了一种新的策略。
06
文献链接
Electrocatalytic Hydrogenation of 5-Hydroxymethylfurfural Promoted by a Ru1Cu Single-Atom Alloy Catalyst (Angew. Chem. Int. Ed.2022, DOI: 10.1002/anie.202209849)
文献链接:
https://doi.org/10.1002/anie.202209849
审核编辑 :李倩
-
中国科大制备出34种单原子催化剂的方法2020-03-16 6493
-
电催化过程2020-11-18 2406
-
高活性生物质碳负载Fe/Pt单原子双功能催化剂开发2021-02-12 3286
-
电催化与电催化电极的原理及研究2021-02-10 3552
-
一种高效评估复杂合金纳米团簇电催化析氢反应活性2021-06-18 2935
-
低结晶和异质结构AuPt-Ru@CNT像高效多功能电催化剂2022-05-31 653
-
单原子Cu催化剂的重构现象以及它们在电催化反应的应用2022-09-20 3990
-
利用可持续方法获得绿色能源的电催化分解水制氢2022-09-29 4930
-
介绍三金属电催化剂对C2醇的电催化机理2022-10-20 3710
-
EnSM:锂硫电池单原子催化剂的基础、应用和机遇2022-12-22 2622
-
PtNi纳米合金可与Ni单原子发生原子置换2023-01-03 3069
-
离子共价有机骨架衍生钴单原子和纳米颗粒用于高效电催化2023-01-31 3385
-
中科院大连化物所《Angew》:开发出单原子合金材料2023-07-05 1074
-
亚纳米尺度原子级分散Rh催化C≡N加氢研究新进展!2023-07-19 860
-
相调控对镍锡合金的电催化氮还原调控机制研究2024-03-26 2271
全部0条评论

快来发表一下你的评论吧 !

