

基于人脑类器官微生理分析平台 了解免疫驱动的大脑衰老
描述
免疫系统的老化驱动系统性老化和与年龄相关的疾病的发病机制(如阿尔茨海默病)。但是由于体外研究的有限性,在理解免疫驱动的衰老,尤其是大脑衰老方面,仍然存在重大的知识空白。因此,研发神经-免疫相互作用的优良模型显得尤其重要。
来自哈佛医学院的Luke P. Lee教授课题组与印第安纳大学布明顿分校的郭峰课题组合作,通过3D打印开发了人脑类器官微生理分析平台(Microphysiological analysis platform,MAP),可动态监测免疫驱动大脑衰老过程,该工作以题为“Understanding Immune-Driven Brain Aging by Human Brain Organoid Microphysiological Analysis Platform”的研究报告于近期刊登在Advanced Science上。
构建人脑类器官微生理分析平台(MAP)了解免疫驱动的大脑衰老
为了解免疫驱动的脑衰老过程,研究人员开发了人脑类器官MAP,从老年和年轻的供体分离单核细胞(图1a),和人脑类器官相互作用,来模拟免疫驱动的大脑衰老。MAP有2个部分组成(图1b、c):1)一个中空的网状管状可灌注支架,与两个介质容器相连,用于支持类器官沿管状支架表面生长,灌注氧气和营养物质,并模拟免疫细胞(例如单核细胞)在血管中流向类器官;2)薄玻璃盖玻片上的有机体支架,用于将有机体固定在孔板内。发育中的类器官可以在管状可灌注支架和类器官支架之间的有限空间内(400μm内)长成煎饼状结构。一旦与摇摆流相结合,MAP可最大限度地减少玻片上培养的类器官的坏死和缺氧,进而促进免疫细胞的无创流入,实现动态观察免疫细胞-类器官相互作用的延时成像(图1d)。
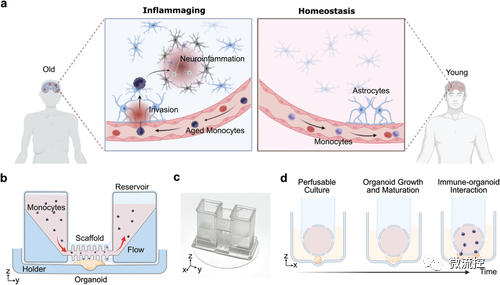
图1 构建人脑类器官微生理分析平台(MAP)了解免疫驱动的大脑衰老
芯片上构建人脑皮质类器官的可灌注培养
在MAP应用于人脑类器官培养之前,首先生成并优化了在芯片上培养人脑皮质类器官。通过模拟,描述了MAP装置内的3D分布图(图2a左)和侧视图(图2a右)(摇摆角=15,摇摆频率=0.1rpm)。进一步测量了流速对摇摆角的依赖性(图2b中的点,摇摆频率=0.1rpm),这与模拟结果相匹配(图2b中的红色虚线)。该研究采用了一种在芯片上生成和培养人脑皮质类器官(human cortical organoids,hCO)的方案(图2c)。具体来说,用SB-431542和XAV-939将人类胚胎干细胞(human embryonic stem cells ,hESC)组装为直径约300µm的胚胎体(embryonic bodies,EBs),通过抑制TGF和Wnt/β-catenin信号传导来诱导神经和形成图像。在第9天将EB转移到孔板内的类器官支架上,原位嵌入Matrigel中,并在装置内培养15天,直到形成围绕网状管状支架形成的中空结构(图2d)。培养基中添加多种生长因子,如BDNF、EGF或FGF,用于诱导神经元分化、成熟和存活。在第24天,孔板内的装置被转移到摇摆平台以产生内腔流体流动,同时添加抗坏血酸和cAMP,以支持神经祖细胞分化为成熟神经元、类器官生长。
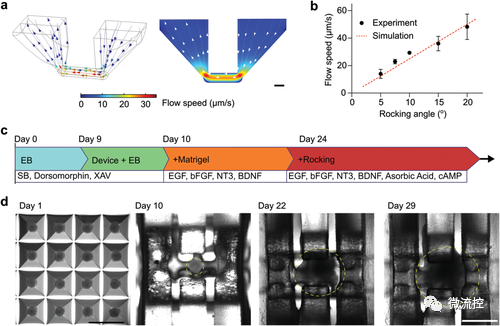
图2 芯片上人脑类皮质类器官的培养
人脑类器官MAP表征
使用活力测定、免疫荧光染色和RNA-Seq方法描述了芯片上培养的hCOs。通过检测第9、16、24天芯片上培养的hCO细胞活力,发现其保持非常高的活力(图3a)。使用PAX6(神经祖细胞)和MAP2(神经元)进行免疫荧光染色,确认hCOs可正确发育和分化(图2b)。RNA-Seq结果提示芯片上培养的hCO具有前脑的转录谱特征(图2c、d、e)。总体而言,这些结果表明,MAP系统可以促进hCO中的前脑命运承诺、神经元和突触的成熟。
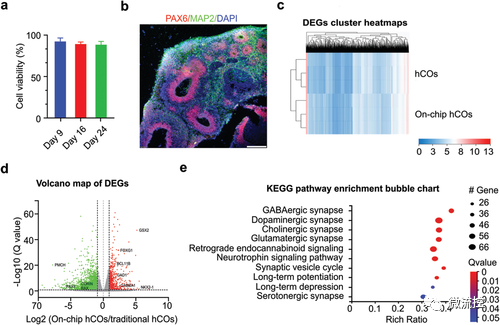
图3 芯片上培养的类器官表征
使用人脑类器官MAP系统研究单核细胞可浸润类器官
在老年的大脑中,单核细胞在受伤或神经系统疾病期间可通过脑血屏障(Brain-blood barrier,BBB),在大脑中浸润增加。动物实验表明,老年小鼠在受伤/慢性炎症中CCR2+的单核细胞浸润增加,可能是基于MCP1/CCR2趋化性信号进入大脑,进而诱导炎症。为了研究年轻和老年的单核细胞对hCOs的浸润能力,分离年轻和老年供体的外周血单核细胞灌注到芯片上培养的hCOs中。免疫荧光检测单核细胞(图3a),发现24小时后老年的单核细胞浸润细胞数是年轻的3倍(图4b),浸润深度更高(图4c),表明老年的单核细胞渗透能力明显高于年轻的单核细胞。将老年单核细胞和年轻单核细胞分别与类器官共培养后,用ELISA检测培养上清,发现MCP-3在老年单核细胞和类器官共培养上清中显着上调(图4d)。利用qRT-PCR发现MCP-3在老年单核细胞和类器官共培养细胞中显著上调(图4e)。这表明老年的单核细胞浸润能力增加可能归因于MCP1/MCP3/CCR2信号轴,根据文献推测这可能是由hCOs中活化的星形胶质细胞分泌的。
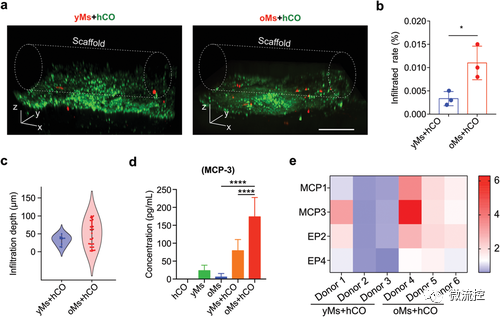
图4 单核细胞浸润人脑类器官的表征
使用人脑类器官MAP系统研究单核细胞驱动的脑衰老
细胞衰老、神经元凋亡是大脑衰老的标志。通过钙染料(Cal520,绿色)对hCO的神经元进行染色,发现老年组中的神经元显示出凋亡形态(图5a)。通过对芯片上共培养的单核细胞和hCO的qRT-PCR分析,发现前列腺素E2(PGE2)、COX-2和TNF-α显著上调(图5b),它们是与年龄相关巨噬细胞相关的促炎基因,也是星形胶质细胞活化的指标。通过分析促炎细胞因子,进一步证实了老年的单核细胞在hCOs中诱导出促炎反应(IL-1-β、TNF-α均升高)(图5c)。还发现在老年的单核细胞+hCOs组中,p16和p21等衰老相关标志物的表达显着升高。这些结果表明,来自老年人的浸润单核细胞在hCOs中诱导出促炎反应并促进脑老化。
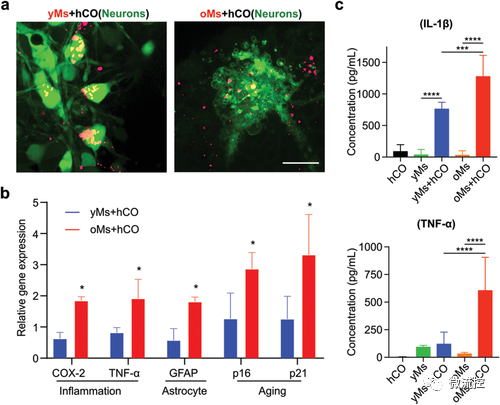
图5 单核细胞驱动的大脑衰老的表型表征
利用MAP这个系统,发现从老年人身上分离出的单核细胞可以对年轻的大脑类器官产生独特的衰老表型。此外,浸润的衰老单核细胞周围的神经元也表现出凋亡形态,进一步支持了衰老的外周免疫系统可能导致大脑衰老的假设。目前的MAP模型的一个限制是类器官来自具有长端粒的人类胚胎干细胞,这些端粒不能反映衰老大脑的衰老表型。总之,该研究揭示了一种无需外部基因操作即可在hCO内诱导衰老表型的新的潜在方法,为研究免疫驱动的大脑衰老以及恢复衰老大脑的稳态提供了新的研究途径。
-
芯片上的器官2013-07-12 3150
-
什么是基于Zynq的人类生理模拟系统?2019-08-01 1600
-
微生物与免疫练习题(红色表示正确答案)2010-03-03 928
-
类脑芯片,机器超越人脑的最后一击2018-03-21 7884
-
可追踪类器官的RFID技术2018-06-19 2114
-
大脑芯片与血脑屏障芯片结合的器官芯片,研究血脑屏障与大脑相互作用2018-09-05 5015
-
类器官芯片与传感器的结合2019-04-15 12229
-
智慧城市的大脑和人脑有什么差别2019-07-30 3014
-
芯片上的器官模型 有专门的微流控平台2020-03-23 3742
-
中科院利用器官芯片技术模拟新冠病毒感染诱发肺损伤和免疫反应等2021-01-15 3335
-
类器官和器官芯片的研究进展综述2022-05-25 6042
-
为微型大脑打造的微型脑电图电极帽2022-08-31 1451
-
基于人类脑器官移植为人类大脑疾病的治疗提供新方法2022-10-25 1194
-
天津大学科学家突破人类大脑器官成功驱动机器人2024-07-08 1381
-
芯片上集成功能性血管化类器官的微流控平台2024-11-18 866
全部0条评论

快来发表一下你的评论吧 !

