

微流控电化学磁免疫传感器的原理是什么
描述
近日,英国期刊Talanta在线刊登香港科技大学电子与计算机工程系Chiye Zhang研究团队的研究成果“Microfluidic electrochemical magnetoimmunosensor for ultrasensitive detection of interleukin-6 based on hybrid of AuNPs and graphene”,详细报道了用于检测类风湿关节炎(rheumatoid arthritis,RA)潜在生物标志物——白介素6(interleukin-6,IL-6)的微流控电化学磁免疫传感器。
类风湿关节炎(RA)是一种病因未明的慢性、以炎性滑膜炎为主的系统性疾病,致残率高、预后差,目前RA的治疗仍然依赖于抑制炎症。虽然自身免疫性疾病无法治愈,但早期诊断和定期治疗可以显著减轻症状。
研究表明,多种细胞因子和蛋白酶参与RA的发病机制,包括肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素6(IL-6)。这些细胞因子之间的协同作用在代谢诱导中至关重要。IL-6是一种由多种细胞(包括T细胞、B细胞、单核细胞和成纤维细胞)合成的多效性炎症因子。在RA患者血清中,除TNF-α和IL-1β外,还有大量IL-6,据相关研究报道,IL-6的表达水平与RA疾病活动指标呈正相关。
因此,开发一种灵敏、快速、定量检测IL-6的诊断工具,对于RA的早期检测显得至关重要。在该项研究中,研究人员将电化学传感器、微流控和磁颗粒三者结合起来,开发了一种基于石墨烯和金纳米颗粒的新型集成微流控电化学磁免疫传感器,用于定量血清样本中的IL-6。
微流控电化学磁免疫传感器的原理
微流控电化学磁免疫传感器是通过集成微型金电极和微流控腔室,通过电化学方法在微型金电极表面修饰石墨烯和金纳米颗粒,促进电子转移,如图1所示。
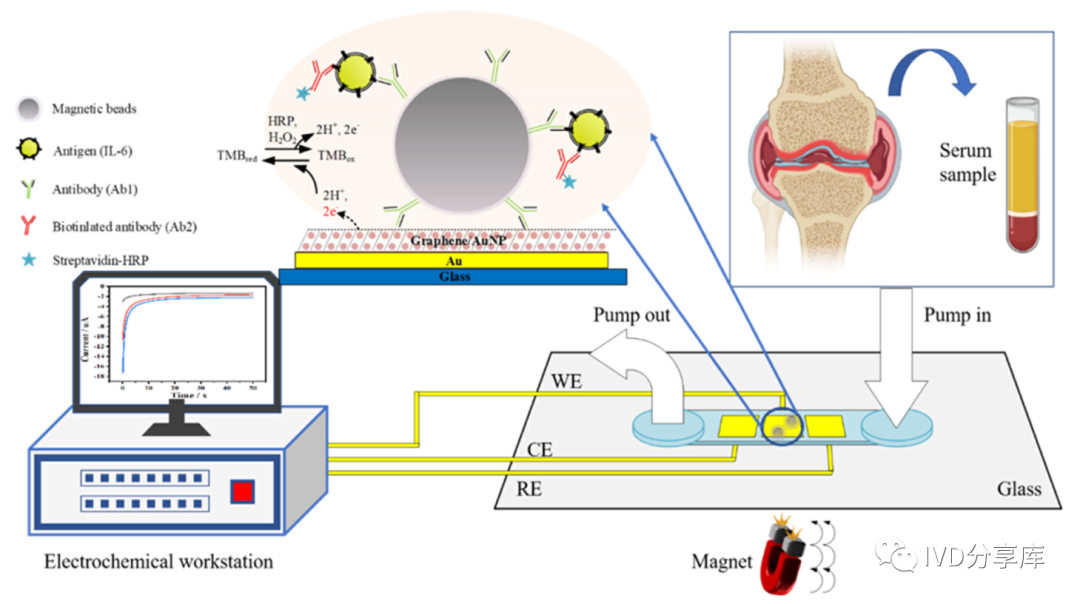
图1 微流控电化学磁免疫传感器的检测原理图。
首先,在微流控腔室外构建好磁珠免疫夹心复合物。在待测物(IL-6)、生物素化检测抗体存在的情况下,由于捕获抗体磁珠、待测物及生物素化检测抗体之间的特异性识别,从而在磁珠上形成免疫夹心复合物。再添加HRP-链霉亲和素溶液,由于链霉亲和素和生物素之间的特殊亲和力,HRP与免疫夹心结构结合。
其次,磁铁捕捉磁珠免疫夹心复合物。将制备好的磁珠免疫夹心复合物溶液注入微流控腔室中,在微型电极的正下方放置磁铁,得以捕捉免疫磁珠。
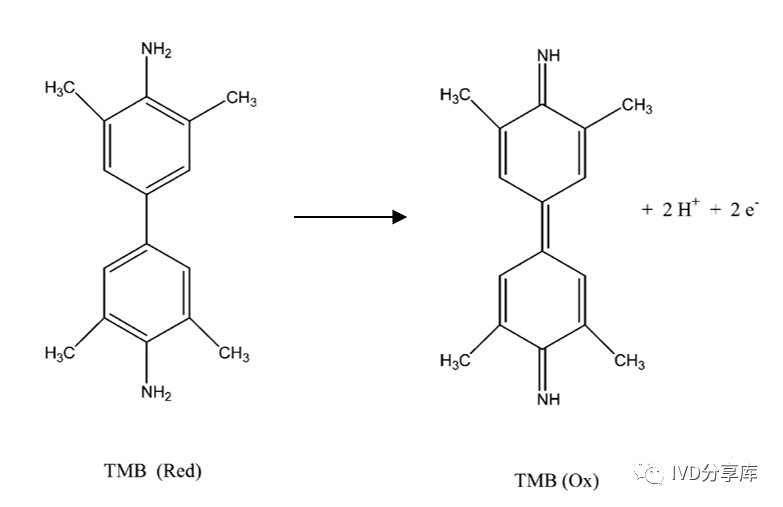
最后,加入底物溶液,开始电化学信号检测。向微流控腔室中注入TMB/H₂O₂底物溶液,由于HRP在H₂O₂存在下的催化作用,TMB被氧化为TMB(Ox)。酶反应产物TMB(Ox)具有电活性,因此可以进行电化学检测。待测物IL-6的浓度在一定时间内与TMBox呈正相关。通过测量TMB(Ox)的还原电流,可以间接获得IL-6的浓度。
构建ELISA磁珠免疫夹心结构
研究人员在96孔板中构建了ELISA磁珠免疫夹心结构,具体步骤如下:
1)将50ul捕获抗体磁珠与40ul不同浓度的IL-6混合,4℃孵育过夜,并持续振荡;
2)孵育后,在96孔板的底部放置磁铁,捕捉IL-6结合的捕获抗体磁珠;然后使用0.1% PBST洗涤三次,将未与磁珠结合的IL-6洗掉;
3)加入100ul生物素化的检测抗体,37℃孵育1小时,在磁珠上形成免疫夹心结构;
4)0.1% PBST洗涤三次后,加入100ul HRP-链霉亲和素复合物,37℃孵育30分钟;
5)0.1% PBST洗涤五次后,加入40ul PBS重悬磁珠免疫夹心复合物,保存在4℃中备用。
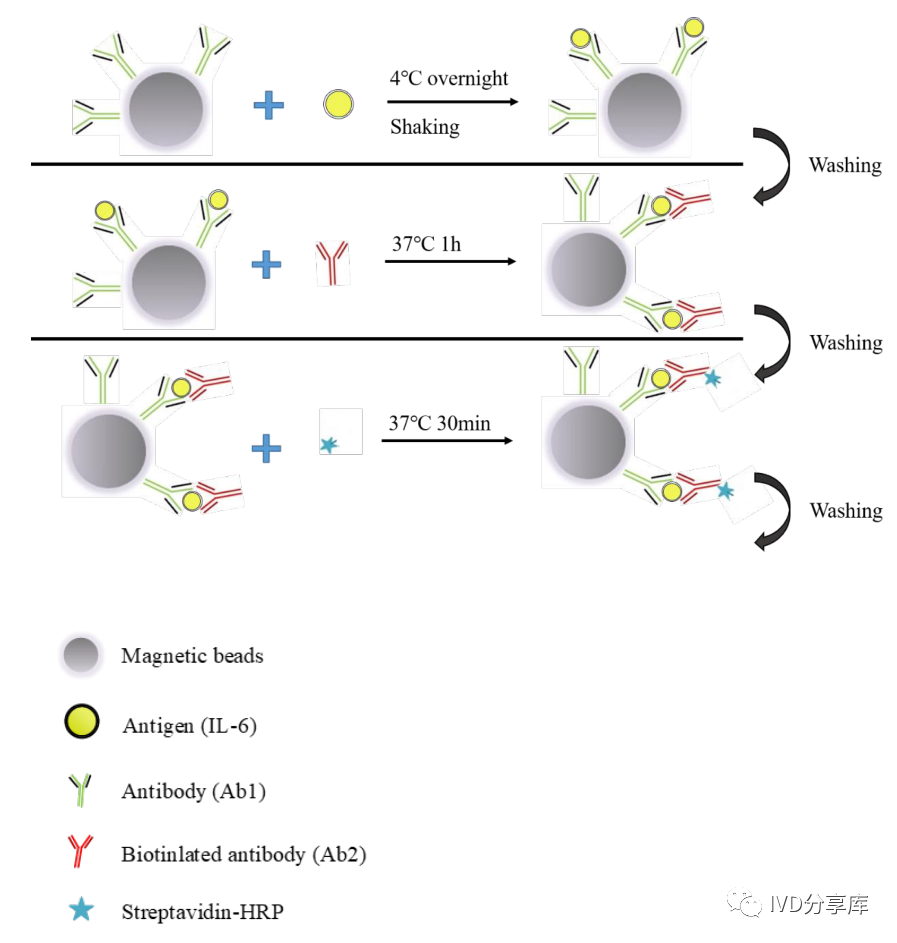
图2 磁珠上构建免疫夹心结构。
微流控电化学磁免疫传感器性能测试
将上述备用的ELISA磁珠免疫夹心结构溶液注入微流控反应室中,并应用磁铁捕捉电极表面的磁珠。随后,将基质混合物TMB/H₂O₂转移到微流控反应室中并孵育15分钟,采用I-T法(0.8V,50s)检测待测物浓度,线性范围为0.97至250pg/mL,检测限(LOD)为0.412pg/mL。测试结果如下图所示。
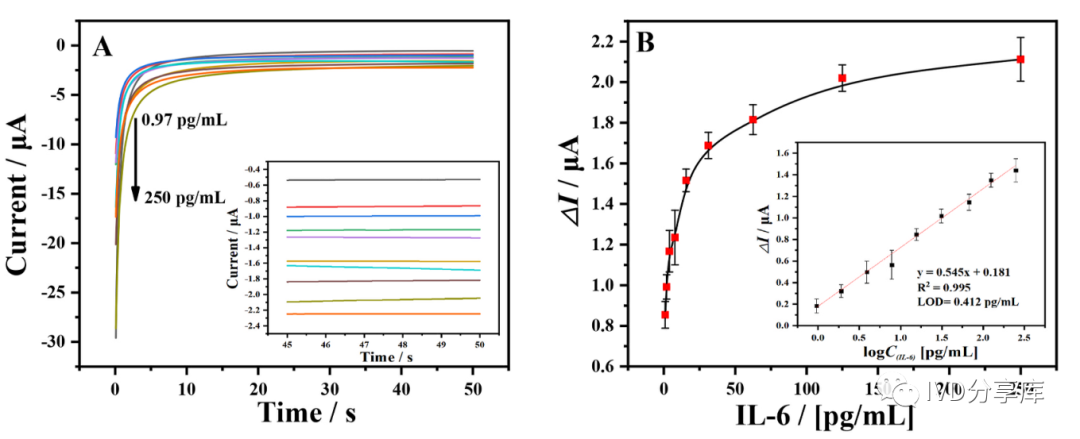
图3 (A)不同浓度IL-6的电流响应;(B)电化学磁免疫传感器对IL-6的校准图,插图为电流与IL-6浓度对数之间的线性关系。
人血清样本的电化学测量
为了研究微流控磁免疫传感器在实际临床应用中的可行性和有效性,研究人员对加入不同浓度IL-6的人血清样本进行了测试。如下表所示,回收率在93.37%到103.84%之间,相对标准偏差小于10%。这一结果表明,该研究中的微流控电化学磁免疫传感器具有较好的可靠性和精度。

审核编辑:刘清
-
南京邮电大学:研发超灵敏电化学发光免疫传感器检测人补体因子H相关蛋白!2023-07-28 1613
-
基于白介素6的微流控电化学磁免疫传感器2022-09-02 2314
-
电化学传感器的基本原理2020-12-24 5597
-
电化学传感器的组成以及电化学传感器的原理2020-10-28 7588
-
电化学传感器的发展怎么样?2020-03-25 3142
-
基于电化学传感器的Arduino兼容电化学气体检测电路CN03572020-03-12 4207
-
电化学传感器的优缺点_电化学传感器的应用2019-09-29 24659
-
应用电化学传感器的设计2018-11-15 2981
-
电化学传感器OFweek Mall优缺点_电化学传感器怎么用2018-07-20 1009
-
电化学传感器2015-04-17 3162
-
什么是电化学传感器2012-01-08 6938
-
电容型免疫传感器2009-03-06 1207
-
电化学传感器ppt2008-07-02 11657
全部0条评论

快来发表一下你的评论吧 !

