

基于微流控和细胞3D培养技术设计的PMC-β和β-M可快速重塑葡萄糖稳态
描述
近年来,组织工程领域迅速发展,为胰岛细胞移植提供了可靠的解决方案。借助细胞封装技术植入的胰岛与机体形成免疫隔离屏障,允许葡萄糖、氧气、营养物质、代谢废物和信号分子通过微囊双向扩散,同时阻止免疫细胞、免疫活性物质等对移植胰岛细胞的攻击。
据麦姆斯咨询报道,东南大学附属中大医院内分泌科主任李玲教授与国内外知名学者深度合作,医工融通,于近期在Chemical Engineering Journal和NPG Asia Materials期刊发表两项最新研究,通过微流控技术和医学工程方法构建载胰岛β细胞聚集体的微载体(PMC-β)及多孔胰岛β细胞微胶囊(β-Mi),展示了胰岛“类器官”移植后能逃避免疫攻击,并持续释放胰岛素以重建葡萄糖稳态。研究工作得到国家重点研发计划干细胞研究与器官修复项目以及江苏省重点研发计划临床前沿技术等项目支持,李玲教授的研究生李静波、刘小钰分别为两篇文章的第一作者。
在具体的研究过程中,研究人员基于微流控和细胞3D培养技术设计的PMC-β和β-Mi能够在体外模拟体内微环境,对胰岛细胞进行3D培养,且均具有良好的生物相容性,其结构可允许小分子物质自由进出,在保证物质交换效率的同时可抵御免疫细胞的攻击。另外,PMC-β和β-Mi可以延长移植胰岛细胞在体存活时间,并持续释放胰岛素,将二者移植于糖尿病小鼠网膜,可快速重塑葡萄糖稳态,有望为糖尿病患者胰岛移植提供新策略。
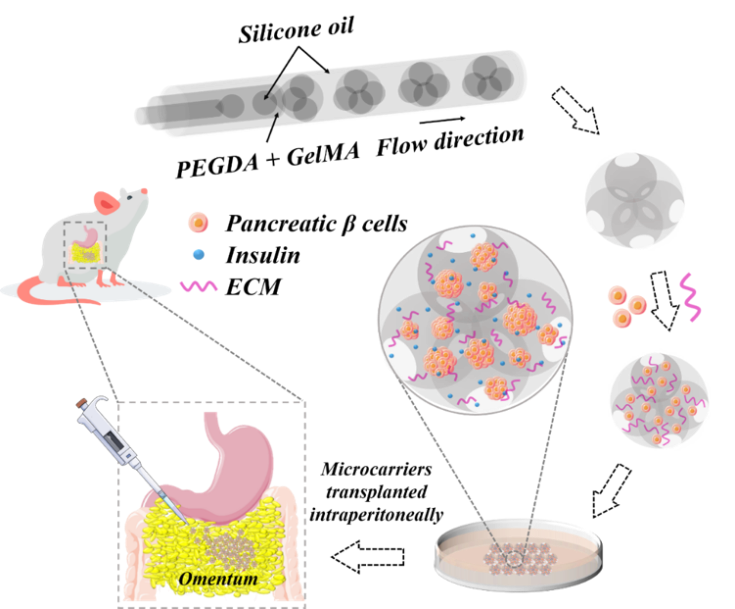
图1 基于微流控双乳液滴模板系统制作可控的多孔微球,填充细胞外基质及胰岛β细胞,形成3D胰岛β细胞聚集体的微载体(PMC-β),并将其移植于糖尿病小鼠网膜处,评价其胰岛素分泌功能及恢复葡萄糖稳态的潜力。
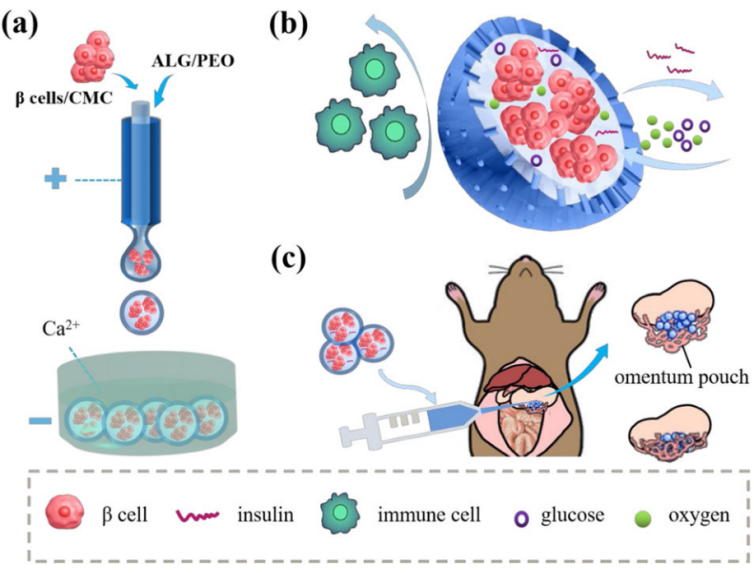
图2 微流控电喷雾系统制备核壳结构多孔胰岛β细胞微胶囊(β-Mi),能隔离免疫细胞,进行氧气和营养物质的交换,并响应葡萄糖变化释放胰岛素。将其移植于糖尿病小鼠网膜,评价β-Mi的生物相容性、胰岛素分泌功能及对血糖水平的影响。
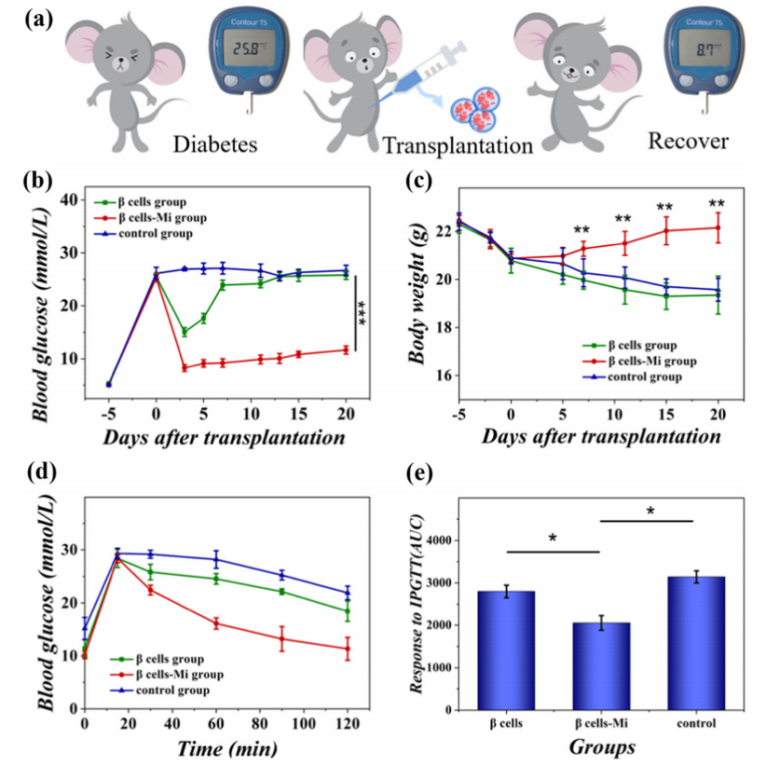
图3 多孔胰岛β细胞微胶囊(β-Mi)在糖尿病小鼠网膜移植后恢复了血糖控制。相比于对照组及单纯胰岛β细胞移植组,胰岛β细胞微胶囊(β-Mi)移植组小鼠血糖降低至正常范围,且体重逐渐升高至患病前水平,IPGTT结果显示其维持葡萄糖稳态的能力优于其他两组。
总体而言,该研究以“医工交叉融合”的理念,集成临床医学、生物医学工程和基础医学多学科优势,基于微流控系统和高压静电喷雾技术,实现胰岛细胞的3D培养,获得具有近生理结构与功能特点的胰岛细胞微载体和微胶囊,为治疗糖尿病提供新策略,引领前沿技术助推医疗模式变革浪潮,实现未来生命科学领域的关键理念性与技术性突破。
-
泪液葡萄糖传感器有望让可穿戴无创血糖监测仪成为现实2018-11-21 2354
-
使用PSoC 3进行葡萄糖测量2019-05-30 1212
-
如何校准葡萄糖浓度的电压?2019-06-24 1618
-
新型葡萄糖氧化酶电极与毛细管电泳的联用2009-06-24 593
-
微型葡萄糖微传感器的研制及其应用2009-07-11 723
-
MAX9913在三电极电化学葡萄糖仪中的应用电路2012-09-26 3730
-
葡萄糖药液质量检测的视觉成像方案研究2021-04-18 2967
-
葡萄糖含量检测仪的产品性能是怎样的2021-07-29 792
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 4443
-
一种3D打印支架集成的“三明治”结构微流控装置2022-09-26 2298
-
基于金属纳米材料的可穿戴无创葡萄糖传感器研究进展2023-05-12 2189
-
汗液葡萄糖无酶传感器用于监测汗液中葡萄糖浓度2023-06-07 2628
-
新型3D介孔生物传感膜提高葡萄糖生物传感区域面积2023-07-04 1090
-
微针葡萄糖传感器贴片 可至皮肤深层持续监测2024-06-20 2937
-
ATA-7020高压放大器在微流控3D细胞微球培养中的应用2024-10-09 925
全部0条评论

快来发表一下你的评论吧 !

