

如何实现更实用的低温锂硫电池技术
电源/新能源
描述
传统锂离子电池(LIB)在能量密度方面遇到了应用瓶颈,而新兴的锂硫(Li-S)电池在下一代可充电电池系统中显示出可实现更高能量密度的潜力,这是由于硫正极(1675 mAh g−1)和金属锂负极(3860 mAh g−1)均具备相当高的理论比容量。此外,结合轻量化、环境友好和低经济成本等优点,锂硫电池在过去十几年中已成为最有前途的电池体系之一,并得到不断发展。然而,这些研究工作主要是在室温(RT)下进行的。由于锂硫电池的电化学反应过程相对缓慢,在低温(LT)情况下所进行的相关研究仍较少。但对于实际情况来说,如电动车辆、空间/极地探索、水下作战和边境国防等场景,迫切需要能适应寒冷环境的高比能可充电电池体系。
【工作介绍】
吴飞翔教授团队前期的工作(Nano Lett. 2020, 20, 5391.)已经证明采用低浓度电解液可提高室温锂硫电池的循环容量保持率和实现高达2 C的优异倍率性能。这主要是由于低浓度电解液具有低粘度、更好的润湿性以及在常温下对多硫化物穿梭的抑制。基于此,中南大学吴飞翔课题组等人于近日采用低浓度电解液(LCEs)来提升锂硫电池在恶劣条件下的电化学性能,包括低温工况、普通硫材料和高载量正极。发现即使在低温条件下LCEs也能提供更高的容量和更高的容量保持率。更重要的是,利用低浓度电解液策略对锂硫电池在低温下的电化学和动力学行为进行了深入研究。这些发现和见解将揭示低浓度电解液在实现低温锂硫电池具备更快动力学的作用。此外,低浓度电解液这种方法可为实现更实用的低温锂硫电池提供了一种实际可行的方法。该文章发表在国际材料领域顶级期刊《先进功能材料》(Adv. Funct. Mater.)上。通讯作者为中南大学吴飞翔教授和湖南大学柳斌副教授;中南大学19级博士生褚福路为本文第一作者,湖南大学19级硕士生王萌为共同第一作者。
【内容表述】
锂硫电池主要是基于非拓扑转换化学,放电过程基本上有两个步骤(即两个不同的电压平台)。位于高电压区(从2.5到2.3 V)的第一个平台对应于硫转化反应,该反应过程会经历硫环的断裂,形成可溶于醚类电解液的长链硫组分即多硫化物(LiPSs),随后会产生难以控制的穿梭效应。另一个平台位于较低电压范围(≈2.1 V),符合从短链多硫化物到Li2S2/Li2S的转化。实际上,每个充放电循环都是一个复杂的多相电化学过程。因此,在硫氧化还原反应过程中,可实现完全转化反应的快速动力学是至关重要的。然而,现实情况中从Li2S4到Li2S的完全转化很难实现,转化反应动力学非常缓慢。再加上最终放电产物Li2S的绝缘性能,这种情况在低温工况下会加剧恶化。因此,为了成功实现锂硫电池的低温性能,加速转化反应动力学特别是在Li2S4到Li2S转化过程中的转化动力学变得非常重要。
本文采用低浓度电解液成功实现了在低温环境中(在0和−20 °C)加速锂-硫转化反应速度,尤其是从Li2S4到Li2S过程中的转化动力学,并抑制了多硫化物的穿梭效应,从而有效提升了低温锂硫电池的性能。这主要是由于低浓度电解液的低粘度、更好的润湿性,以及稳定的电极界面层进而对多硫化物穿梭有效抑制。原位EIS和CV等电化学测试手段揭示了0.1 M和1 M电解液中电极动力学的主要差异,进一步解释了两种电解液在工作机理上的差异。对循环后的电极进行的界面化学分析表明,在LCEs体系中构建了以有机物为主和一些有利无机物组分共存的混合界面层,进而展现出较小的表面层电阻。这些发现阐明了LCEs在实现低温锂硫电池提升反应动力学方面的作用,并为在极端条件下实现高性能锂硫电池提供了简单、低成本和广泛适用的途径。
1. 低温锂硫电池在低浓度电解液中的电化学性能
为了显示出低浓度电解液的最大改善效果,直接使用商业大颗粒硫粉与常规导电剂石墨烯混合得到石墨烯-硫(G–S)复合物,而无需任何功能性基体或特定催化位点。如图1所示,在0°C环境下评估使用G-S正极材料(面积硫负载量:1.0 mg cm-2)的锂硫电池的电化学性能。可以看到,使用0.1 M电解液时,电池在不同电流密度下均呈现出比常规电解液(1 M)高得多的可逆容量(图1a-c),并具有更正常的放电/充电曲线(图1d-i)。
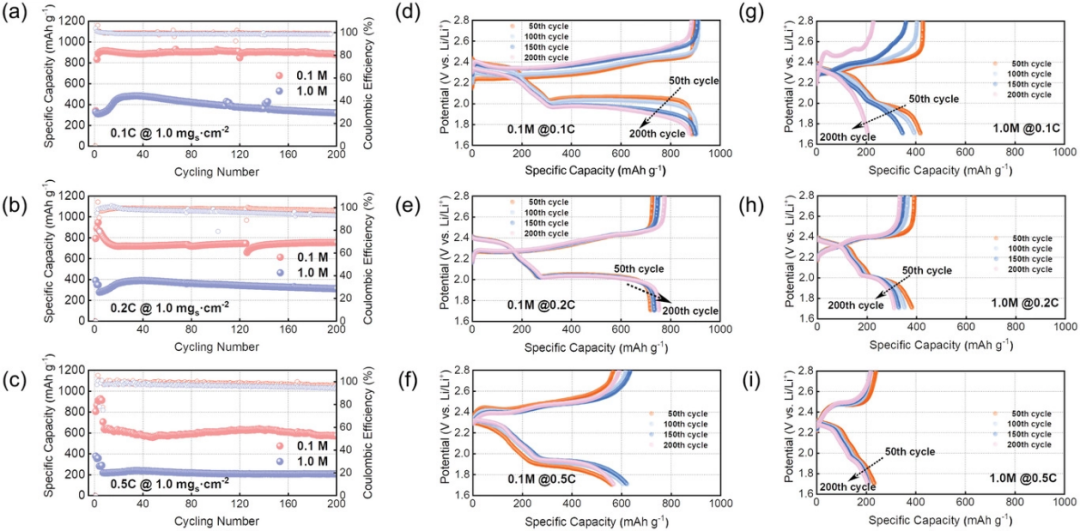
图1. 石墨烯-硫(G–S)正极在0℃条件下在0.1和1.0 M电解液中不同倍率下的电化学循环性能:a)0.1 C、b)0.2 C、C)0.5 C,以及d–i)随循环圈数变化的相应容量-电压曲线图。
同样的,在不同循环次数和不同倍率条件下的充放电曲线(图1d–i和图2a)进一步加深了对电解液浓度及其可逆容量之间联系的理解。使用LCEs的电池保持着良好的充放电曲线形状,在不同的倍率下具有明显更高的放电容量和更小的电压滞后,可为在低电压范围内的短链多硫化物到不溶性硫化物的转化反应提供了更好的动力学。而对于使用1 M电解液的电池,其总容量主要来源于第一个放电平台,而对应于短链多硫化物到固态硫化物转化的第二个放电平台似乎愈发不清晰可见(图1g-i)。即使在G–S硫正极的面载量进一步增加时,具有LCEs的电池也显示出良好的循环性能(图2a-c)。
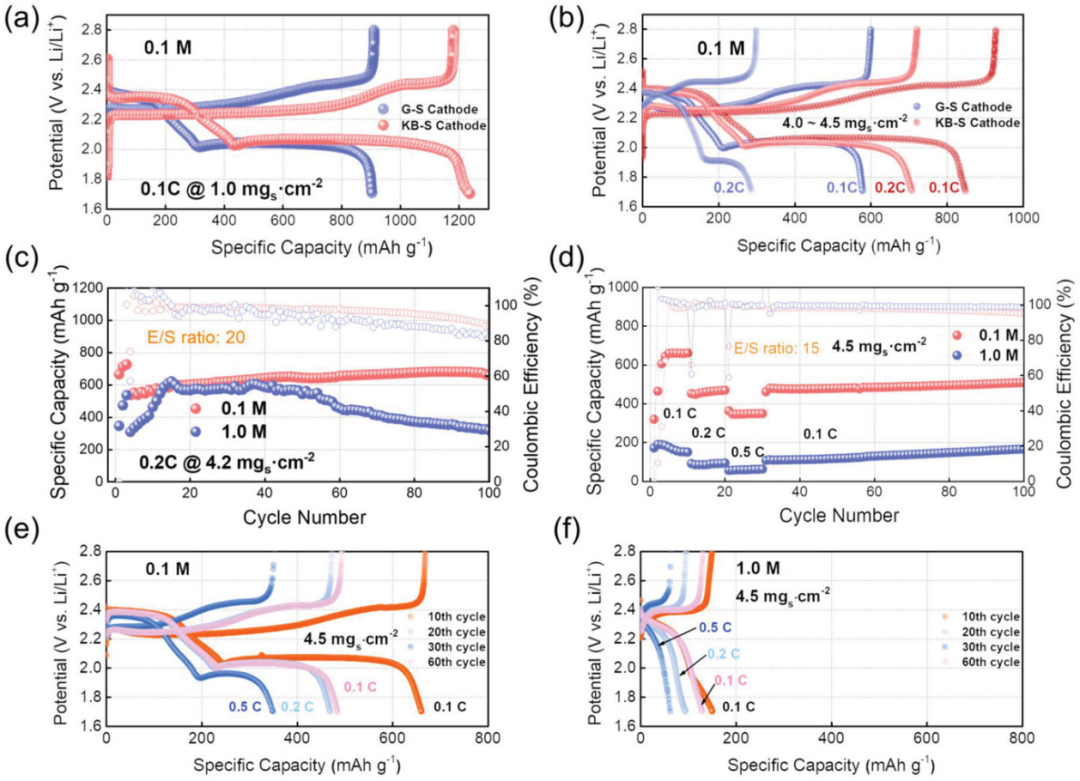
图3. 具有不同载量的石墨烯-硫(G–S)和科琴黑-硫(KB-S)正极在0°C下的电化学性能比较研究:a)1.0 mg cm-2和b)4.5 mg cm-2 使用0.1和1.0 M电解液的高载量KB-S正极的c)循环稳定性和d)倍率性能。使用e)0.1 M和f)1.0 M电解液进行倍率测试所对应的充放电曲线图。
由于商用硫块直接用于简单的G-S正极,几十微米的颗粒可能会限制硫的容量利用率。因此,为了进一步验证低浓度电解液的有效性和普遍性,又选择了通过常用的熔融-浸渍法得到的纳米级科琴黑-硫(KB-S)复合正极,来研究低温下的锂硫电池。为了详细探讨LCEs在更实际条件下的有效性,进一步研究了高载量KB–S样品(图3b-f)。特定循环下充电和放电平台之间的电压差表明,在0.1 M电解液中循环时,电压滞后增长较小。相比之下,使用标准浓度电解质(SCE)的电池最初显示出相当低的容量和较长的活化时间,且其容量很快下降到低得多的容量以及库伦效率(CE)的波动远大于LCE(图3c)。这应该是由于溶解的多硫化物的更严重穿梭行为和低导电含硫物质的进一步沉积而导致的活性电极失活,使用高负载正极会加剧这种情况。当进一步降低电解液的用量(E/S=15 µL mg–1)时,0.1 M体系在不同的倍率下提供了与1.0 M相比具有竞争力的容量(图3d)和良好的重复性。图3e,f中的相应电压曲线显示,1.0 M电解液中锂-硫转化反应行为不完全,表明该电池中的反应动力学相当差。
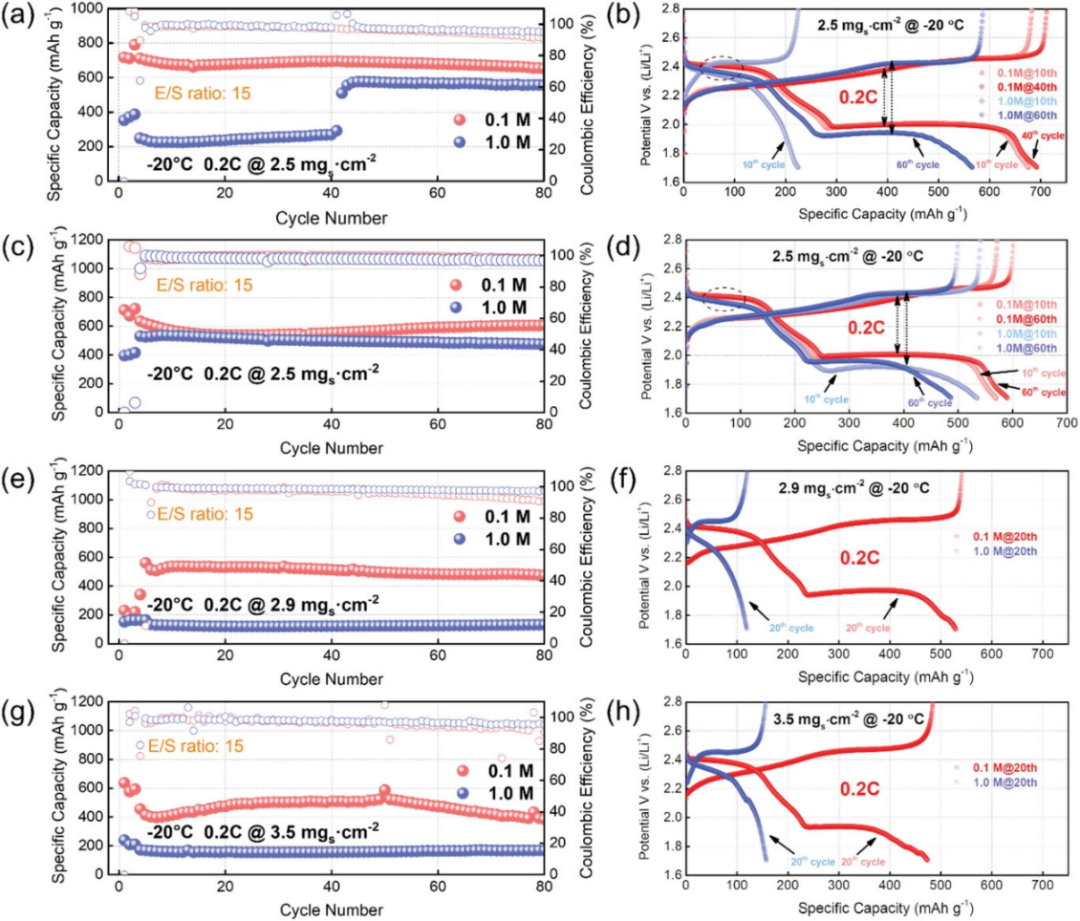
图4. 在-20℃条件下,不同载量KB–S正极在0.2 C下使用0.1和1.0 M电解液的循环性能及其相应的电压曲线图:在2.5mg cm–2载量条件下,a,c)循环性能和b,d)相应的电压曲线图的平行测试。
在面向实际应用的更苛刻的条件下即−20℃,对低温锂硫电池使用0.1 M电解液的可行性进行了详细评估。图4显示了使用两种电解液的电池在−20℃下的循环性能和相应的电压曲线。在这样的低温下,电池中的硫氧化还原反应速率不可避免地变得非常慢。S8转化为长链多硫化物的转化反应或许可能实现,但从Li2S4直接转化为固体Li2S2或甚至Li2S将变得相当困难。如图4a所示,使用SCE的KB-S正极无法在0.2 C下完成固相转化,提供了非常低的初始容量。再加上1 M电解液的润湿性较差,典型的电压曲线显示几乎消失的第二电压平台,进一步证实了在该低温下硫氧化还原反应动力学的严重恶化(图4b,第10个循环)。而对于在0.2 C下使用LCE的电池,它释放出711 mAh g-1的高放电容量,提供清晰的具有较小极化的第二电压平台(图4a,b)。当继续将硫载量增加,LCE仍然可以保持其竞争优势(图4e,f)。采用稀溶液的电池在0和−20°C下,均可实现短链多硫化物向固体硫化物的过渡,并具有更好的一致性,而常规电解质中的电化学性能均匀性较差。这可以得出结论,在低温下使用SCE的内部动力学是不稳定和变化的,并且通常需要长时间的活化,以维持较高载量和贫电解质条件下的硫利用率,甚至活化失败(图4e-h)。
为了研究使用不同电解液电池的详细电化学行为,在低温环境(0和−20℃)中进行了循环伏安法(CV)测量以探测LCEs的积极影响。伏安曲线分别如图5所示,显示了低浓度溶液对硫化学反应动力学的明显影响。具有低浓度电解液的电池在0℃下显示出两个显著的峰值(图5a),这可归因于固体硫还原为长链多硫化物,并进一步得到最终放电产物,如Li2S2/Li2S。对于反向扫描中的氧化峰,它们归因于最终放电产物(Li2S)向中间产物(LiPSs)的可逆转化,然后转化为活性硫。相比之下,具有常规电解液的电池具有较大的极化和较小的峰面积。从第二个循环开始,氧化还原峰的位置和面积略有变化,表明反应可逆性和循环稳定性良好(与常规体系相比,峰面积更大,曲线重叠,极化更小)。注意,首圈还原反应的明显位置变化应归因于初始循环中的电池活化。
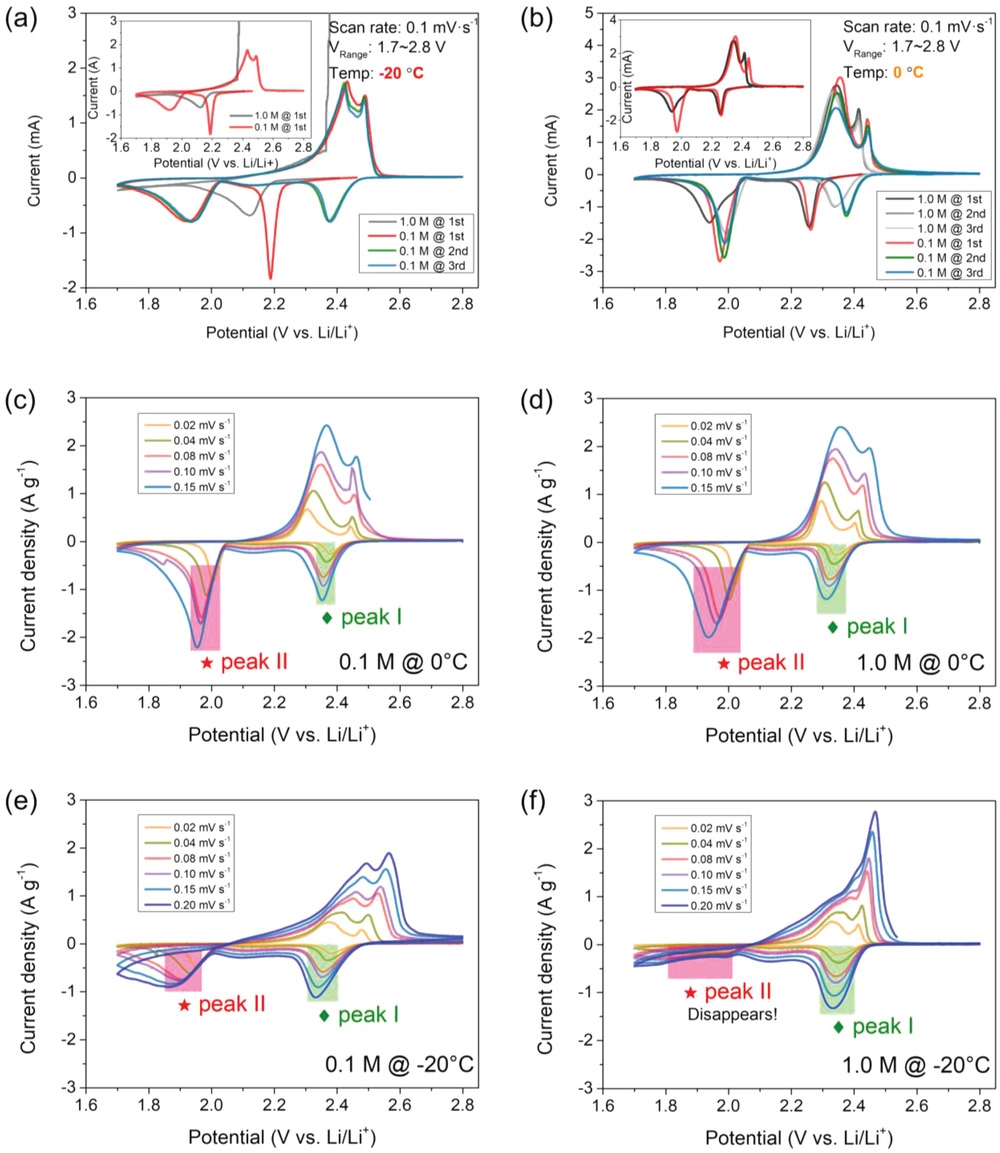
图5. 使用不同电解液的低温Li–S电池的循环伏安曲线:在0.1 mV S-1下使用0.1和1.0 M电解液在a)0和b)−20 ℃环境进行重复循环伏安扫描;使用不同电解液的低温锂硫电池在不同扫描速率下的循环伏安曲线(ν=0.02、0.04、0.08、0.10和0.20 mV S−1),c)0℃下0.1 M,d)0 ℃下1.0 M,e)-20 ℃下0.1 M和f)-20 ℃下1.0 M。
在−20℃时,这些电池的电化学行为差异更为明显。如图5b所示,1 M电池经历了有限的硫氧化还原反应,在初始扫描期间,仅在2.12V下显示了单个还原峰,峰面积较小,第二还原行为(低于2.0V)几乎消失。因此,由于不存在多硫化物被还原为最终产物Li2S的行为,锂化动力学受到极大限制。此外,1 M电池在正扫期间经历了大量极化的过充电行为(图5b插图),这是由于LiPSs的不可控穿梭损耗造成的。但LCE电池在图5b中表现出完全不同的电化学行为。在第一个循环中,可以在2.19和1.928V处发现明显的还原峰。此外,在2.433和2.49V下,两个氧化峰也清晰可见。在随后的循环中,即使在−20℃电池的阳极和阴极峰很好地重叠,表明在硫转化反应期间优越的循环稳定性和更好的可逆性。
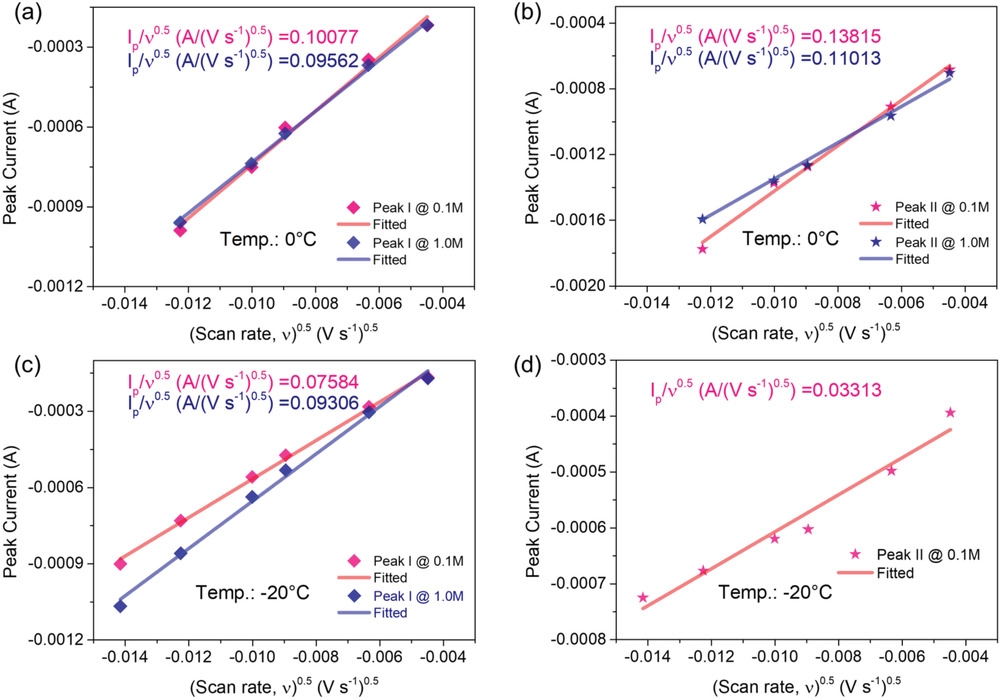
图6. CV曲线的各种峰值电流与扫描速率平方根的关系图,以及从Randles–Sevcik分析获得的线性关系拟合。a)0 ℃下的峰值I,b)0 ℃下的峰值II,C)−20 ℃下的峰值I和d)−20 ℃下的峰值II。
此外,在硫氧化还原反应期间,锂离子Li+在电解液和电极之间界面上的扩散动力学通过一系列CV曲线进行评估(图5和6)。图5c-f中的这些结果表明,在相对较低的扫描速度下,硫转化具有良好的氧化还原反应行为。另一个令人印象深刻的方面是,在−20℃(图5f)使用1 M电解液的电池其第二还原峰消失,强烈表明当使用LCE时,多硫化物的转化动力学在低温下得到加速。如图6所示,峰值电流(ip)与扫描速率的平方根(η1/2)呈良好的线性关系,LCE比常规LCE更陡,这意味着使用稀溶液的电池具有更好的动力学。然后,根据Randles–Sevcik方程计算放电过程各阶段的锂离子扩散系数(DLi+)。对于具有LCE的系统,在低温条件下,DLi+值显著优于对照组(1.0 M电解液),例如LCE的扩散系数(峰值I在−20℃)为≈7.1×10–7 cm2 s−1明显高于常规体系(≈1.4×10–9 cm2 s−1). 总之,这些结果令人信服地证明了低浓度电解液在促进反应动力学和规范电极表面界面行为方面的重要性。
2. 低浓度电解液的物化属性
低浓度(0.1 M)体系提供了非常低的粘度以释放高的锂离子迁移率。0.1 M电解液在25, 0, −20 ℃分别显示出1.83、1.816和1.63 mS cm-1(图7a),而1.0 M电解液中对应数值为12.14、11.09和8.52 mS cm−1。尽管环境温度不同,LCE的离子电导率几乎不变,可以满足锂硫电池的正常工作。值得注意的是,在一定电流密度范围内,活性离子(Li+)的相间溶剂化/脱溶剂化和随后的迁移远比离子电导率的值重要。因此,稀释液中足够的离子电导率可以满足各种硫正极在寒冷环境中的高性能,如先前数据所示。此外,使用接触角计评估它们对硫正极的润湿性。各种硫正极的静态接触角如图7b所示。对于G–S正极,LCE中的接触角(CA)仅为13.5°,而SCE样本显示为21.3°。对于KB–S正极,与使用1.0 M电解液时的接触角(25.4°)相比,LCE的接触角也较小,为11.9°,表明低浓度溶液的高润湿性。因此,正极上良好的润湿性和低浓度的适当离子导电性可以加速电极反应过程,从而即使在高倍率下也能提供更高的容量保持率和更低的过电位(图1-4)。
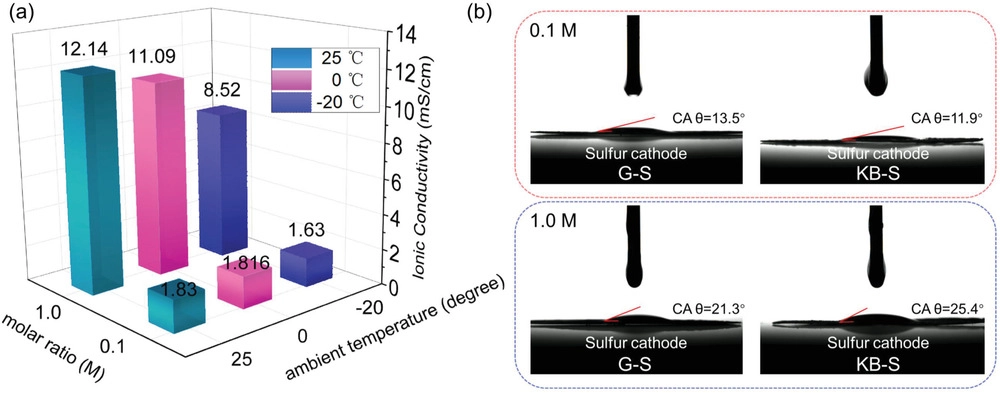
图7. 0.1和1 M电解液的物理性质:a)不同温度下的离子电导率;b) 通过接触角测量在硫正极上的相应润湿性。
3. 低温锂硫电池中循环后电极的形貌演化

图8. 在0℃下运行的锂硫电池中循环电极的形态特征:在a、b)0.1 M和C、d)1.0 M电解液中循环500次后,G-S正极的表面SEM图像;在e,f)0.1 M和g,h)1.0 M电解液中循环500次后锂金属负极的SEM图像。(d)中的黄色虚线圆圈表示多硫化物的不均匀穿梭沉积。
使用扫描电子显微镜(SEM)来观测循环后电极上的表面形貌变化。如图8a,b所示,在0.1 M电解液中循环的正极其纳米结构完整性可以很好地保持,同时有最小的裂纹和较少颗粒粉碎。平坦表面形貌表明多硫化物沉积更均匀,多硫化物在0.1 M电解液中的扩散可控。由于短链多硫化物(Li2S2)倾向于在0.1 M电解液中聚集(较难溶解),长链多硫化物和Li2S2之间的化学结合可以成功地抑制多硫化物的穿梭效应。相反,常规体系循环正极的表面显示出更多的孔、裂纹和锂多硫化物的不均匀穿梭沉积(图8d中的黄点圆圈),表明在低温下,1 M电解液中存在严重的多硫化物穿梭效应、不良的反应动力学和有限的固-固转化。可溶性多硫化物很难转化为固体硫化物,导致更粘稠的电解质和这种可溶性多硫化物不受控制的扩散。因此,循环正极的形貌变得越来越粗糙,有更多的孔和裂纹(图8c,d)。在1.0 M电解液中循环的锂负极显示出相同的特征,证明了可溶性多硫化物对原始锂金属的严重侵蚀。随着锂负极上的钝化表面和任意位置的体积变化,循环锂片出现更粗糙的区域,具有垂直的锂枝晶,并形成金属锂基体的表面粉化(图8g,h),表明循环期间锂沉积不均匀。有趣的是,0.1 M电解液中的循环锂负极(图8e,f)显示出均匀且高度均匀的表面,其中包含有序排列且表面形貌光滑的大锂金属颗粒。更重要的是,没有任何可见的硫化物沉淀和有害的锂细丝(即锂枝晶)。这意味着在低温下,0.1 M电解液成功地抑制了多硫化物穿梭效应和电解液/锂负极界面问题。
4. 低温锂硫电池中低浓度电解质实现快速动力学的机理
复杂的硫氧化还原反应动力学可以从表观电化学阻抗中得到根本反映。具有SCE和LCE的电池均在低温环境(0℃)中进行循环,然后在不同的放电或充电深度下进行原位电化学阻抗谱(EIS)测试(见图9)。通常,EIS曲线主要包括从高频扰动信号到低频的三个部分。即内阻(Rs)、界面阻抗(Ri,存在于高频至中频区域的半圆)和扩散阻抗(Warburg阻抗)。其中,界面阻抗是本研究的主要焦点,涉及固体电解质界面(SEI)层(RSEI)的电阻和电荷转移电阻(Rct)。如图9所示,在锂硫电池的初始状态下,界面阻抗通常显示为单个融合半圆,表明常规系统中Rs和Ri的电阻较小,这是由于1.0 M电解液的较高离子电导率所致。随着放电过程从开路电位(OCP)变为2.05 V,硫正极经历固-液相转化的第一个电压平台,以释放具有更高粘度的可溶性长链多硫化物中间体(Li2Sn,4≤n≤8)。这些中间体将遇到电极来形成界面层,从而引起穿过电极/电解液界面的相应电荷转移过程。因此,在高频到中频范围内出现了两个半圆。由于长链多硫化物的形成是通过固液相反应进行的,因此界面传质过程将得到改善。这是在2.25 V的第一次放电中两种电解液体系的阻抗明显降低的主要原因。此外,可溶性长链多硫化物的形成将不可避免地增加电解液的体相粘度。正如先前的研究表明,LCE(0.1 M)提供了极小的粘度,这有助于高锂离子迁移率。因此,0.1 M电解液中溶液粘度的增长也相对较小。对于LCE,作为预期结果,其在第一次放电平台期间的电荷转移阻抗则要更小。
在放电范围≈2.05–1.7 V内,更多的多硫化物将参与表面构筑。加上电极上更好的润湿能力,低浓度体系中的SEI层电阻(RSEI)将逐渐降低并稳定。在该范围内,放电对应于短链多硫化物的还原过程,即从液体LiPSs中间体形成固体Li2S2/ Li2S。在2.05–1.7 V范围内的主要差异是,稀释溶液中的电荷转移阻抗(Rct)远大于标准溶液中的阻抗。这种有趣的现象也出现在充电电压范围≈1.7–2.3 V。根据我们之前的发现,添加LiTFSI盐可以增强Li2S2的溶解,这意味着1 M具有更强的溶解Li2S2能力。然后,1 M电解液中的可溶性Li2S2降低了电池在固-固范围内的Rct。更重要的是,在该固-固反应范围内(≈ 2.05–1.7和1.7–2.3 V),Li2S2在0.1 M电解液中的聚集将与电解质中的长链多硫化物化学键合,以减少穿梭效应,部分导致0.1 M电解液中更好的循环稳定性(图1-3)。
在≈2.3–2.8 V的充电范围内时,由于长链多硫化物的形成,两种电解液中电池的Rct都大大降低。就图9所示的第二个循环而言,总体而言,两个电池显示出与第一个循环相同的界面阻抗变化行为。它们的总值略有降低,这可能是由表面层的电化学活化和稳定重建所导致的。一个区别是使用0.1 M电解液的电池其整体界面阻抗降低得更明显。另一个区别是,除2.05–1.7和1.7–2.3 V范围外,在0.1 M电解液中大多数电压范围内的电荷转移电阻(Rct)要小。
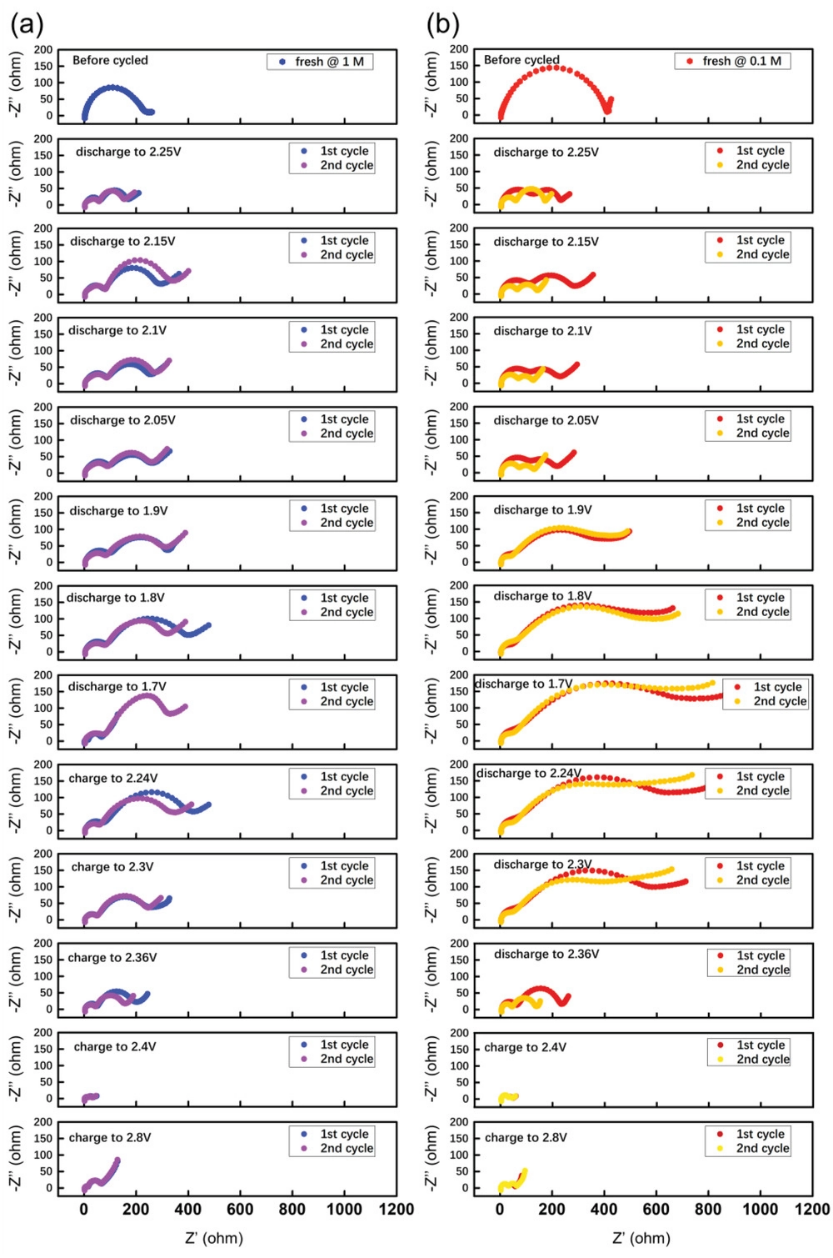
图9. 在a)1.0 M和b)0.1 M电解液中,在0℃下,锂硫电池在不同放电和充电状态下的原位EIS测量。
于1 M电解液体系,这是由于低浓度电解液的以下影响:i)更好的润湿性能,ii)可溶性多硫化物的粘度较低,iii)可能存在弱溶剂化效应,导致反应能垒较低,以适应快速电荷转移过程。由于盐浓度的巨大差异,预计两种电解质体系的溶剂化结构不同。与1 M液体相比,低浓度溶液显示出更少的Li+-阴离子相互作用组分,但更多的Li+-溶剂配位络合物。由于不同离子络合物的结合能明显不同,这些溶剂化合物的去溶剂化难度不同。因此,在低浓度电解质中具有较弱结合能的高比例Li+-溶剂组分导致Li+离子去溶剂化更容易并进一步迁移穿过电极。因此,在低温锂硫电池中,由此产生的更快的动力学可以加速更快的电荷转移过程,并实现更出色的倍率性能。这些结果与电化学性能一致,表明低浓度电解液能够在极低温度条件下实现不受阻碍的转化反应动力学,并抑制锂硫电池中多硫化物的穿梭,从而在各种倍率下实现相对较高的容量利用率和更好的循环稳定性。
5. 电解液/电极界面处的界面化学行为
由于锂硫电池的快速动力学和优异的倍率能力也极其依赖于稳定的界面层,因此采用X射线光电子能谱(XPS)技术进行了表面成分分析和探究相关的化学键合情况。详细总结了LCE(图10a–c,g–i)和SCE(图10 d–f,j–l)中形成的电极界面(SEI和正极电解质界面,CEI)的光谱情况,可发现锂金属负极和硫正极两个样品的XPS光谱(特别是C 1s、F 1s和S 2p光谱)存在明显的差异。
在负极侧,0.1 M电解液体系的C 1s光谱结果(图10a)显示了一个明显的峰应归因于C-C组分以及几乎不可见的C-F峰。对于其他C 1s峰,可以分别对应于Li2CO3和C-O。但明显的C-OR(R为烷基)峰在常规体系中显现出来,而其他碳峰是正常强度(图10d)。这些碳基组分的强度越强,表明各个SEI层的组成差异越大,特别是在LCE体系中以C-C和-CO3有机组分为主的外部SEI层。这一趋势可以广泛验证,即SEI层由无机和有机组分组成,外层提供更多的有机组分,如-COOR,-CxHyOz,and-CO3。更特别的是,对于低浓度的情况,盐与溶剂的低摩尔比易于诱导有机占主导地位的界面层,因为大量溶剂会优先得到还原。C-F峰证明了稀释电解液中副反应(消耗锂盐)的减少,因为相关官能团-CF3最有可能来自LiTFSI盐中阴离子的分解。这一现象也可以在F 1s光谱中显示,其中一个极弱的峰即C-F出现在0.1 M电解液中(图10b)。
仅就峰值强度而言,低浓度体系中F和S元素的光谱强度略低,这也是因为它们的盐与溶剂的摩尔比低。但是在每一表面层中所得物种之间的比例相当不同。由LCE得到的表面层中LiF的高含量应源自LiTFSI分解。根据之前的研究,在低浓度的情况下,LiTFSI大部分被解离,这可能有助于产生更多的还原产物。LiF作为SEI层中众所周知且几乎无处不在的成分,由于高杨氏模量和低扩散能垒,可以提供更好的SEI层,以实现稳定性和快速离子扩散。因此,使用LCE可以获得具有良好平整度的坚固SEI层(通过SEM证明),从而提高倍率能力。而对于其余组分,在低浓度存在下,诱导LiCF3和Li2NSO2CF3的副反应被抑制。因此,在LCE体系的初始循环期间,LiTFSI主要分解为LiF,并进一步伴随着不良反应的减少(低占比的C-F组分)作为已经稳定的界面。此外,由于硫氧化还原的快速动力学和完全放电过程,在0.1 M电解液中可以看到更多的硫基物质(图10c)。Li2Sx的存在表明Li金属与可溶性多硫化物之间发生化学反应。LCE中多硫化物的受控穿梭效应将导致锂金属负极的有限腐蚀(更少的Li2Sx组分)。从包括Li、N和O元素的其他光谱(图S9,支持信息),可以发现类似情况。大量研究表明,氮化界面可以促进锂离子的快速扩散,LiNxOy和锂多硫化物的协同效应可以调节表面形貌和均匀的锂离子通量分布。因此,低浓度电解质可以形成具有更多有机成分且不缺乏坚固无机物的混合SEI层。这种稳定的界面层可以将锂金属负极与电解液隔离,并确保快速离子扩散(更好的倍率性能)和更均匀的表面。
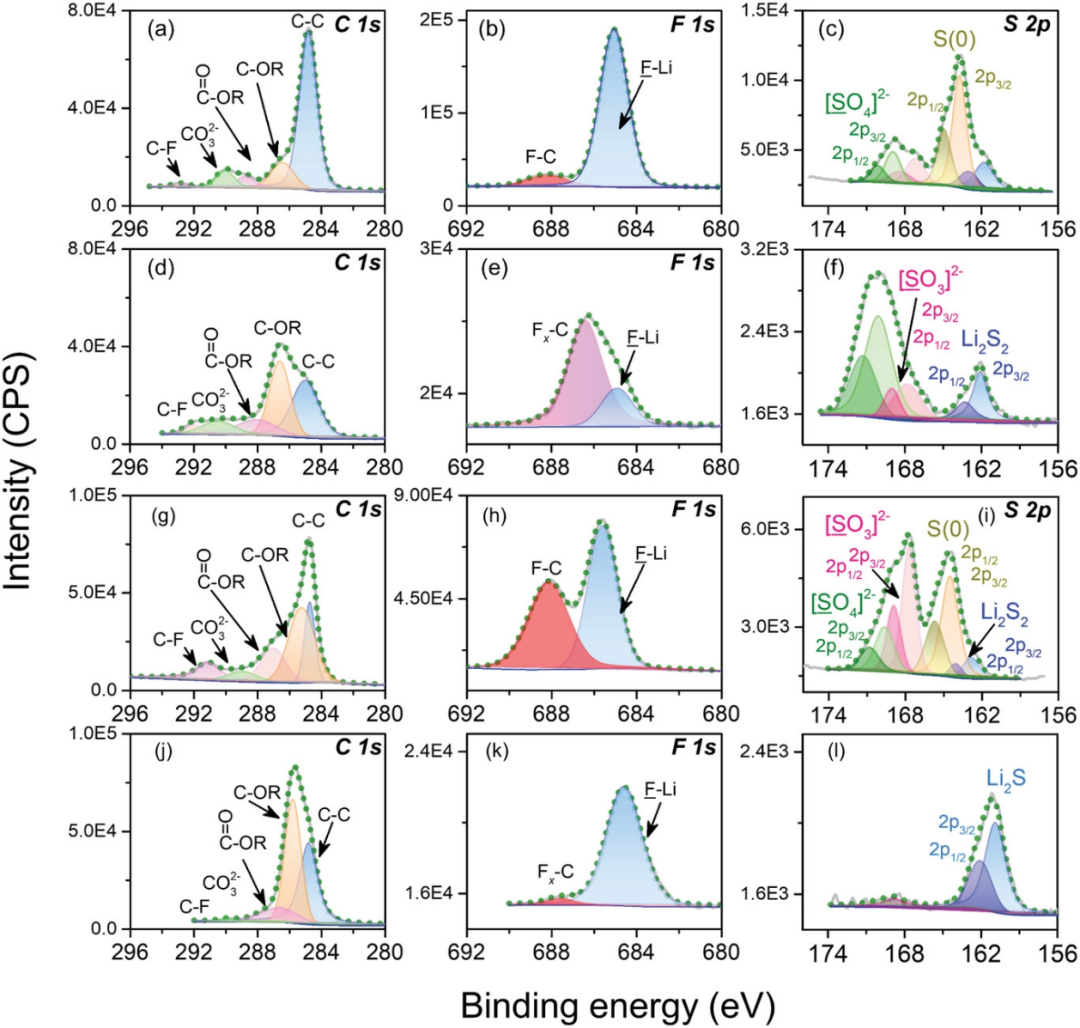
图10. 两种电解质中形成的SEI和CEI层的界面表征。500次循环后,a–c)循环负极和g–i)正极与0.1 M电解液的C 1s、F 1s和S 2p的XPS光谱;500次循环后,d–F)循环负极和j–l)正极的C 1s、F 1s和S 2p的XPS光谱,以及1.0 M电解液。
对于正极侧,在两种电解液中循环的电极上其表面膜呈现出更具弹性的碳酸烷基酯和聚二氧戊环(polyDOL)的多孔低聚物,如图10g,j所示。LCE中的LiF比例要多于标准体系中的LiF,且有相对较高的C-F组分(图10h,k)。这可能源于具有更多活性位点的硫正极,这是由于0.1 M电解液具有更好的润湿性能。表面层中硫的形式在S 2p光谱中确定(图10i,l)。首先,含S物种的信号在SCE中似乎较弱。通过硫物种峰值强度的比较,可以合理推测在SCE中正极上较厚的层,因为含碳化合物较多的较厚层会阻碍硫化合物的检测信号。通过溶剂分解的有机成分越多(如C-OR,图10j)将覆盖电极表面并使原始平滑度变粗糙。更致命的是,在S 2p中几乎完全存在绝缘硫化物(Li2S,S 2p1/2为160.8 eV)(图10l)会钝化硫电极的活性表面,导致容量衰减。相反,LCE中形成的表面层由更多的硫基无机物种组成,如Li2SOx、C/S-S、Li2Sx,它们来自多硫化物的还原(图10i中的Li2Sx)和完全充电后的氧化产物(图10i),构成稳定的界面层。因此,低浓度电解液中形成的CEI也是一个混合层,含有更多有机物和一些无机物质,如LiF、Li2Sx和Li3N(图S10a-c,支持信息),如我们前面所分析的。该混合层可以通过更柔性的界面层更好地适应硫转化反应的体积变化。此外,在这些无机组分的晶界处可以提供更快速的离子通道。在1 M电解液中,醇基锂(ROLi)含量明显较高(图S10d-f,支持信息)。据报道,它是醚类电解液的主要分解产物。基于上述XPS结果,这可能是解释0.1 M电解液中更好低温性能的更合理机制。
【结论】
总之,通过使用低浓度电解液,在低温环境中实现了具有快速硫转化动力学、稳定循环和界面化学优化的高性能锂硫电池。详细的实验结果表明,低浓度电解液可以实现快速的转化反应动力学,特别是对于简单碳基硫正极中具有挑战性的固-固反应过程。尽管是基于采用商业大块硫颗粒(G–S)的正极,使用0.1 M电解液的电池仍旧可以实现900(0.1 C)、750(0.2 C)和600(0.5 C)mAh g–1的放电比容量,与常规1 M电解液相比,并显示出更小的电压滞后和更长的第二放电平台。对界面化学的进一步分析证明,通过自建的低浓度效应,在负极和正极上都存在具有多种成分的更佳保护层。原位电化学阻抗测试进一步证明,在循环过程中,0.1 M电解液中的SEI层电阻和电荷转移电阻较小,并且短链多硫化物(Li2S2)在0.1 M电解液中的溶解度较小,实现多硫化物的穿梭受到抑制。因此,尽管在低温环境下运行,锂硫电池仍具有更长的循环耐久性和更好的可逆容量。即使在更低的温度下(−20℃),在0.2 C下仍可实现600 mAh g–1的高比容量,并保持稳定的容量保持率。考虑到这些积极影响和利用低浓度电解液可有效降低应用成本,这项工作有助于实现在低温条件下更实用的具有优异性能的锂硫电池。此外,低浓度电解液可以同时实现高载量硫正极和低电解液体积。因此,确定低浓度电解液中的合理成分尤其重要,这可以确保电池性能和电解液成本得到更好协调。未来的策略,如选择功能性添加剂和采用优化的共溶剂等,也是很好的方法。
Chu, F., Wang, M., Liu, J., Guan, Z., Yu, H., Liu, B., Wu, F., Low Concentration Electrolyte Enabling Cryogenic Lithium–Sulfur Batteries. Adv. Funct. Mater. 2022, 2205393.
https://doi.org/10.1002/adfm.202205393
作者简介
吴飞翔,教授,博士生导师, 国家海外高层次人才(青年),德国洪堡学者,湖南省杰青,顶尖期刊Materials Today(影响因子26.94)副主编 。中南大学冶金工程学士,中南大学和美国佐治亚理工学院(Georgia Institute of Technology)联合培养博士。美国佐治亚理工学院(Georgia Institute of Technology)Gleb Yushin教授研究组博士后研究员,德国马普固体研究所(Max Planck Institute for Solid State Research) Joachim Maier 教授研究组研究员。目前主持海外高层次人才计划项目、国家自然科学基金青年项目、国家自然科学基金面上项目、德国洪堡基金项目、湖南省杰出青年基金、湖南省重点研发计划、中南大学特聘教授计划、中南大学创新驱动等项目。长期开展材料化冶金、高比能二次电池关键材料设计与材料界面科学等研究,以第一作者/通讯作者在Advanced Materials, Nano Letters, Energy & Environmental Science , Chemical Society Reviews, Joule, Advanced Functional Materials, Advanced Energy Materials, ACS Nano, Materials Today, Nano Energy等国际顶级期刊上发表学术论文近五十篇。授权中国发明专利7项和国际发明专利2项。
柳斌,湖南大学土木学院副教授,博士生导师,岳麓学者,以第一作者/通讯作者在Advanced Functional Materials,ES&T,Water Researh等杂志发表论文30余篇。
褚福路,山东济宁人,2015年获得湘潭大学材料科学与工程学士学位,2018年获得湘潭大学材料科学与工程硕士学位,硕士期间主要是在中国科学院上海硅酸盐研究所进行联合培养(导师 李驰麟研究员),2019年进入中南大学冶金与环境学院攻读博士学位(新能源材料与器件专业),主要研究方向为高性能锂金属负极构筑与电解液体系优化。作为第一作者或共同一作在Adv. Funct. Mater.,ACS Nano, ACS Appl. Mater. Interfaces, J. Energy Chem. 等国际顶级期刊上发表6篇Q1 SCI论文,总计参与并发表了包括Materials Today, Nano Letter, InfoMat在内的15篇SCI期刊论文。
王萌,河南南阳人,2019年毕业于郑州大学,2022年获湖南大学硕士学位(导师为柳斌副教授),硕士期间主要在中南大学冶金与环境学院吴飞翔教授课题组进行联合培养,研究方向为低浓度电解液用于高低温锂硫电池。作为共同一作分别在Advanced Functional Materials和Energy&Environmental Materials期刊上各发表一篇SCI论文。
编辑:黄飞
-
新能源汽车电源之锂硫电池利与弊2018-07-13 0
-
锂空气电池未来或击败锂离子电池2018-10-09 0
-
新能源汽车电源之锂硫电池利弊谈2010-11-15 1066
-
石墨烯柔性锂硫电池电极材料取得进展2016-11-28 2200
-
锂硫电池的工作原理2017-12-14 43679
-
锂硫电池属于锂离子电池吗_锂离子电池和锂硫电池有什么区别2017-12-14 16929
-
我国锂硫电池技术研发又获新进展2018-09-17 5902
-
锂硫电池优缺点_锂硫电池电极材料2019-08-23 21148
-
锂硫电池充放电原理_锂硫电池的应用2019-08-23 11496
-
我国锂硫电池技术获新突破2019-09-05 1888
-
原位散射技术捕捉锂硫电池放电产物2022-11-25 1034
-
弱化Li+脱溶剂化能垒实现高能低温锂硫电池2023-02-03 1270
-
V2C MXene组件促进实用锂硫电池的硫释放动力学和锂离子筛分2023-04-01 1613
-
双洎3.6v 一次锂电池(锂亚硫酰氯电池,锂硫酰氯电池)的用途?2022-05-31 1978
-
关于锂硫电池最新研究成果分享2023-12-01 1038
全部0条评论

快来发表一下你的评论吧 !

