

立体声流技术在微纳米尺寸生化颗粒物操控中的应用
描述
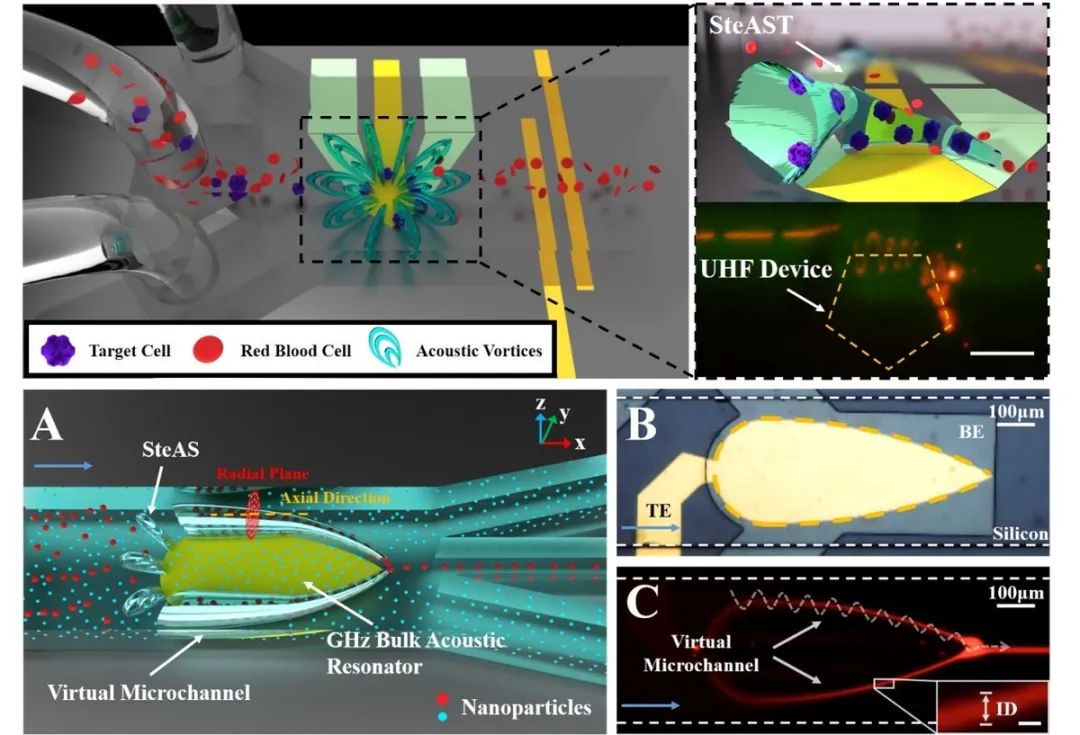
近日,他开发出一种全新的声流控技术——立体声流技术(Stereo acoustic streaming,SteAS)。该技术可实现对低至30nm的聚苯乙烯微球片上富集和低至150nm的微球连续式聚焦和筛分,并已被用于患者血液中循环肿瘤细胞及外泌体的筛分纯化。
据介绍,立体声流技术兼具声波操控和流体动力学操控的优势,具有灵活、高效、温和等特征,很适合作为一种通用的操控技术,以用于小体积生化样品的预处理和检测。
在相关论文里,杨洋针对微米尺寸和纳米尺寸生化颗粒物操控的不同需求开发了两套立体声流平台,分别为立体声流隧道(stereo acoustic streaming tunnel,SteAST)和自适应虚拟微通道(self-adaptive virtual microchannel),并展示了该技术在单细胞多模式操控和外泌体筛分中的潜力。
值得强调的是,该技术应用潜力并不限于生物样品,任何采用离心机分离纯化的场景,都能采用该技术进行替代,材料包括但不限于金、银、聚苯乙烯、二氧化硅、乳胶等。目前来看,床旁检测(Point-of-care diagnostics)和液体活检(Liquid biopsy)仍是微流控技术的各种潜在应用中最有机会落地的场景。然而对小体积复杂生化样品的预处理技术的发展是滞后于片上检测技术的。
近年来,片上库尔特计数器、数字PCR、拉曼、三代测序等技术的出现提供了不同维度的检测方案,精度可达单碱基水平,但是往往需要大型设备来完成样品的预处理。尤其是针对百纳米的生物颗粒物,超速离心几乎是唯一的方案,但是昂贵的价格、耗时的操作和高的损失率限制了超离的普及。
通过对立体声流技术进行多级整合,可对小体积纳米颗粒进行即时的片上多级分离、富集和检测,缩短目前微流控技术和片上实验室(Lab on a chip)目标之间的距离。
用立体声流技术,将操控极限尺寸提高至30nm
据介绍,纳米颗粒物是近年来备受关注的研究目标之一,其作为药物载体、表面涂层或敏感单元,被广泛用于生物医学、化学、材料和光电子等领域。按性质软硬来区分,纳米颗粒物可被分为:以有机无机材料组成的“硬”颗粒、以及各种生物纳米颗粒为主的“软”颗粒。
纳米级的尺寸,让这些颗粒物具备不同的性质和功能。例如,不同尺寸的金纳米颗粒载体有不同的代谢周期,可以通过控制其尺寸,用于调控药物在体内的循环时间。其中,外泌体作为尺寸在30-150nm的一类外泌囊泡,被认为在细胞通讯中起到重要作用,并且是多种疾病的潜在标志物。
尽管这些纳米颗粒物具备研究价值和应用价值。但是,昂贵复杂的纯化富集技术比如超速离心、密度梯度离心、排阻色谱等,带来了极高的硬件门槛,这让研究规模和应用推广遭受限制。尤其是面对生物纳米颗粒物时,其脆弱的膜结构、同类样品间的巨大差异和复杂的成分,对纯化技术的生物兼容性、操控能力和稳定性提出了极高的要求。
声流控技术是一种理想的解决方案,该技术通过结合声镊技术和微流控技术,在微尺度的流道中引入声波,来实现对颗粒物和流体的驱动。在技术原理上其类似于光镊技术,即用声代替光去“抓”“移动”和“推”目标。相比于光,声在可集成性、驱动效率和生物兼容性上有明显优势。
同时,相比于复杂的光路和昂贵的光源,声波器件往往只需电学激励即可驱动。并且得益于与集成电路相兼容的加工工艺,其大规模加工难度较低,封装尺寸往往能做到毫米甚至微米水平。
研究中,该团队采用的固体状配型薄膜体声波谐振器的尺寸处于百微米水平,非常适合与微流控技术集成。在驱动效率上,声波的波速远低于光波,这使得同样的功率下能引发的声波辐射力远高于光辐射力。
此外,在生物兼容性上,声波作为一种非接触的操控手段,其作用力本身是均匀温和的,已在单细胞操控领域应用多年,并已作为聚焦技术被用于商品化流式细胞仪当中。但是,面对生命科学中复杂的操控需求和纳米尺寸的颗粒物,经典的声流控技术无法实现多模式操控和纳米级操控能力。
(来源:资料图)
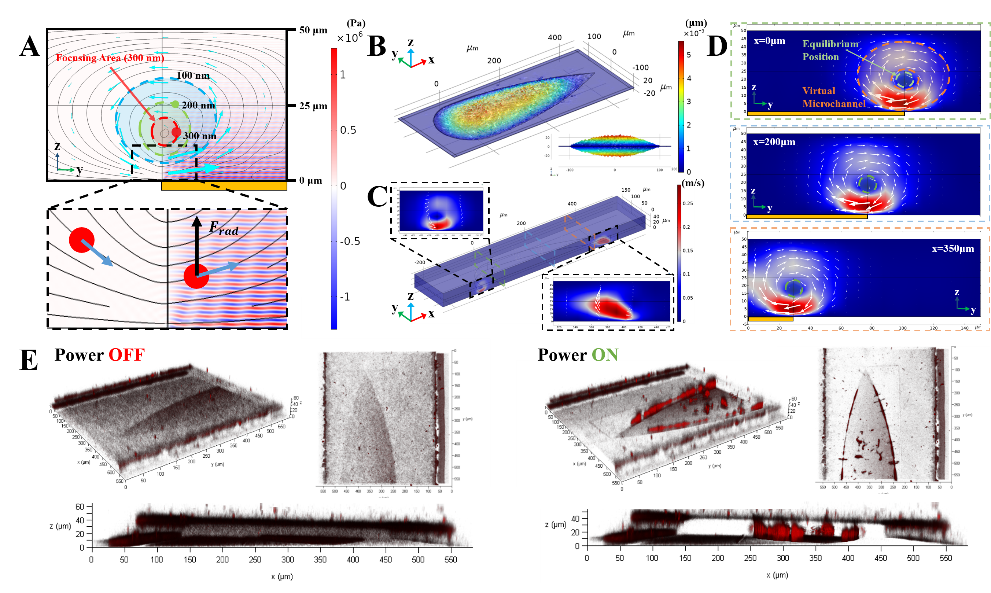
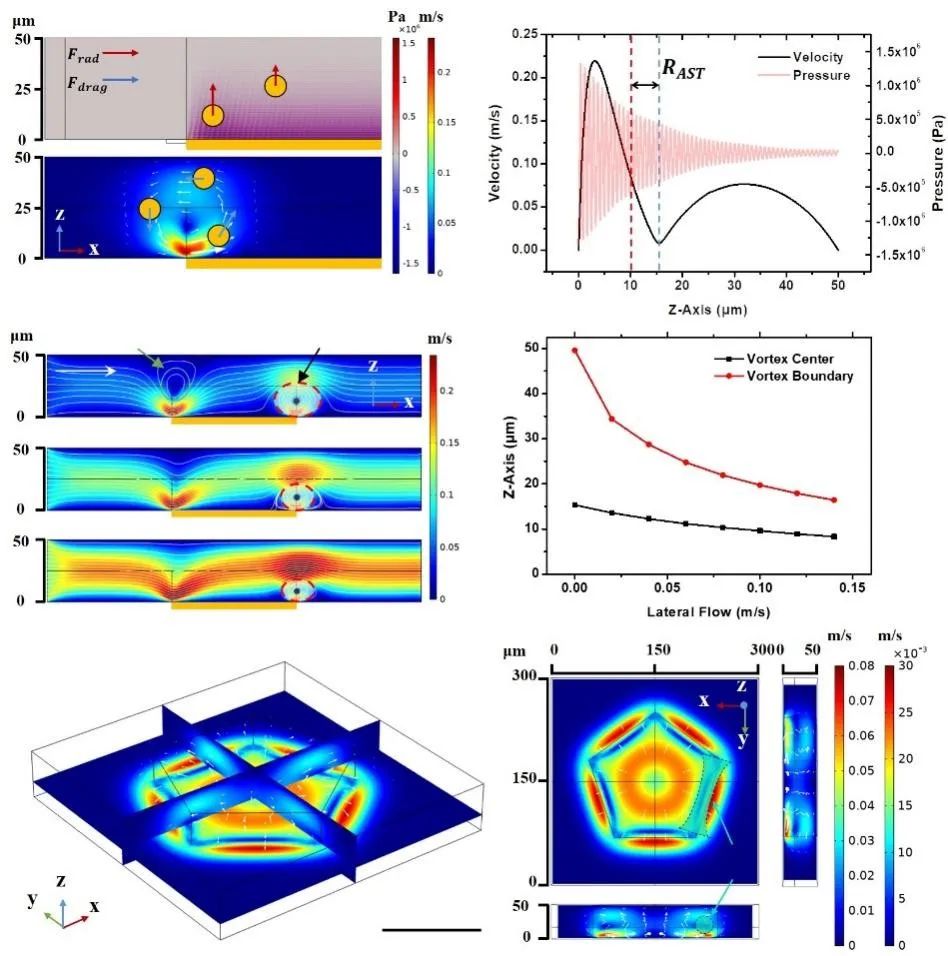
针对操控模式和操控能力这两大瓶颈,杨洋和所在的天津大学精密仪器与光电子工程学院教授段学欣课题组开发出了立体声流技术。与依靠声波驱动的经典声流控技术不同的是,该技术通过强化声流体效应,在微尺度内引发三维分布的声流体涡旋来实现操控。
通过对于微流道的设计,该团队将声流体涡旋的尺寸限制在微米量级,并且涡旋之间可以相互连接形成一对虚拟的隧道。这时,粒子会被聚焦至隧道中心,并会在侧向流的作用下向下游移动。
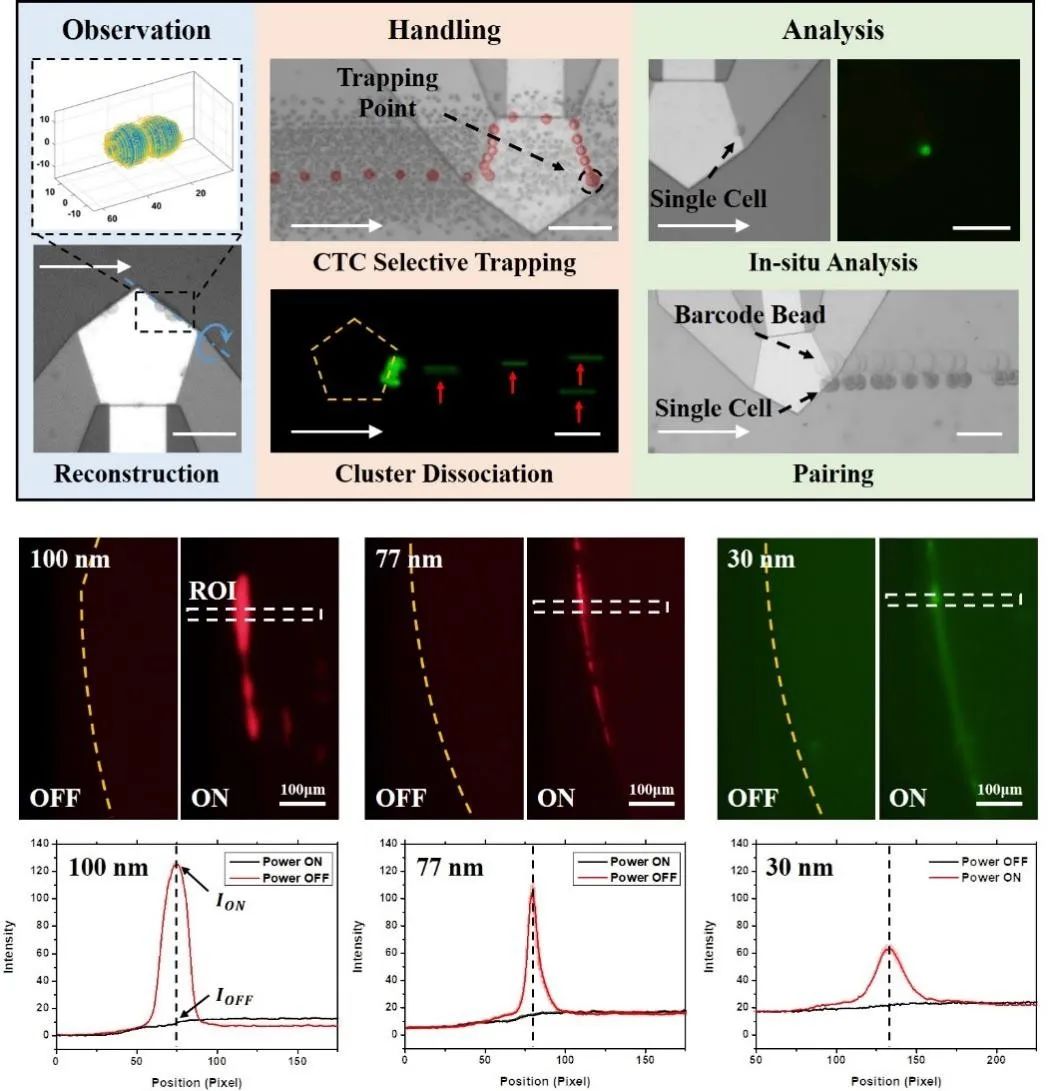
声流体涡旋与微流控侧向流体的配合,一方面丰富了声波单一的驱动模式,为操控带来了更多可能性。在单器件上也可实现对单细胞的旋转、捕获、筛分、染色等多模式操控 。另一方面,它也能弥补声流控技术对纳米级尺寸颗粒操控能力的不足,将操控的极限尺寸提高至30nm。
相关论文于2022年先后发表在Microsystems&Nanoengineering和Science Advances上。杨洋担任第一作者,其导师段学欣担任通讯作者。
审稿人评价称,该技术拥有极好的性能,为声波操控技术在生物样品预处理中的应用提供了一个良好范式。同时,也指出了初稿在机理解释和作图表达直观程度上的不足。
为此,课题组补充了更多的机理讨论和仿真展示,来说明立体声流与各种边界条件之间的关系和粒子在虚拟通道中的运动过程。杨洋表示:“这部分修改对不同学科背景的研究者了解我们的技术是十分重要的。”
注定是一场科研“马拉松”
事实上,从2015年决定从器件底层设计出发进行技术开发,就注定了该技术的研发是一场“马拉松”。在正式立项之前,他们经历了两年之久的技术探索期。
据悉,该课题组曾首次将GHz体声波谐振器与微流控技术结合,来实现流体和颗粒物操控。在此之前,领域内更关注GHz器件在生化传感中带来的灵敏度增益,学界曾以一款成功商品化的声学传感技术——石英晶体微天平为目标进行研发,并应用在气体检测当中。
在探索期,该团队学习参考了国际知名声流控课题组的工作,借此来解决基础的封装、进样和系统搭建等基础问题,同时也发表了此次技术的第一篇论文,实现了多相流的混合。
2016年之后,声流控领域快速发展,从纯声波主导的驱动模式,拓展到声流-声波混合驱动模式,这让课题组意识到通过设计调整侧向流、声流和声波的空间分布,或许能打破声流和声波互相干扰的耦合状态,从而实现操控性能的提升。
在组内多次讨论后,该项目于2017年正式立项,经过器件设计、仿真验证、设计流片和基础测试之后,该团队拿到了第一版器件。
很幸运的是,第一批器件就表现出了远超前人的操控能力。那时,杨洋和所在团队带着该成果,参加了微流体领域最权威的国际学术会议MicroTAS 2017。
期间,与会者对三维分布的声流很感兴趣。但是,很遗憾他们当时没能给出完整的实验结果和机理讨论,来展示这种立体操控的特点。回国后,课题组开始思考如何完成立体声流的三维表征。
由于荧光显微镜只能观察x-y平面,无法表征三维分布的声流体涡旋和涡旋内粒子的x-z平面的轨迹,而这对解释和优化立体声流体又是至关重要的。
在尝试多种方案之后,他们最终选择改装共聚焦显微镜来完成表征。“这里要特别感谢莱卡、蔡司、奥林巴斯的工程师们对共聚焦显微镜选型和改装提供的帮助。获得测试数据之后,经过迭代优化的第二版器件很快完成加工,并且达到了预期性能指标。最终在天津医科大学肿瘤医院任秀宝教授团队的支持下,我们完成了真实患者样品的分离实验。”杨洋表示。
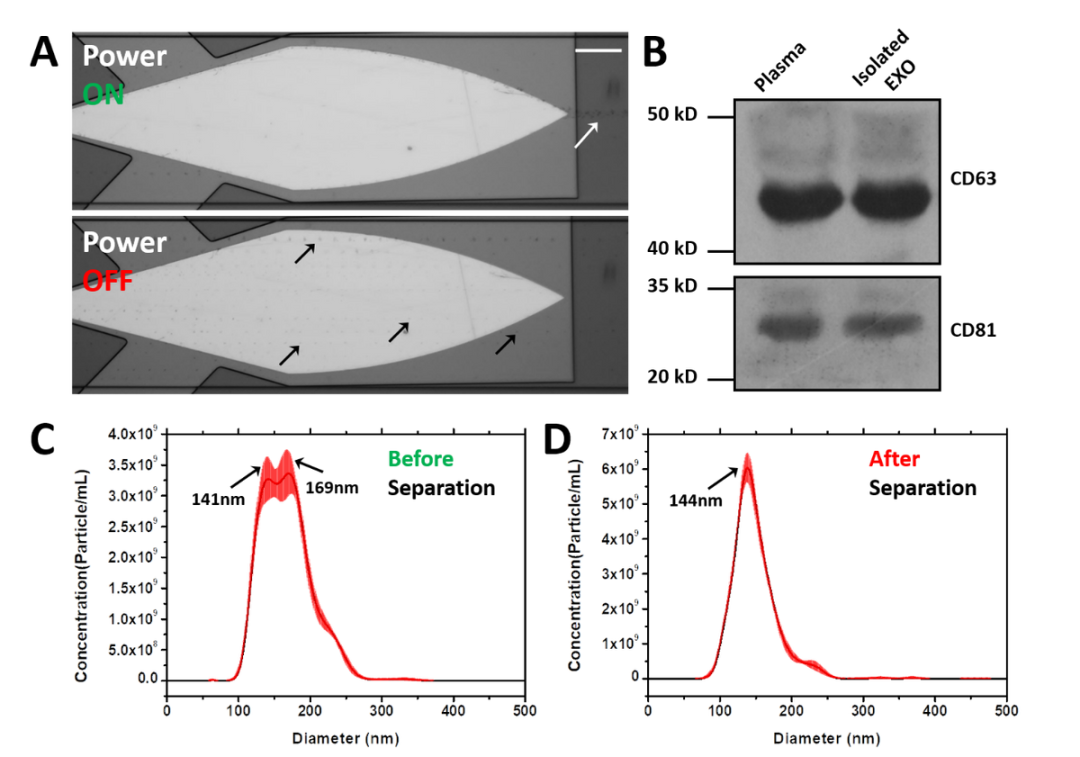
(来源:资料图)
幸得学界和业界相助,相关成果均已申请专利
杨洋表示在技术、虚拟通道的自适应性发现是比较意外的收获。一开始他们只是想表征在不同浓度样品中的富集能力。具体实验中却发现,虚拟通道会根据样品浓度自发的扩张和收缩。
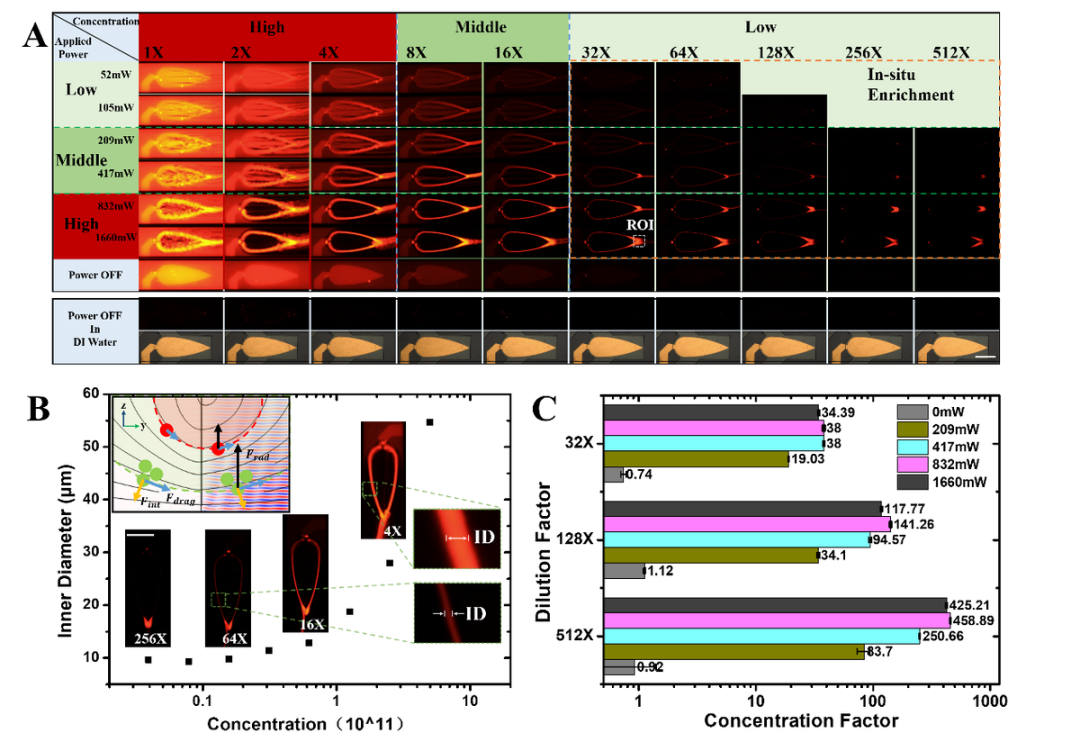
(来源:资料图)
在高浓度样品中,虚拟通道的直径能扩张至几十微米来提高载量和回收效率;在低浓度样品中,会收缩至几微米来提高浓缩倍数。这种虚拟管壁的弹性让该技术具备很好的浓度兼容性,因此更加适合用于生物样品这类批次间有显著差异的样品预处理。
杨洋还表示,合作者们的支持和帮助让人同样难忘。如今,科研的节奏越来越快,面对成果压力,合作者能在数年的项目周期里对他们保持支持,是项目得以顺利完成的重要保障。
如同之前提到的,为了拍摄立体声流的空间分布,课题组当时联系和试用了市面上所有共聚焦显微镜,并且在工程师帮助下进行设备的改装。
在这期间,厂商工程师团队、清华大学医学院显微平台、天津医科大学和南开大学显微平台老师们,都提供了宝贵的建议。此外,在生物样品的处理和产物鉴定上,天津医科大学尹海芳教授团队提供了重要支持。
目前,相关成果全部已经申请专利,包括发明专利三项、PCT专利(Patent Cooperation Treaty,专利合作条约)三项,具备从器件底层设计至应用端的全流程自主知识产权。
此外,杨洋表示:“我们在立项初期的定位,是希望开发一种类似于离心机的通用样品预处理工具,这要求其在拥有堪比超速离心的富集性能的同时,兼具微流控技术的小样品的即时处理能力。”
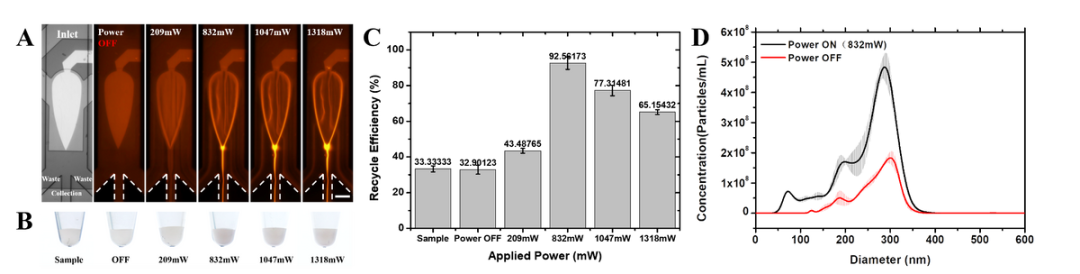
因此,他认为课题组接下来应该会一方面关注该技术在应用端的场景拓展,另一方面会根据应用需求进行定制和仪器化开发。
而杨洋个人的科研兴趣,仍会关注对于立体声流的操控能力和操控模式的进一步提高和拓展。
就操控能力来说,在本文介绍的两篇论文里,他和所在课题组分别完成了单细胞和纳米粒子的操控,即百微米至数十纳米水平的操控。后续,其希望通过设计优化,来将操控能力推动到生物大分子水平。
在操控模式方面,微流控技术虽然有诸多优势,但是始终与生命科学研究逻辑和习惯是不符的。因此,该团队更希望在经典的培养皿-显微镜体系中开展研究。
针对这一需求,课题组期待能将立体声流技术的应用场景进一步拓展至开放环境,这需要对机理和工作模式有更多的理解和设计,同时也是他们的重要研究方向。
-
华东师范大学:激光定制3D微流控芯片连续制备不同尺寸半导体聚合物纳米颗粒用于荧光传感2023-07-06 2365
-
高压功率放大器在超声驻波场的水下颗粒操控中的应用2023-01-05 1131
-
功率放大器在磁性微纳米颗粒微流体操控研究中的应用2022-11-02 907
-
微纳米颗粒的磁场驱动控制平台设计2022-06-21 2200
-
微流控技术在纳米给药领域的研究进展2022-05-05 3096
-
数字式通用颗粒物PM2.5传感器:监测空气中的悬浮颗粒物2021-11-26 3014
-
PM2.5传感器的应用:室内燃香颗粒物的危害2020-12-25 1370
-
关于重型柴油车颗粒物烟度传感器技术的应用2020-07-13 1890
-
参量立体声简介2012-07-10 1682
-
立体声放大器,立体声放大器的原理/选用/作用2010-03-22 1653
-
什么是准立体声/立体声?2010-02-05 671
-
电视节目立体声播出方案探讨2009-10-06 3893
全部0条评论

快来发表一下你的评论吧 !

