

一种3D打印支架集成的“三明治”结构微流控装置
描述
大多数体内组织细胞存在于三维细胞外基质(ECM)中。为了更好地研究细胞生理学和病理生理学,越来越需要类似于体内的微环境以培养细胞,目前正在研究的策略包括水凝胶、球体、组织支架和非常有前景的微流控系统。
近期,大连理工大学的李经民课题组,提出了一种3D打印支架集成的“三明治”结构微流控装置,用于三维动态细胞培养。研究发现,该微流控装置具有良好的生物相容性和可行性,在体外细胞研究、组织工程和肿瘤治疗药物筛选方面具有巨大的潜力。相关研究以 “Engineering a dynamic three-dimensional cell culturing microenvironment using a ‘sandwich’ structure-liked microfluidic device with 3D printing scaffold”为题发表在Biofabrication期刊上。
在二维细胞培养技术中,细胞生长在平板上,难以模拟体内复杂的三维微环境。近几十年来,微流控技术被广泛采用,以提供简单、有效的3D空间来加速细胞聚集并指导细胞球体的形成,可用于3D动态细胞培养。基于此,李经民课题组提出了一种模拟细胞外基质和微循环的体外三维培养模型的建立方法。使用热辅助电液动力喷射(TAEJ)打印技术设计的3D微流控装置具有“三明治”状夹层结构,包括上层、支架层和底层。用其进行HeLa细胞的三维培养,并与48孔板和无支架装置中的二维培养细胞进行比较。
“三明治”式微流控装置的设计
活体细胞存在于复杂的三维微环境中,其中存在诸如可溶性因子、细胞-细胞接触、细胞-细胞外基质相互作用和流体流动引起的剪应力等因素(图1a)。受体内细胞三维微环境的启发,该研究设计了一种能够为细胞培养提供三维组织支架和动态液的夹心式微流控装置。该装置由三层组成,即上层、支架层和底层(图1b)。图1c显示了微流控装置和不同上下层结构的相应位置。
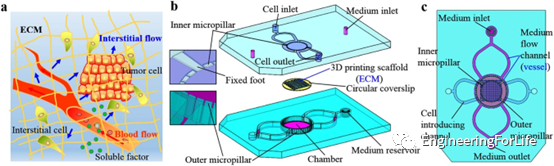
图1 微流控装置的设计
微流控装置的制作
微流控装置的上层和底层是用聚二甲基硅氧烷(PDMS)通过复制母片上的结构来制造的(图2a)。支架层利用PCL/PVP复合生物聚合物墨水并采用TAEJ印刷技术制造(图2b)。最后,使用氧等离子体处理整个装置(图2c),进行不可逆地粘合。
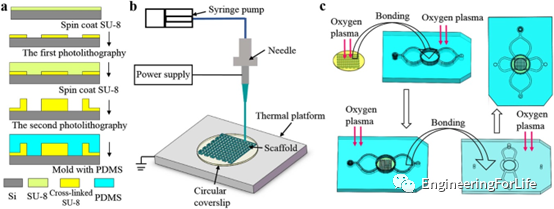
图2 微流控装置的制造工艺示意图
微流控装置的结构
图3a显示了用于打印3D PCL/PVP支架的设备。图3b可见3D打印支架的扫描电子显微镜图像,该支架的支架纤维平均宽度约为12微米,相邻纤维之间的平均距离约为70微米。图3c为支架的三维轮廓,呈现出均匀而光滑的特征。图3d为PDMS上层的断面图像,内部微柱为上板的凸起,凸起的高度为50微米。图3e是底部PDMS层的截面图像,小室的深度等于外部微柱的高度,即200微米。图3f是粘合装置的截面图像,可防止因流体流动而产生的变形冲刷,提高了支架结构的稳定性。图3g是用于粘合三层的设备。经氧等离子体处理后,将一片PDMS放在上板的下表面,另一片放在底板的上表面,并在范德华力的作用下可逆结合。然后,通过调整,将两个PDMS块在Z方向上对齐。最后,将两个PDMS片不可逆地粘合在一起(图3h)。图3i可见粘合的装置充满了红色墨水,表明装置内的流动状况良好。
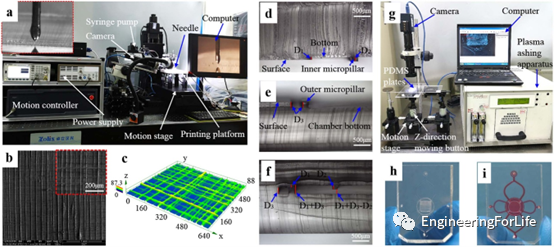
图3 微流控装置的设备和结构 支架对装置内流场的影响
为了研究3D打印支架对装置内流场条件的影响,定性上,通过比较颜色的渐变,可以观察到控制室(图4a)中的流速明显快于支架区域 (图4b)。图4c显示了沿交叉线的速度曲线,这些抛物线状曲线表明,室内的流场分布明显不均匀。相反,支架区域的流场分布更均匀,交叉线的曲线相对平滑(图4d)。在图4e-f中,蓝色轨迹的长度表明控制室的平均速度比支架区域的平均速度快。图4g显示了不同设备中平均跟踪粒子速度的小提琴曲线图。红点和蓝点表示速度样本的中位数,可见红色小提琴区(无支架装置)的高度大于蓝色(有支架装置)的高度,前者的速度分布更分散,说明支架可以为细胞培养提供更均匀的流动微环境。
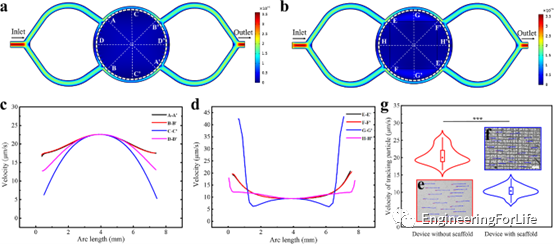
图4 微流控装置内的流场状况及3D打印支架对其流场的影响
墨水流动模拟细胞培养过程
为了展示细胞培养过程,研究了不同颜色油墨的流动行为。首先,在引入HeLa细胞悬液(蓝色墨水)之前,在装置中装满培养液(红色墨水)以去除气体。用塞子堵住细胞入口和细胞出口,通过将培养液入口连接到注射器泵上,将培养液注入设备(图5a)。输注20s后,将细胞悬液(蓝色墨水)注入装置,多余的细胞悬液从细胞出口溢出。培养液入口和出口用塞子堵塞(图5b)。结果表明,输入20s后,培养室内充满蓝色墨水。静置6h后,将培养液输入,细胞入口和细胞出口被堵塞(图5c)。可见灌装500s后,该装置充满了红墨水,表明培养室内装满了培养液,废液从培养液出口流出。
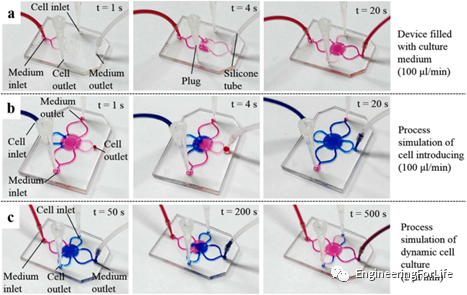
图5 Exo-TDN的肝脏保护作用研究 在装置和平板中培养HeLa细胞
在3D打印支架的微流控装置中培养HeLa细胞,研究其生物相容性和可行性。图6a-c分别显示了引入微流控装置和平板中的HeLa细胞的初始状态。6d-f分别显示了HeLa细胞在微流控装置内和平板内培养72h的状态。可见,在有支架的小室中,HeLa细胞在明场上的观察受到了干扰。因此需结合活/死(绿/红)染料染色,以进一步估计细胞密度(图6g-i)。这些荧光图像中细胞亮度的变化可能表明HeLa细胞在不同的深度附着在支架上。图6j-l分别显示了HeLa细胞在有支架装置、无支架装置和48孔板中的空间分布重建。相应地,3D重建的X-Z截面如图6m-o所示,以表征细胞在高度(Z轴)方向上的分布。可以明显观察到,支架装置的细胞三维重建高度明显大于对照组。图6p显示带有支架的装置中的细胞密度显著大于对照装置和平板中的细胞密度。表明,三维动态培养模型在促进细胞生长方面具有优势。根据活/死染色结果计算活细胞数与总细胞数之比,评价HeLa细胞的存活率。如图6q所示,平板和对照装置中的细胞存活率为86.7%和90.8%,而支架微流控装置细胞存活率为95.3%,优于对照组。图6r显示了培养72h后,有支架微流控装置的细胞纵横比中位数约为3.2,是平板和无支架装置的1.5倍以上。结果表明,支架可以促进细长和纺锤形的HeLa细胞的形态发生。
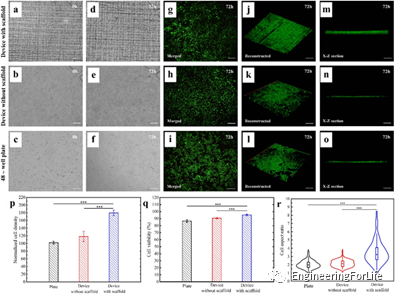
图6 HeLa细胞生长在微流控装置和平板内
微流控装置和平板中DOX的细胞毒性评价
实验结果表明,在不同浓度的DOX作用下,支架组的细胞存活率始终高于对照组,且细胞存活率随DOX浓度的增加而降低。较高浓度的DOX对HeLa细胞存活率的影响较低浓度的细胞更为显著,除了药物传递效率低下外,3D支架中形成的体内类微环境可能在耐药中发挥重要作用,因为较高的细胞密度限制了DOX对3D类组织结构的渗透。此外,从荧光图像中可以明显地观察到DOX作用24h后细胞形态的变化,支架装置的细胞长宽比中位数仍然高于其他组,意味着治疗后细胞的去极化行为也表现出对DOX的剂量依赖性反应,与细胞活力是一致。以上结果表明,具有支架的微流控装置,为体外细胞研究、组织工程和肿瘤治疗药物筛选提供自然的微环境(图7)。
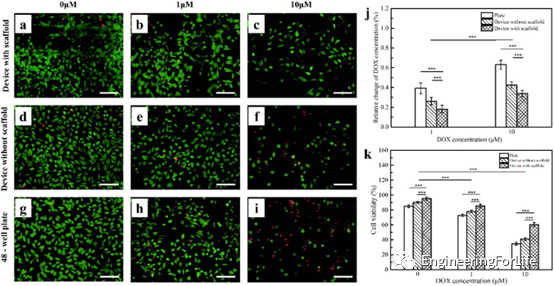
图7 微流控装置和平板中的HeLa细胞经不同浓度的DOX处理24h后的细胞毒性研究
综上所述, 研制了一种“三明治”结构的微流控装置,用于在有流体流动的三维微环境中进行动态细胞培养。该装置由三层组成,上层用于引入细胞和固定支架,中间层模仿细胞外基质提供3D附着区,底层模仿血管为细胞提供动态培养液。利用3D打印技术和微细加工技术成功地制作了该器件。该支架可以为细胞培养提供更稳定的流体微环境,具有良好的流动性,促进了细胞的生长和活力。DOX的体外细胞毒性评估证实,采用3D支架模拟体内微环境的装置具有更高的耐药性。可为体外细胞研究、组织工程和肿瘤治疗药物筛选提供良好的微环境。
论文链接:
https://doi.org/10.1088/1758-5090/ac8a19
审核编辑 :李倩
-
干货 什么是变压器三明治绕线法2024-12-11 2002
-
微流控气泡发生器+DLP 3D打印用于构建3D多孔生物支架2023-09-26 2429
-
涂鸦三明治开发板简介、应用场景与原理图2022-03-26 4447
-
涂鸦三明治 Wi-Fi&BLE SoC NANO 主控板免费试用2022-03-21 1845
-
怎样去设计一种基于STM32F103+涂鸦三明治的宠物自动喂食器呢2021-12-13 1837
-
【红外遥控三明治开发套件免费试用】+开箱分享2020-12-07 3053
-
3D打印复合材料结构的性能分析2020-08-19 1623
-
智能彩灯五路产品原型的代码实现(三明治开发板+Arduino,Wi-Fi)2020-05-20 1668
-
爱驰汽车的三明治结构专利电池包是什么2020-04-17 4584
-
Von Roll公司开发出了一种三明治结构的夹层板2020-01-13 2765
-
【3D打印图纸】手机摇摆支架设计2018-08-03 5651
-
基于新型三明治结构的MEMS微波功率传感器结构设计2018-01-17 3713
-
Android操作系统—“冰淇淋三明治”2011-05-11 868
-
快乐牌70型三明治电烤炉电路图2008-11-18 2401
全部0条评论

快来发表一下你的评论吧 !

