

基于单价离子存储的普鲁士蓝类似物电极分析
描述
1
图文摘要
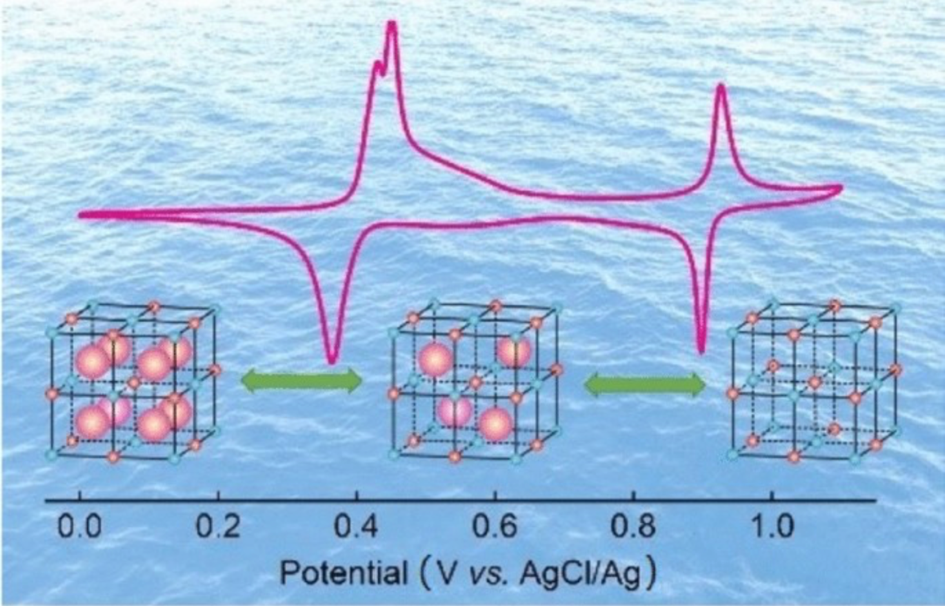
2
内容简介
1. 简介
2. 用于单价离子存储的普鲁士蓝类似物电极
2.1水性锂离子电池
2.2水性钠离子电池
2.3水性钾离子电池
2.4水性铵离子电池
2.5水性质子离子电池
3. 讨论与展望
3
综述亮点
1、分析比较了不同单价离子(锂、钠、钾、铵、氢离子)对普鲁士蓝材料的影响规律,并强调了“电荷载流子”对电极材料性能的关键影响;
2、总结了普鲁士蓝材料在新型水系电池(铵离子、氢离子)中的应用,并指出了铵离子电池潜在的高电压和氢离子电池潜在的超高倍率和长循环;
3、对普鲁士蓝类材料的机理理解和实际应用挑战等方面,作出了分析与展望。
4
图文导读
(1)前言
清洁能源(太阳能、风能)的开发使用依赖于廉价、安全的储能电池系统。目前,锂离子电池广泛应用于较为高端的储能领域,如手机、笔记本、电动汽车等,但是在大规模储能领域却受到限制。其一是锂元素在地壳中的储量很低(~0.00002),不足以支持电网级别的储能应用;其二是可燃碳酸酯电解液的使用,导致锂离子电池存在较大的安全隐患。相比之下,基于水系电解液的铅酸电池具有安全性高、价格低廉等优点,目前已在规模储能领域有所应用。然而,铅酸电池毒性大,循环性能有限,能量密度较低(30 Wh kg−1),并不是一种理想的规模储能电池。因此,开发一种资源丰富、价格低廉,且电化学性能(能量密度、循环等)优于铅酸的水系二次电池体系,对于规模储能具有重大的现实意义。
自从1994年Jeff Dahn首次提出水系二次锂离子电池的工作原理之后,研究者逐渐将水系电池扩展到钠、钾、钙、镁、铝、锌等离子体系。尤其是近年来新型水系电解液的发展(如高浓度、混合型等),将水系电池的研究热情推到一个新的高度。在二次电池体系中,电极材料往往起到主导性的作用,尤其对于规模储能型电池,电极材料更需要同时满足低成本、高性能、可持续等特点。目前的水系电极材料,大致分为氧化物、磷酸盐、有机物以及普鲁士蓝四大类。其中,氧化物结构紧密,局限于Li、Na电池体系;而磷酸盐因其较高的分子量,导致比容量偏低(60–120 mAh g−1)。有机物材料可以储存多种离子体系,但通常电导率低、振实密度低,限制实际应用。相比之下,普鲁士蓝具有诱人的应用前景,不仅具有开放性的晶体结构、可逆的氧化还原过程,适合多种离子的普适性储存,而且合成简便,通过简单的液相沉淀法即可制备,避免了球磨、高温煅烧等高能耗过程,降低了材料制备成本。
普鲁士蓝类材料代表着一大类过渡金属氰化物,分子式一般可以表示为AxM[Fe(CN)6]·mH2O,其中A和M分别代表阳离子(如Li+, Na+, K+等)和过渡金属离子(如Fe, Co, Ni, Cu等)。图1(a)给出了结构完整的普鲁士蓝晶体结构示意图。其中,Fe元素与氰根的碳原子形成6配位,M则与氰根的单原子形成6配位,根据–Fe–CN–M–化学键的有序排列,最终形成了三维立方体结构,A+阳离子和沸石类型水分子占据在小立方体的中心。根据Fe/M氧化状态的不同,普鲁士蓝类材料可以进一步分为普鲁士黄(Prussian Yellow,Fe和M均为+3价,简写为PY)、普鲁士蓝(Prussian blue, Fe为+2价M为+3价,或者Fe为+3价M为+2价,简写为PB)和普鲁士白(Prussian white,Fe和M均为+2价,简写为PW)等三种。然而,在实际制备中,PBA材料容易形成铁氰根Fe(CN)6空位,导致M/Fe偏离1:1的计量比(通常大于1),而且会引入更多的配位水分子,从而形成AxM[Fe(CN)6]1−y·□y·mH2O的分子式。为便于理解,图1(b)给出了具有1/4 Fe(CN)6空位的PBA材料,该空位位于结构中心,同时引入了6个配位水分子。需要说明的是,在实际样品中,这些结构空位会随机地分布在整个晶体结构中。
根据“结构决定性质”的观点,我们不难发现,PBA电极材料具有多方面的优点。第一,结构中具有两对潜在的氧化还原活性中心,M3+/M2+和Fe3+/Fe2+,对应着高达150–190 mAh g−1的理论比容量(按照A2MFe-PWA计算,A = Li, Na, K)。第二,由于氰根的配位效应,碳配位的Fe3+/Fe2+和氮配位的M3+/M2+电对具有0.6–1.2 V的反应电位(相对于标准氢电池),利于提升全电池的电压。第三,PBA具有结构开放的三维网络结构,离子通道为3.2 Å,内部空隙为4.6 Å,适合多种离子的储存。第四点,开放的晶体结构还可以缓冲离子在嵌入脱出时的体积变化,有利于提升电极的长期循环性能。最后,PBA材料为难溶于水的沉淀,理论上,可以避免电极材料的溶解流失。
由于PBA材料的结构特点,PBA材料已经广泛应用于多种水系离子电池体系,如单价、二价、三价等。尤其是,在单价离子电池体系中,PBA表现出最优的综合电化学性能。另外,从实际应用的角度出发,单价离子电池更容易设计匹配全电池,比二价、三价似乎更接近应用。更为重要的是,由于这些离子的性质相近,又都可以嵌入PBA材料,为研究“离子–材料”间的相互作用,提供了极大的便利。因此,在本综述中,我们选择了代表性的PBA水系电池研究成果,分析比较了相同材料在储存不同离子(Li+, Na+, K+, H+, NH4+)时的电化学反应行为差异,并对其储能机理进行了分析讨论,突出强调了“电荷载流子”对电极材料性能的关键影响。
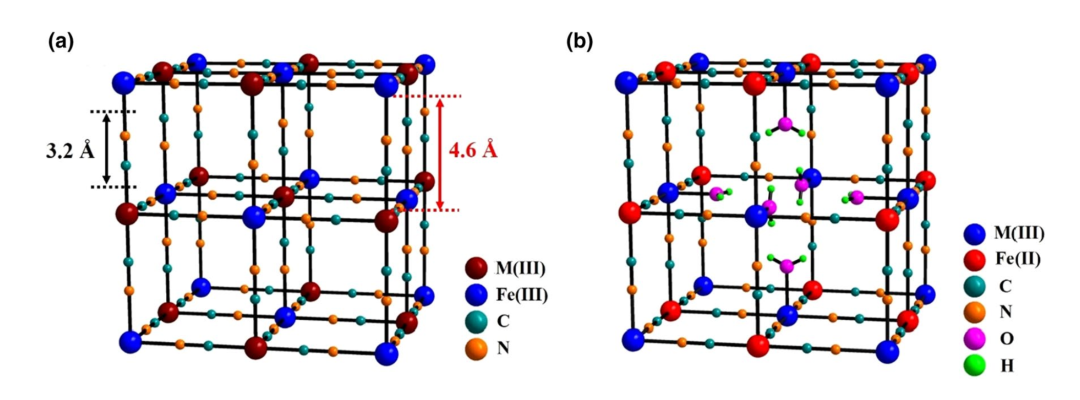
图1 普鲁士蓝材料的晶体结构示意图:(a)完整的MIII[FeIII(CN)6]⸱2H2O材料;(b)含1/4 Fe(CN)6空位的MIII[FeII(CN)6]3/4·□1/4·3.5H2O材料。
(2)内容概括
2.1 水系锂离子电池
在各种水系离子电池中,水系锂离子电池研究最早,研究机理也最为深入。但是PBA材料在水系锂离子电池中的研究并不多见,主要原因在于PBA材料的离子通道(3.2 Å)与水化锂离子尺寸(3.82 Å)不匹配。由于Li+较高的水合能,水分子难以被脱离,当太大的水合离子试图强行进入PBA结构,会导致PBA材料的结构损坏,进而导致循环性能衰减。
Yi Cui等人早在2011年分析比较了NiFe–PBA和CuFe–PBA材料储存不同离子的行为,发现PBA材料表现出很强的离子倾向性:NH4+ 》 K+ 》Na+ 》 Li+,表现为不仅Li+的反应电位最低,循环性能也最差。最近的研究也发现,FeFe–PYA在水系Li+电解液中具有很快的容量衰减和形貌变化,但XRD峰位却无变化,推测是水合Li+离子聚集在PBA表面附件,或者进入到铁氰根空位的位置。因此,PBA材料在水系锂离子电池中的应用,受到本征晶体结构的极大限制。
2.2 水系钠离子电池
相比于水系锂离子电池,水系钠离子电池资源更为丰富,更适合规模储能。另外,钠离子的离子尺寸较大,更适合嵌入PBA的晶体结构。因此,PBA作为水系钠离子电池的正极材料,得到了十分广泛的研究与关注。在各种PBA材料中,NiFe–PBA和CuFe–PBA的研究较早,循环性能也十分优异(》2000 次),但因为Ni、Cu离子的电化学惰性,导致这两种材料为单电子反应,实际比容量较低(~60 mAh g−1)。相比之下,两电子反应的FeFe–PBA, MnFe–PBA和CoFe–PBA则可以提供更高的反应容量,然而,他们的循环性能往往较差。早期的电分析文献甚至认为,PBA材料性能衰减的原因在于水化钠离子的尺寸太大,会破坏PBA材料的晶体结构,因此将钠离子归结为“阻断离子(blocking ions)”的范畴。
根据“结构决定性质”的观点,电池研究者发现,PBA嵌钠性能的衰减,实际上来源于PBA结构的不完整。在常规的液相沉淀法中,PBA材料结晶速率快,结晶度低,还含有大量的铁氰根空位(图1(b)),这导致在两电子反应的过程中,晶体结构容易破坏,循环性能快速衰减。因此,合成低空位、高结晶度的PBA材料,是实现两电子PBA循环稳定的关键。从配位化学的角度来说,Mn+离子既可以与水分子配位,形成水合Mn+(H2O)m离子,也可以与[Fe(CN)6]n−阴离子配合,形成M/Fe计量比1:1的M[Fe(CN)6]化合物。相比之下,形成M[Fe(CN)6]化合物是热力学上十分倾向的反应,这也是PBA材料发生沉淀反应的根本动力;但是,该物质的反应动力学较慢。在常规的快速沉淀法中,许多水合的Mn+(H2O)m离子往往来不及脱去全部水分子,从而直接以水合离子形式参与配位反应,导致了Fe–CN–M和Fe–CN–M⸱H2O化学键的同时存在。这些配位水分子,进一步导致了铁氰根空位的产生。因此,降低结晶速率是合成低缺陷、高结晶PBA材料的关键因素。
在合成低缺陷PBA材料方面,武汉大学的杨汉西教授课题组较早做出了机理层面的研究工作。发现,当把Fe3+与[Fe(CN)6]3−溶液混合时,并不会得到沉淀,而是一种深棕色的溶液,该颜色来自于Fe3+···[Fe(CN)6]3−络合物。当缓慢加热到60 ℃时,Fe3+···[Fe(CN)6]3−络合物会缓慢氧化水分子或者溶液中的氯离子,形成Fe3+···[Fe(CN)6]4−化合物,该物质具有极低的溶解度常数(Ksp),从而形成大量细小的晶核,促进格林绿晶体缓慢结晶。最终,格林绿材料含有13%的铁氰根空位,远小于常规的25%,而且表现出完整的立方体形貌,也反应出结晶过程的缓慢与充分。图2(a)给出了该物质的缓慢结晶示意图。同时,该材料的储钠电化学性能(比容量、循环),远远高于常规样品(图2(c, d))。另外一种制备方法被称为络合结晶法,或者控制结晶法(图2(b)),即在反应前加入另外一种络合剂(如柠檬酸根等),与Mn+离子预先形成配位,从而降低初始态的PBA浓度。由于络合剂的竞争反应,柠檬酸络合的Mn+离子会缓慢释放出低浓度的Mn+离子,与铁氰根反应,从而延缓了结晶速率,最终也可以得到低缺陷、高结晶的PBA材料。图2(e)给出了低缺陷CoFe–PWA材料的充放电曲线,表现出十分稳定的两电子嵌钠反应,比容量为~125 mAh g−1。目前,这两类方法已经广泛应用于合成低缺陷的PBA材料。
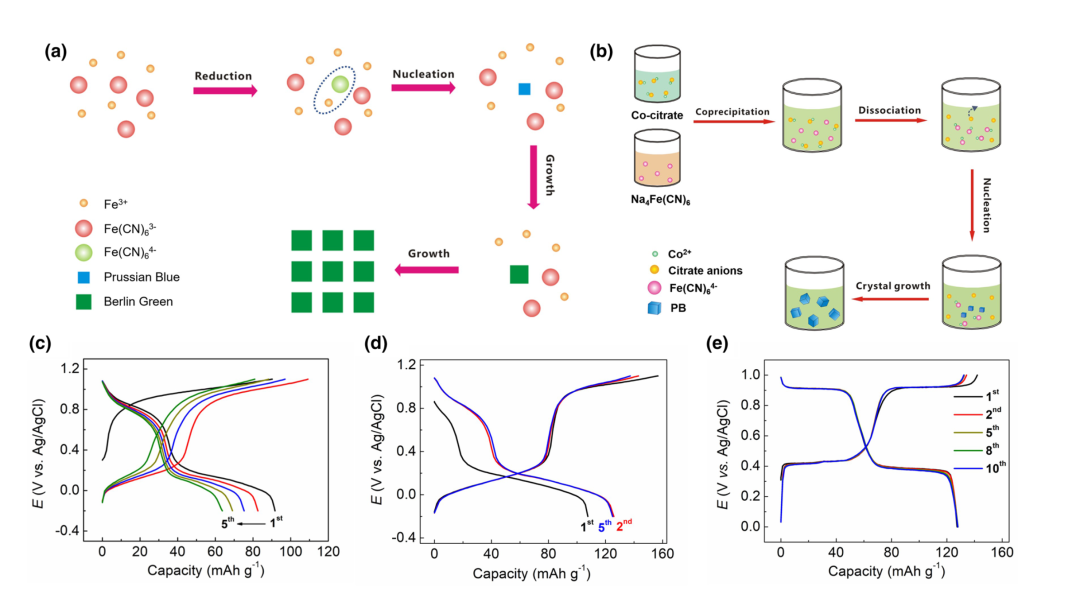
图2 (a)格林绿材料的缓慢结晶示意图;(b)络合结晶法合成低缺陷的CoFe–PWA材料;(c)常规PBA材料的充放电曲线;(d)低缺陷格林绿的充放电曲线;(e)低缺陷CoFe–PWA材料的充放电曲线
2.3 水系钾离子电池
相比于锂、钠离子,钾离子的离子半径较大(1.38 Å),限制了嵌钾电极材料的开发。PBA因其开放的晶体结构,是为数不多的高性能储钾正极材料。2011年,Yi Cui报道了NiFe–PBA和CuFe–PBA在水系钾离子电池中的性能,二者分别具有5 000和20 000圈的循环性能,但是比容量较低,仅为~60 mAh g−1. 为开发高容量正极,需要将目光转移到FeFe, MnFe和CoFe–PBA上。
Wang 等利用单一铁氰源法,通过缓慢结晶,制备了K2FeFe(CN)6·2H2O化合物,比容量达到120 mAh g−1. 相比于Na2FeFe(CN)6, 该K2FeFe(CN)6正极的反应电位更高,而且表现出2个充放电平台(而不是斜坡),表明由于钾离子较大的离子半径,PBA结构发生了从立方相到单斜相的转变。MnFe–PBA也可以表现出两电子嵌钾反应,比容量可达~130 mAh g−1,但是由于材料溶解流失的问题,需要使用高浓度电解液以改善循环性能。Hu等人报道了22 mol kg−1 KCF3SO3高浓度电解液对MnFe–PBA循环性能的改进,并与有机小分子负极匹配,构建了能量密度~80 Wh kg−1的水系钾离子全电池。相比之下,两电子反应的CoFe–PBA还鲜有报道,可能原因是CoIII/CoII电对对配位环境更为敏感,较大的钾离子会影响整体材料的电子结构、配位环境等。
由于钾离子半径太大,开发适合的储钾负极材料十分困难,因此,研究者们构建了混合型离子电池。例如,使用PBA材料为储钾正极,磷酸钛钠为储钠负极,Na/K混合溶液为电解液,可以构建Na/K混合离子电池。电池的工作原理为:利用PBA材料的离子选择性(K 》 Na 》 Li),PBA会优先储存钾离子;利用NaTi2(PO4)3负极的框架尺寸效应,钾离子太大不能嵌入,但可以嵌入较小的钠离子。但是,该混合电池会消耗电解液,因此,计算电池的能量密度,需要考虑电解液的用量。
2.4 水系铵离子电池
相比于水系锂、钠、钾离子电池,铵离子电池的研究起步较晚,研究较少,可能在于铵离子更大的离子半径(1.48 Å),限制了材料的开发。但是,铵离子的大小与PBA的空腔尺寸可以很好地匹配,导致许多PBA材料不仅表现出更高的嵌铵反应电位,也给出优异的循环性能。
为了构建“摇椅型”铵离子全电池,需要找寻一种富含铵离子的PWA材料。美国俄勒冈州立大学的纪秀磊课题组以“富钠态”NiFe–PWA为原料,利用PWA框架对铵离子的喜好,通过液相的离子交换法,成功制备了“富铵态”PWA材料(图3(a))。发现,当PWA晶格中为钠离子时,晶体结构为扭曲的单斜相,当钠离子全部被替换为铵离子时,PWA恢复为经典的立方相结构(图3(a)),这也证明了PWA结构对铵离子的喜好。而且,充放电测试表明,该“富铵态”PWA材料的平均反应电位高于“富钠态”材料0.2 V(图3(b)),有利于提升水系全电池的电压。该材料也表现出长达2 000圈的循环稳定性能。
开发两电子储铵PBA材料,研究者尝试了之前水系Na、K电池体系的低缺陷FeFe–PBA材料。虽然氮配位FeIII/FeII电对的反应电位得到了提高,但是FeFe–PBA材料却只表现出一对氧化还原峰。即使扫描到更高电位,碳配位的FeIII/FeII电对也无明显活性(图3(c))。其他的两电子MnFe和CoFe材料,在铵离子电池体系,也同样表现出类似的行为。这似乎暗示铵离子影响了PBA材料的本征电化学行为。虽然FeFe–PBA的比容量降低为~90 mAh g−1,但是由于铵离子与PBA框架的高度匹配,在整个嵌入反应过程中,材料的体积变化率小于1%,属于“零应变”材料的范畴;相比之下,水化钠离子的嵌入会引起显著的体积膨胀,而钾离子的嵌入则降低结构的对称性,成为单斜相结构(图3(d))。最终,铵离子表现出最佳的循环性能(图3(e)),在大电流循环下,经过5万圈循环,仍然具有78%的容量保持率。
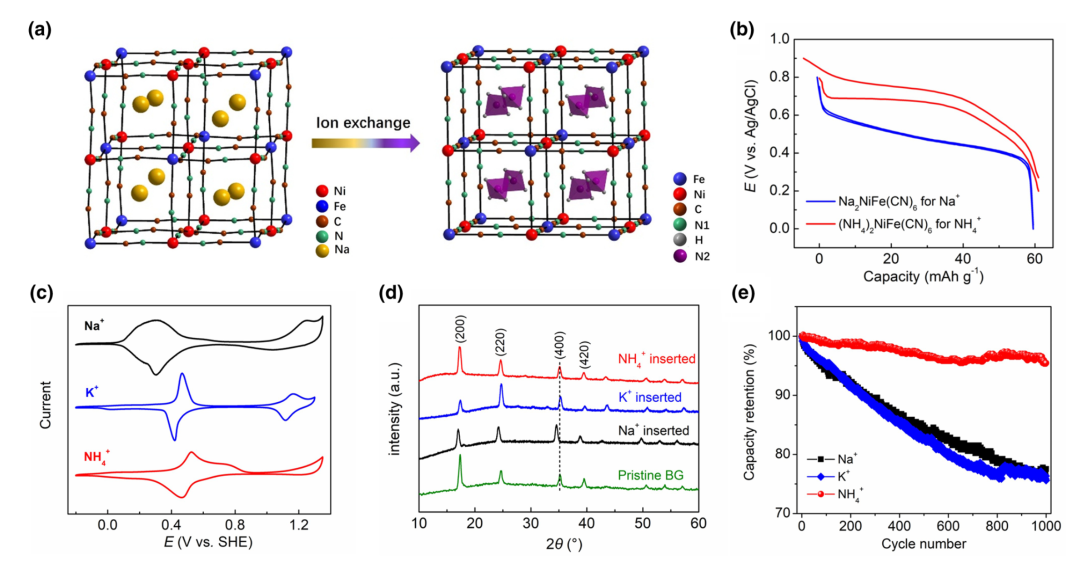
图3(a)离子交换法制备“富铵态”PWA材料;(b)NiFe–PWA嵌钠、铵充放电曲线比较;(c)FeFe–PBA在水系Na+, K+和NH4+电解液中的循环伏安曲线;(d)FeFe–PBA嵌入Na+, K+和NH4+后的结构变化;(e)FeFe–PBA嵌入不同离子的循环性能
2.5 水系氢离子电池
相对于其他离子,氢离子最具最小的分子量(+1.0 g mol−1)和最小的离子半径(~0.89 fm),因此更容易嵌入材料的晶体结构,实现较高的反应容量。在早期的研究中,研究者也往往加入一定的酸溶液,以提升PBA材料嵌钠、钾离子的循环稳定性能。但是,考虑到PBA结构的离子选择性(NH4+ 》 K+ 》Na+ 》 Li+),似乎最小的氢离子并不是合适的选择。如图4(a)所示,低缺陷的FeFe–PBA可以实现稳定的Na+、K+嵌入反应,但是在H2SO4水溶液中,容量却衰减很快。因此,早期的电分析、电催化文献,也把氢离子归属为PBA“阻断离子”的范畴。
实际上,氢离子的水合能很高,嵌入PBA材料的形式可能是水合的氢离子,如H3O+,该离子的尺寸(1.0 ± 0.1 Å)与裸Na+半径(1.02 Å)接近;或者,嵌入的形式为纯的质子,嵌入后与PBA中的水分子结合形成水合氢离子。因此,氢离子仍可以在部分PBA材料中实现稳定的嵌入反应。虽然PBA材料嵌入氢离子的反应电位不如Na+, K+和NH4+离子高,但是反应电位仍然高于Li+,如图4(b)所示。
氢离子在水溶液中具有最高的离子电导率,这是由于氢离子具有独特的“格罗特斯”传递机理(Grotthuss Mechanism):在氢键链接的水分子链上,氢离子可以通过改变氢键-共价键的结合方式,实现自身的快速传输(图4(c))。可以理解为氢离子撞击水分子链,改变氢键–共价键结合方式,从而撞出另一端的氢离子,该速率远远快于溶剂化氢离子的缓慢扩散。利用这一原理,纪秀磊课题组设计了一种高度水合、缺陷的CuFe–PBA材料,结构中充满了沸石水分子和配位水分子,二者通过氢键链接,构建了巨大的氢键网络结构(图4(d))。测试发现,该PBA材料可以表现出高达4 000 C的倍率性能(图4(e))和长达73万圈的循环性能。如此快速的倍率性能来源于氢离子在氢键网络中的高度传输。而且,即使将反应温度降低为−40 ℃,在电解液部分凝固的状态下,缺陷态NiFe–PBA仍可以表现出50 C的高倍率行为(图4(f))。
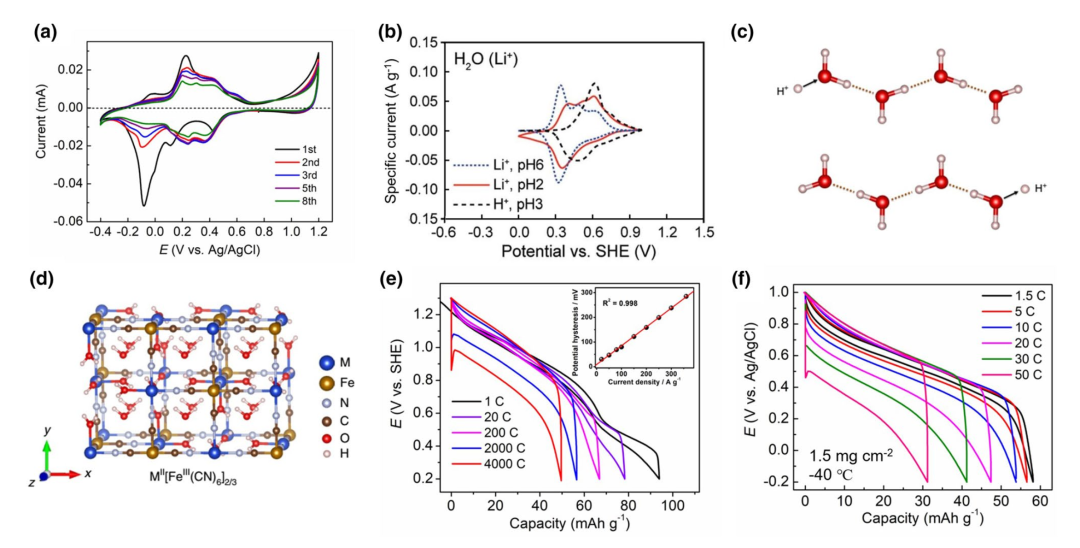
图4(a)低缺陷FeFe–PBA在0.1 M硫酸水溶液中的循环伏安曲线;(b)NiFe–PBA嵌入H+和Li+的循环伏安曲线比较;(c)氢离子的格罗特斯传递机理示意图;(d)高度缺陷的MFe-PBA材料;(e)高度缺陷CuFe–PBA材料的倍率性能;(f)高度缺陷NiFe–TBA材料在−40 ℃低温下的倍率性能。
5
重要结论
(1)电荷载流子对于PBA材料具有显著的影响,会综合影响电极反应的热力学、动力学和可逆性。由于PBA材料自身的大框架结构,整体的离子倾向度表现为NH4+ 》 K+ 》 Na+ ≈ H+ 》 Li+。对于PBA材料,锂离子不是十分合适的离子体系,Na+和K+能够表现出最高的比容量,NH4+能够释放出最高的反应电位和循环性能,而H+则有望实现极高的反应动力学。这一现象也表明,在未来研究中,可以根据材料或者离子的本征特性,针对性地进行“离子/材料”组合的设计与优化,以实现对高能量、高倍率、或长循环电极反应的需求。
(2)在各种PBA材料中,NiFe–PBA和CuFe–PBA容量较低,而且Ni/Cu元素价格较高,限制大规模储能应用。CoFe–PBA的反应电位、比容量都较高,但是电化学性能受离子体系的影响很大,而且Co元素十分昂贵,因此不适合规模储能应用。相比之下,FeFe–PBA和MnFe–PBA最具实际应用前景,不仅价格低廉,而且比容量和反应电压都相对较高,因此应该作为未来研究的重点。
(3)虽然单一PBA材料在单一离子体系中的性能与机理,得到了广泛的研究,但多集中于应用层面;对于不同离子对PBA材料性能、反应机理的影响,缺乏深入、系统的机理研究。比如,CoFe–PBA材料,为何在Na+体系表现为两电子反应,而在K+体系却仅为单电子反应?为何MnFe和FeFe–PBA材料却不受K+的限制?因此,深入理解微观离子对电极材料的影响机制,对于构建高性能的电极材料、电池体系,具有十分重要的意义。
(4)PBA材料的应用研究需要采取更为严格的测试条件,以更好验证在水系电池实际应用中的可能性。比如,目前的文献数据,使用了较为大量的导电炭(10%–20%)、很薄的电极(1.5–10 mg cm−2)以及大量的电解液,实际应用需要降低导电炭的使用比例、厚的电极载量以及少量电解液等。另外,水系PBA电池的长循环性能,不能仅仅按照循环次数来衡量,更应该考察循环时间,特别是小电流下的循环次数和时间。由于水系电解液容易分解,研究者多采用大电流密度进行循环,以达到降低副反应的目的,但这样会高估PBA材料在水系电池中的循环性能。因此,未来需要建立相对实际、统一的测试标准。
-
离子选择电极2013-03-12 2608
-
关于锂电池电极材料SEM测试、氩离子截面解剖电极片2017-07-07 9180
-
如何规避等离子清洗过程中造成的金属离子析出问题?2021-06-08 5197
-
锂离子聚合物电池凝胶态电解质中碳电极的电化学特性2009-11-04 1392
-
普鲁士蓝薄膜电极的制作及充放电研究2011-02-21 730
-
电极污染物分析以及如何有效解决固晶胶沾污LED芯片电极2017-11-24 25339
-
首款培非格司亭生物类似药:长效的粒细胞集落刺激因子,可以用于治疗癌症并发症2018-06-28 10427
-
不同卡西酮类结构类似物的分析对比2021-04-30 1236
-
基于锂化普鲁士蓝类似物的锂离子电池正极2022-12-20 2980
-
锂离子电池的电极厚度对其电化学性能的影响2023-02-07 6327
-
美联新材正式签订了普鲁士蓝(白)钠离子电池正极材料首张吨级订单2023-07-14 1085
-
离子电极电化学土壤离子传感器2024-05-09 839
全部0条评论

快来发表一下你的评论吧 !

