

智能纳米药物用于动态磁共振成像
描述
为实现肿瘤的精准诊疗,开发肿瘤微环境(TME)刺激响应性成像诊断和药物递送的智能纳米药物至关重要。然而,由于肿瘤部位复杂的生理和病理障碍,实现纳米药物的高效肿瘤递送仍然面临着巨大挑战。因此,在开发新型智能诊疗纳米平台时,需要考虑多种障碍,主要包括免疫清除、网状内皮系统(RES)引起的滞留效应、高间质液压力、血管渗漏和淋巴引流不良等。
为了克服免疫和RES器官清除,由于癌细胞膜(CCM)上存在免疫片段、抗原和膜锚蛋白,多种CCM包裹的仿生纳米平台被赋予了免疫逃逸和同源肿瘤靶向能力。为了实现精准的成像诊断、有效的肿瘤给药和降低全身毒副作用,设计TME(酸性pH、过量谷胱甘肽(GSH)等)刺激响应性释放药物的智能纳米药物尤为关键。
对于纳米药物的开发来说,传统合成方法存在诸多缺陷,在重复性制备相同理化性质和足够数量的高质量纳米平台方面显得力不从心。特别是不同批次的纳米平台差异较大,这严重阻碍了其临床转化应用。
相比之下,微流控技术能够通过在微米尺度空间操控微流体进行反应,可以精确控制纳米平台的合成过程,包括成核、生长和聚集。微流控作为一种很有前途的技术,具有试剂损耗低、可控制备和一步合成等特点,在合成高质量纳米平台方面具有相当的优势,能极大助力纳米药物的临床转化。
为了制备高质量的纳米平台,用于克服TME的生理屏障,实现纳米药物的高效靶向递送、肿瘤微环境响应的药物释放、动态磁共振成像和肿瘤的联合治疗,东华大学史向阳教授团队基于微流控技术开发了CCM包覆的负载顺铂的聚多巴胺超小氧化铁纳米团簇(FDPC NCs)用于肿瘤微环境刺激响应的动态磁共振成像导引的肿瘤联合治疗(图1)。
研究团队首先利用含有二硫键的胱胺(Cys)将超小铁(Fe₃O₄)交联,得到GSH响应的Fe₃O₄纳米团簇(Fe₃O₄ NCs)。随后以Fe₃O₄ NCs、多巴胺盐酸盐(DA)、顺铂和CCM为原料,基于微流控方法合成了尺寸均一的FDPC NCs。
为了比较,研究团队通过传统的湿化学法制备了FDPC NCs的类似物(NFDPC NCs)。对比发现,FDPC NCs展现出更好的尺寸均一性、胶体稳定性和TME响应药物释放性能。同时,FDPC NCs还具有良好的光热性能、GSH触发的动态T₂/T₁ MR成像性能和羟基自由基(·OH)生成能力。
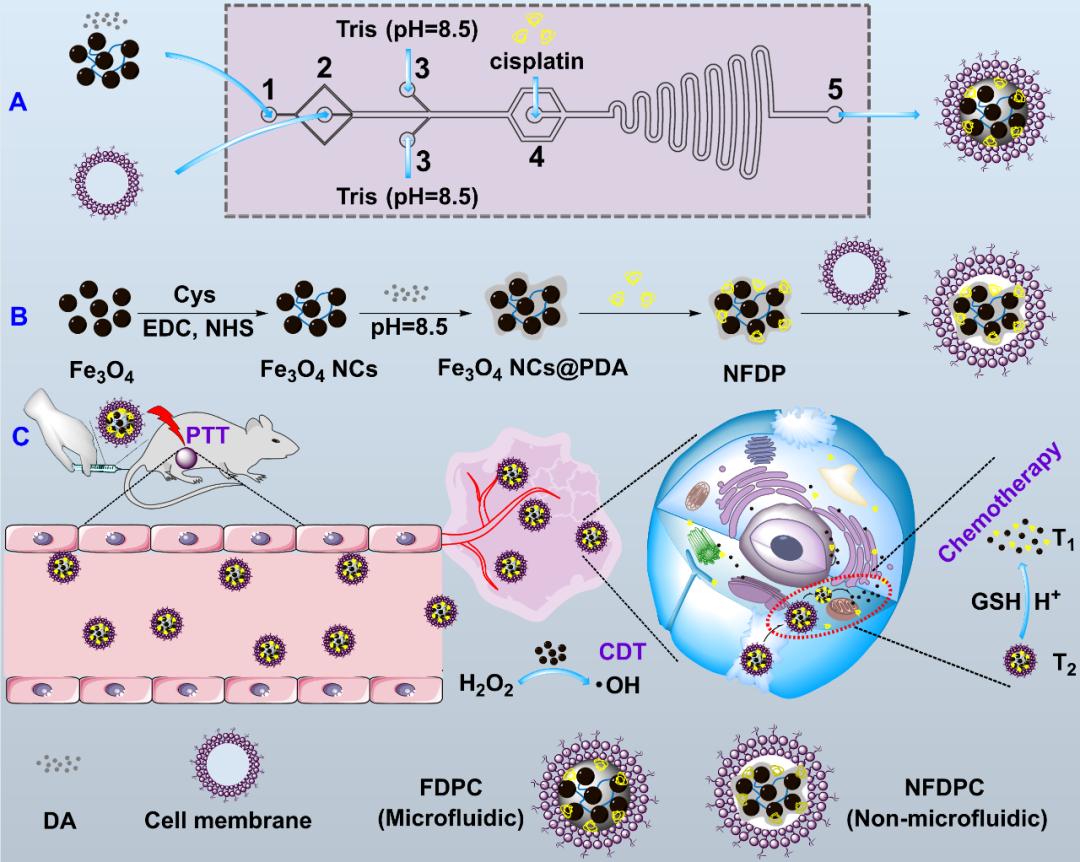
图1 (A)FDPC的微流控制备;(B)NFDPC的非微流控制备;(C)用于动态T₂/T₁ MR成像导引的肿瘤光热-化学-化学动力学三模态联合治疗的示意图。 研究结果表明,相比于NFDPC NCs,由于良好的尺寸均一性,FDPC NCs的癌细胞摄取量更高,从而抗肿瘤效果更明显。
一方面,在近红外光照下,由于光热治疗-化疗-化学动力学治疗联合治疗的优势,FDPC NCs表现出良好的抗肿瘤活性;另一方面,由于TME响应的特异性药物释放,FDPC NCs对正常L929细胞的毒副作用几乎可以忽略。同时,FDPC NCs具有良好的TME调控能力(图2),一方面,二硫键的断裂能够消耗癌细胞内的GSH,降低癌细胞的抗氧化能力,有助于使癌细胞对药物和活性氧(ROS)敏感;另一方面通过超小铁介导的芬顿反应生成ROS,进一步消耗GSH和促进脂质过氧化物的积累,诱导癌细胞凋亡。
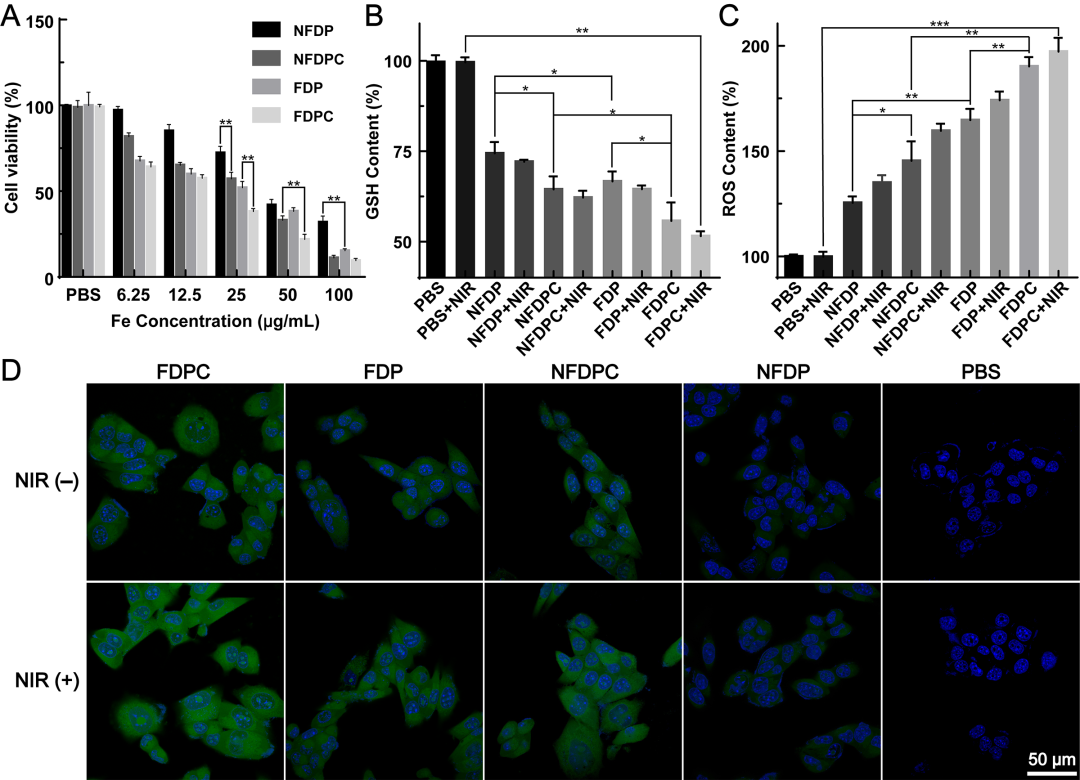
图2 (A)不同材料处理的细胞活力检测结果;(B)不同方式处理后细胞内GSH水平变化情况;(C-D)不同方式处理后细胞内ROS水平变化情况。 随后,研究团队研究了FDPC NCs在小鼠乳腺癌4T1皮下瘤模型中的动态T2/T1 MR成像性能以及热成像性能。
结果表明,该材料能够在肿瘤部位聚集,并且具有良好的动态T₂/T₁ MR成像和热成像效果(图3)。抗肿瘤活性结果表明,在近红外光照下,FDPC NCs处理的小鼠肿瘤体积最小,相应的肿瘤切片中凋亡和坏死的癌细胞最多,即表现出最强的肿瘤抑制效果。
从治疗过程中小鼠体重变化和治疗结束后小鼠主要脏器的HE切片中,可以发现FDPC NCs的毒副作用几乎可以忽略,而单独化疗药顺铂则表现出较强的毒副作用。另外,从肝脏的HE切片中可以观察到,FDPC NCs的治疗明显抑制了4T1癌细胞的肝转移(图4)。
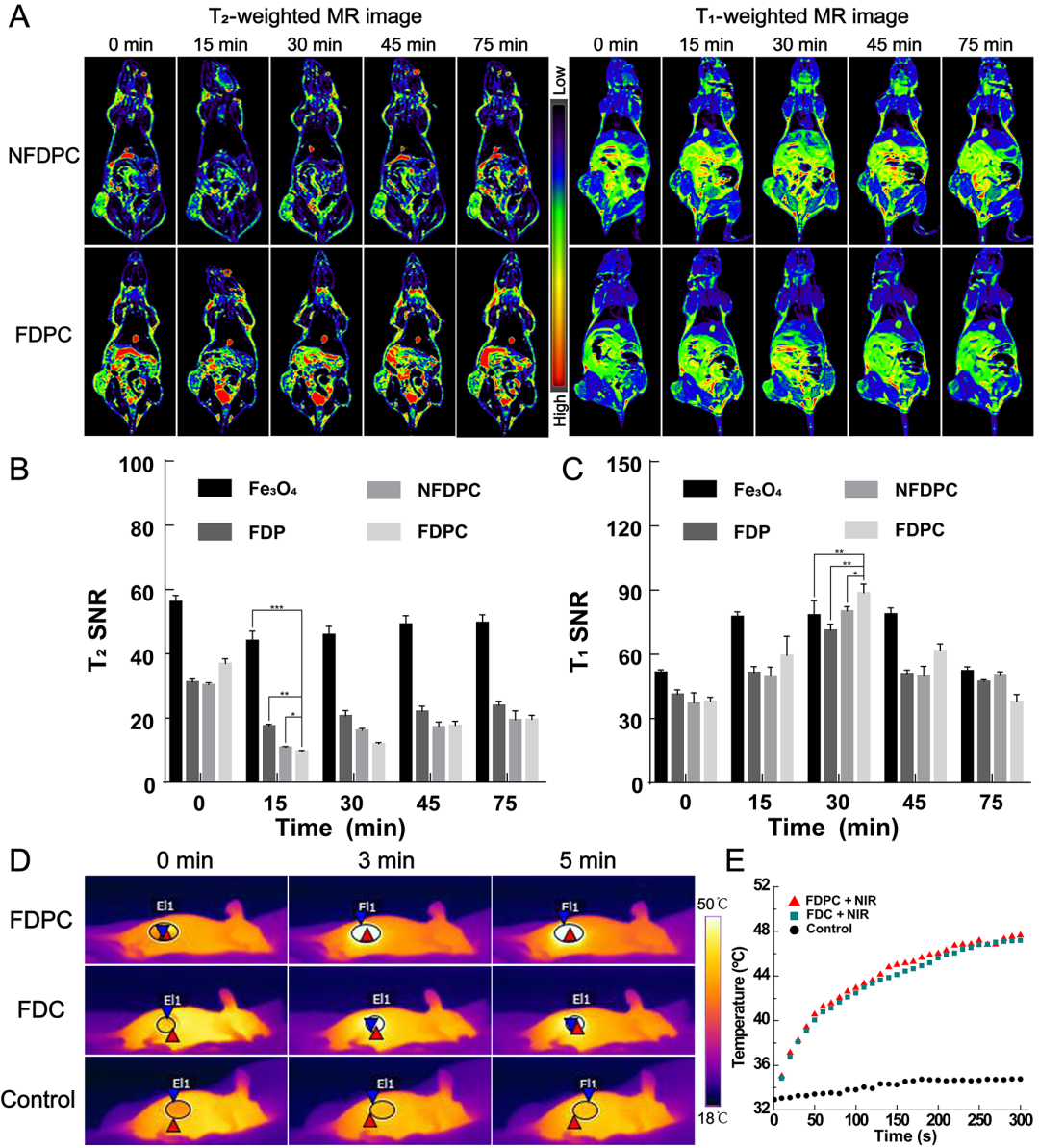
图3 (A)尾静脉注射不同材料后小鼠体内动态T₂/T₁ MR成像;(B-C)尾静脉注射不同材料后肿瘤部位T₂和T₁ MR信噪比;(D-E)尾静脉注射不同材料后小鼠体内热成像及对应肿瘤部位温度变化。
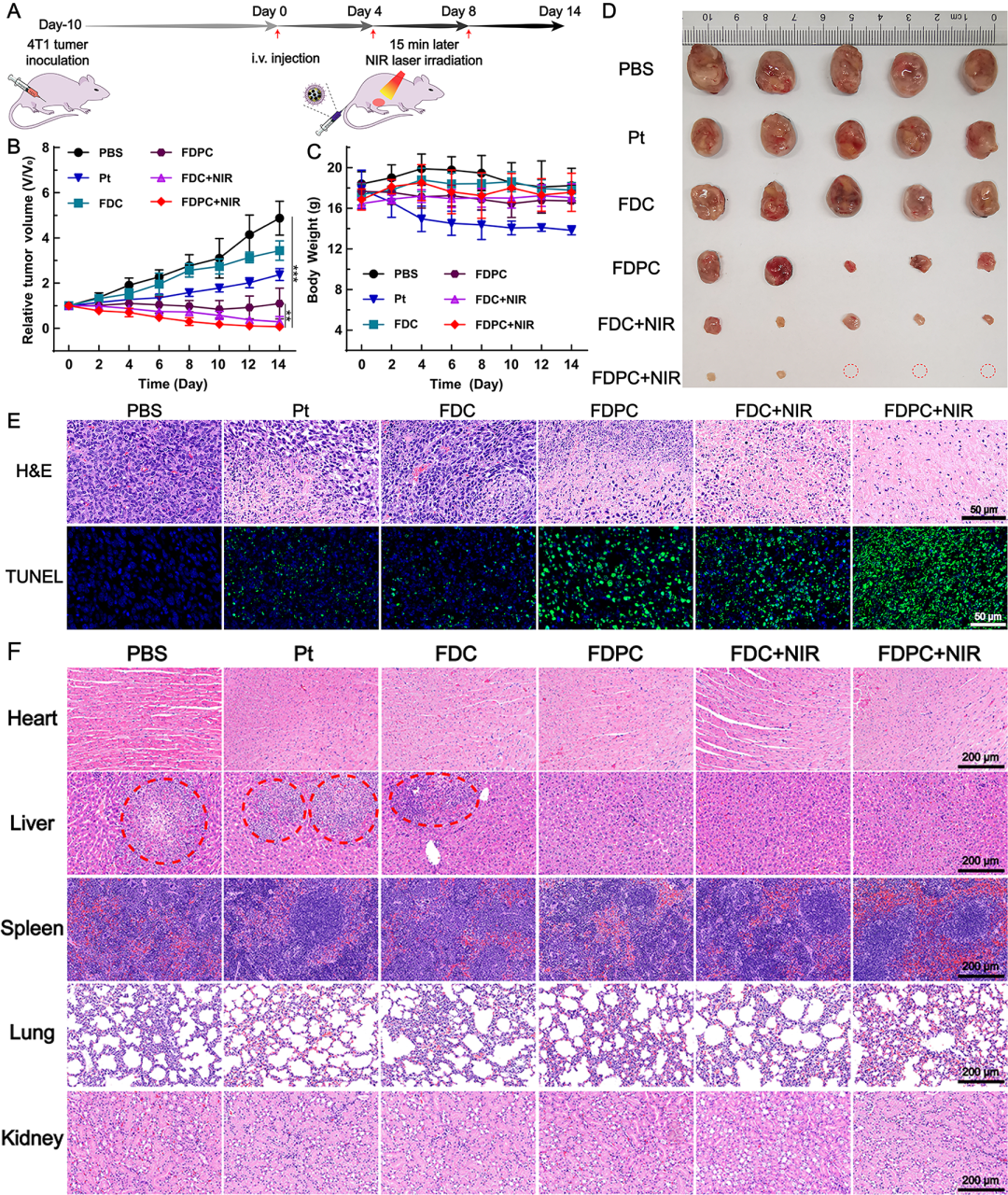
图4 (A)小鼠体内治疗过程示意图;(B-C)治疗14天内小鼠肿瘤体积及体重变化曲线;(D)治疗第14天肿瘤照片;(E)治疗第14天肿瘤切片的HE和TUNEL染色结果;(F)治疗第14天主要脏器切片的HE染色结果。 简言之,该研究设计的FDPC纳米平台的主要优势在于以下几个方面:
1)与传统湿化学方法制备的类似物相比,基于微流控的方法制备的FDPC纳米平台具有更好的均一性、胶体稳定性和TME刺激药物释放性能;
2)通过二硫键的断裂消耗GSH和基于超小铁介导的ROS生成,调控肿瘤微环境,降低癌细胞的抗氧化能力,促使癌细胞对药物和ROS敏感,减少毒副作用;
3)FDPC纳米平台具有良好的同源靶向性能、光热性能和GSH响应的MR成像性能,可用于靶向肿瘤GSH响应的动态T₂/T₁ MR成像和联合治疗。
审核编辑:刘清
-
THS4631DGNR是否可以用在磁共振成像设备中?2024-09-24 278
-
EIP在磁共振成像系统中的应用2009-11-30 4241
-
飞利浦发布全球首台全数字磁共振 Ingenia2012-12-29 3728
-
核磁计算机系统包括,核磁共振和CAT扫描系统 精选资料分享2021-09-13 1723
-
磁共振成像(MRI)系统2010-09-03 2534
-
EIP在核磁共振成像系统中的应用2011-04-09 1422
-
ARBOR在核磁共振成像仪中的应用2012-12-02 3701
-
磁共振对人体有害吗_磁共振对孕妇有影响吗2017-10-31 28109
-
磁共振成像仪梯度模块的设计2017-11-14 1185
-
用于核磁共振成像系统的振荡器分析2018-05-31 2529
-
磁共振成像技术的发展历程2019-07-07 12429
-
医疗电子领域中,磁共振成像是必不可少的环节2020-06-11 1489
-
磁共振adc值代表什么2023-09-07 6435
-
深入浅出带你了解磁共振成像(MRI)基本原理2024-04-03 3367
-
磁共振检查常用线圈及分类方法2024-08-21 7748
全部0条评论

快来发表一下你的评论吧 !

