

基于微冲击波实现给药的微系统应用研究
描述
植入式药物输送(给药)微系统能够通过最大限度地提高局部药物功效和减少潜在的副作用来满足局部治疗要求。包括食道、胃肠道和呼吸道在内的人体内部器官,其轮廓会出现不规则折叠状,病变部位常位于弯曲或曲折的区域。目前的治疗方法对这些器官进行局部给药的能力有限。如果将药物喷洒到这些区域,并利用药物粉末的粘附性和吸水性附着到病变区域,可以提供有效的治疗。
据麦姆斯咨询报道,近日,北京理工大学研究人员开发了一种基于微冲击波实现给药的微系统,并对其应用进行了研究。该微系统装置包括一个可将粉末放置在头部的弹头状外壳,一个可插入尾部的柔性杆。该微系统能够将药物沉积在人体器官弯曲或曲折区域的粘膜上,研究人员通过数值模拟分析了其在给药过程中的爆炸冲击特性。在猪肠给药实验中,研究人员描述了该微系统的生物安全性和给药能力。他们预计,该微系统可以应用于人体弯曲或曲折区域的一系列腔内疾病,同时最大限度地发挥药物的靶向治疗作用。
高掺杂半导体桥用于高能器件,该器件在至少1A的脉冲电流时,可在短时间内产生高能量,并将能量应用到含能材料叠氮化铜Cu(N₃)₂上。叠氮化铜受热发生化学反应,然后爆炸产生冲击波。该冲击波使微系统装置头部的粉末被喷入人体的病理区域。在冲击波的作用下,透明罩内药粉的最大动能为3.2 × 10⁻⁴J、最高速度达到60 m/s。此外,因为系统内部的结构设计,微爆冲击波主要沿轴向传播,径向振动极小。在管状外壳中设置聚二甲基硅氧烷(PDMS)薄膜,以便爆炸产生的铜化合物被截留在壳体中,不会随药粉进入人体。该微系统的总运行时间只有几百微秒。因此,产生的热量可以忽略不计,因为装置本身不会加热。研究人员设计了系统和各个模块,包括含能材料叠氮化铜和作为含能器件的半导体电桥。
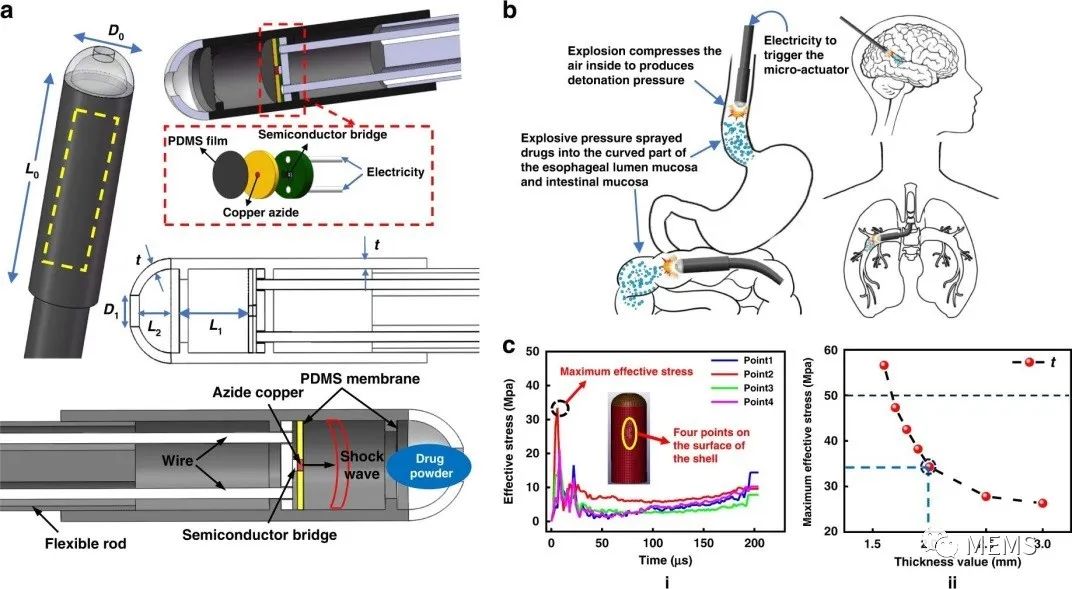
基于微爆炸冲击波的给药微系统概述和数值表征
然后,研究人员对几何特征参数对微爆炸冲击波给药的影响,以及系统和各模块的加工装配进行了动态模拟评估。最后,在猪肠内进行了实验测试,并对结果进行了分析,验证了基于微爆冲击波的给药微系统的生物安全性和给药能力。
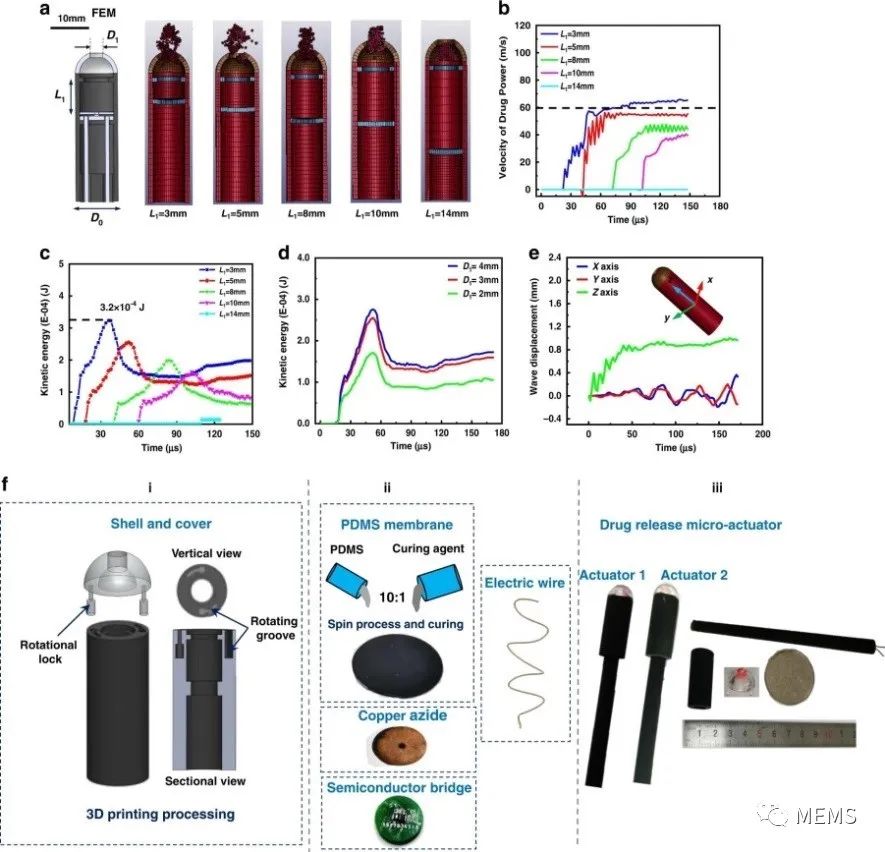
基于微爆炸冲击波的给药特性
研究人员利用猪肠进行给药实验,以评估基于微爆炸冲击波的给药微系统的可行性和生物安全性。猪肠被对折形成一定弧度的曲线,他们用记号笔在猪肠弯曲部分做了标记。弯曲部分如下图a-i所示。研究人员的目标是通过冲击波喷射将药粉送到标记区域。他们用红色粉笔粉突出实验效果。该装置被插入猪的肠道,透明罩的顶部与其中一个标记对齐,在整个实验过程中,猪的肠道始终处于弯曲状态。实验开始时外部电源为5 V。研究人员针对两种不同L1值(含义见上图a)的微系统装置,进行了四组实验。试验结束后,他们沿轴向切开猪肠。结果如下图a-ii所示。红色粉笔粉末被喷入肠道,覆盖了局部60%的区域,证明了设计的可行性。如图a-iii所示,当微系统装置的L1值较小时,喷洒在猪肠上的粉末面积较大,相比之下颜色较深。这是因为此时冲击波更强。
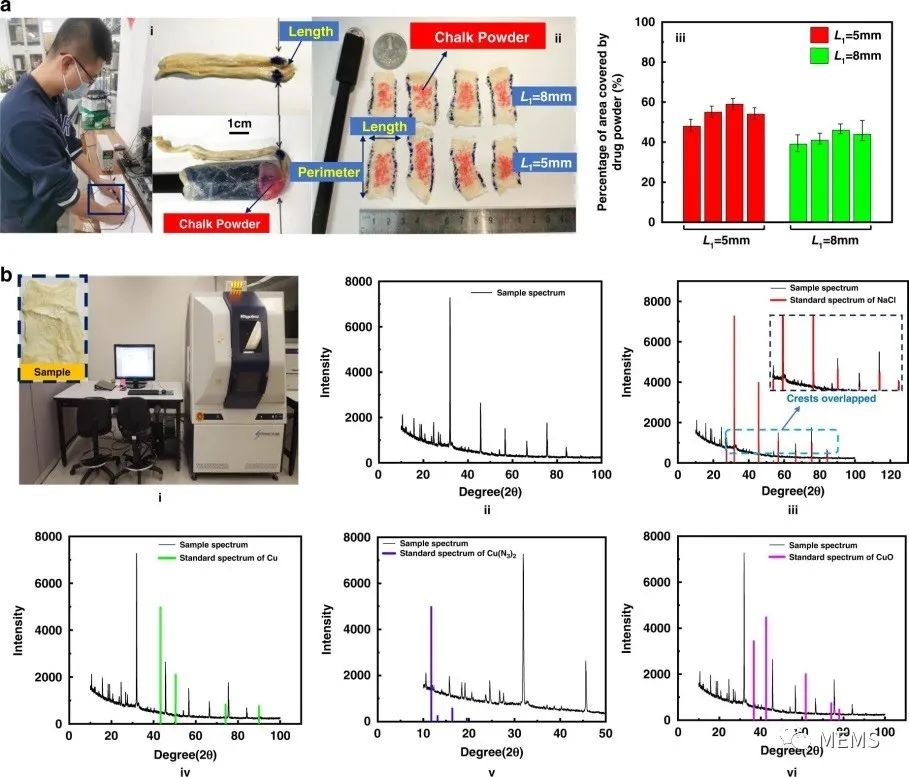
猪肠给药实验验证了给药微系统设计的可行性和生物安全性
由于叠氮化铜在爆炸后产生铜和氮,铜会导致人体重金属中毒。因此,研究人员在猪肠中进行了生物安全性实验,使用盐作为药粉。实验完成后,他们干燥样品,并在多功能X射线衍射仪(日本Rigaku SmartLab)下进行相位检测,如上图b所示。图b-ii为扫描后的样品光谱,将样品光谱与待检测成分的标准光谱进行了比较。样品光谱的峰值强度与氯化钠(NaCl)的标准光谱完全一致,这证明样品中含有给药微系统喷射的粉末,如上图b-iii所示。研究人员观察到,样品光谱在铜、叠氮化铜和氧化铜(CuO)的标准光谱处没有峰值强度,这证明该药粉未将铜、叠氮化铜和氧化铜携带进猪肠内。
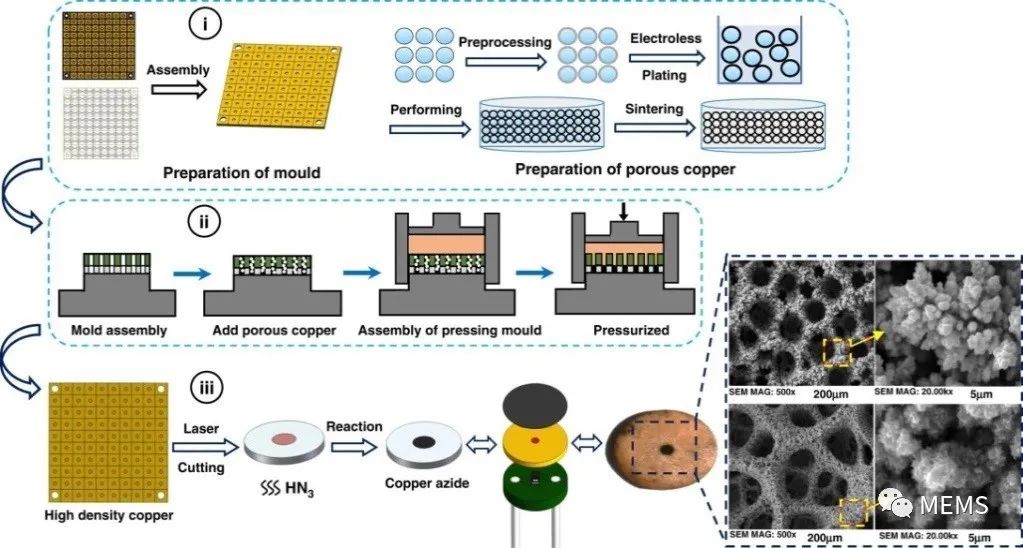
叠氮化铜的制备工艺
综上所述,鉴于植入式靶向治疗疾病的公认能力,研究人员开发了一种新型生物医学微系统装置。爆炸冲击波不仅能将药粉喷射到身体的管状区域,更重要的是,将药粉输送到胃肠道、大脑、气管和身体其它器官中难以触及的弯曲或曲折区域。利用药物粘附和吸水性将药物粘附在病灶上,提供了有效的精准治疗。该研究对基于微爆冲击波的给药微系统进行了总体设计。采用有限元模拟与实验相结合的方法,评估管状壳形、透明罩、半导体桥等模块的特征参数,并分析特征参数对冲击波给药的影响。最后,选择最佳参数对微系统各模块进行加工。更重要的是,研究人员在实验中证明了该微系统的靶向给药能力,药物最大覆盖面积达到局部面积60%以上,该系统无毒,无伴随损伤。此外,该给药微系统可以根据人体腔的大小匹配不同的结构尺寸,并应用于治疗体内难以触及的一系列病灶。
审核编辑:郭婷
-
磁性明胶载药微球的制备及体外释药研究2009-04-26 962
-
冲击波测量用压力传感器准静态校准方法2009-06-30 811
-
基于Nios_的动爆冲击波记录仪设计_刘雪飞2017-01-30 827
-
激光冲击波力学效应与纯钛模型建立与冲击加载方法的研究2017-09-30 987
-
脉冲激光技术在温密物质和冲击波实验研究中的应用2017-11-10 1032
-
无线传感网络在冲击波场中的应用案例2018-04-28 856
-
骨科冲击波治疗仪设计完善了仪器的配置,提高了实用性能2021-05-17 1136
-
多通道存储式抗道内冲击波测试系统2021-06-22 600
-
骨科冲击波治疗仪的设计特点是什么2021-07-21 1150
-
WiFi红外线冲击波开源分享2022-11-21 663
-
用于透皮给药的空心微针阵列实现糖尿病患者的自动化给药2023-03-25 3876
-
电压冲击波开源分享2023-06-07 685
-
利用微针机器人实现结肠给药的快速自定位和抗蠕动粘附2023-07-03 1441
-
可溶解微针在生物医学中的应用研究进展2023-12-09 4117
-
基于葡萄糖响应性微针的胰岛素透皮给药系统研究进展2024-02-27 3521
全部0条评论

快来发表一下你的评论吧 !

