

基于SCNL的方法用于特异性结合和检测表面过表达SA分子的癌细胞
描述
循环肿瘤细胞(CTCs)是肿瘤诊断和监测的重要生物标志物。然而,因为它们的稀有性,CTCs的检测仍然具有挑战性,大多数的检测方法都因CTCs在预富集步骤的丢失和缺乏捕获不同类型癌细胞的通用抗体而受到限制。目前,CTCs分析通常基于两步工作流程,包括CTCs富集和CTCs检测。在富集过程中,血液中的CTCs可通过物理性质或者生化性质被捕获。细胞的物理性质如大小、电荷或弹性可被用于富集CTCs。物理富集方法虽然有效,但往往复杂,并且不能避免CTCs的丢失。此外,物理富集过程中处理时间长、液体流速高也可能破坏细胞膜的完整性,影响CTCs的下游分析。另一方面,生物化学方法可以通过靶向肿瘤特异性标记物的抗体,例如细胞角蛋白(CK)、上皮细胞粘附分子(EpCAM)、表皮生长因子受体(EGFR)、人表皮生长因子受体-2(HER-2)等,直接分离和检测CTCs。然而,由于癌细胞的异质性,其表面缺乏通用抗原,大多数基于免疫亲和性的方法仅限于特定的癌症类型或亚型,特别是转移相关的间质型CTCs,很难被常用抗体检测到。因此,需要迫切开发出适用于广谱癌症类型和亚型的高敏感和特异性的CTCs检测方法,以适应CTCs的临床应用。
据麦姆斯咨询报道,近期,香港城市大学杨梦甦教授课题组联合深圳湾实验室崔淼博士报道了一种包含动态配体的双重刺激响应单链纳米锁(SCNL)聚合物探针,它具有高灵敏度和选择性,可以与过表达唾液酸(SA)的广谱肿瘤细胞和CTCs结合。这种高灵敏度是通过聚合物的单链结构和多价功能基团实现的,提高了靶细胞与SCNL之间相互作用的可及性和结合稳定性。肿瘤细胞的靶向高选择性是通过动态和双重刺激响应的纳米锁结构实现的,它可以在同时暴露于过表达的SA和肿瘤酸性微环境中解锁并功能化。除了用于CTCs计数,SCNL方法还可以通过监测肿瘤细胞表面SA的表达水平,来实现针对肿瘤细胞转移能力的评估。
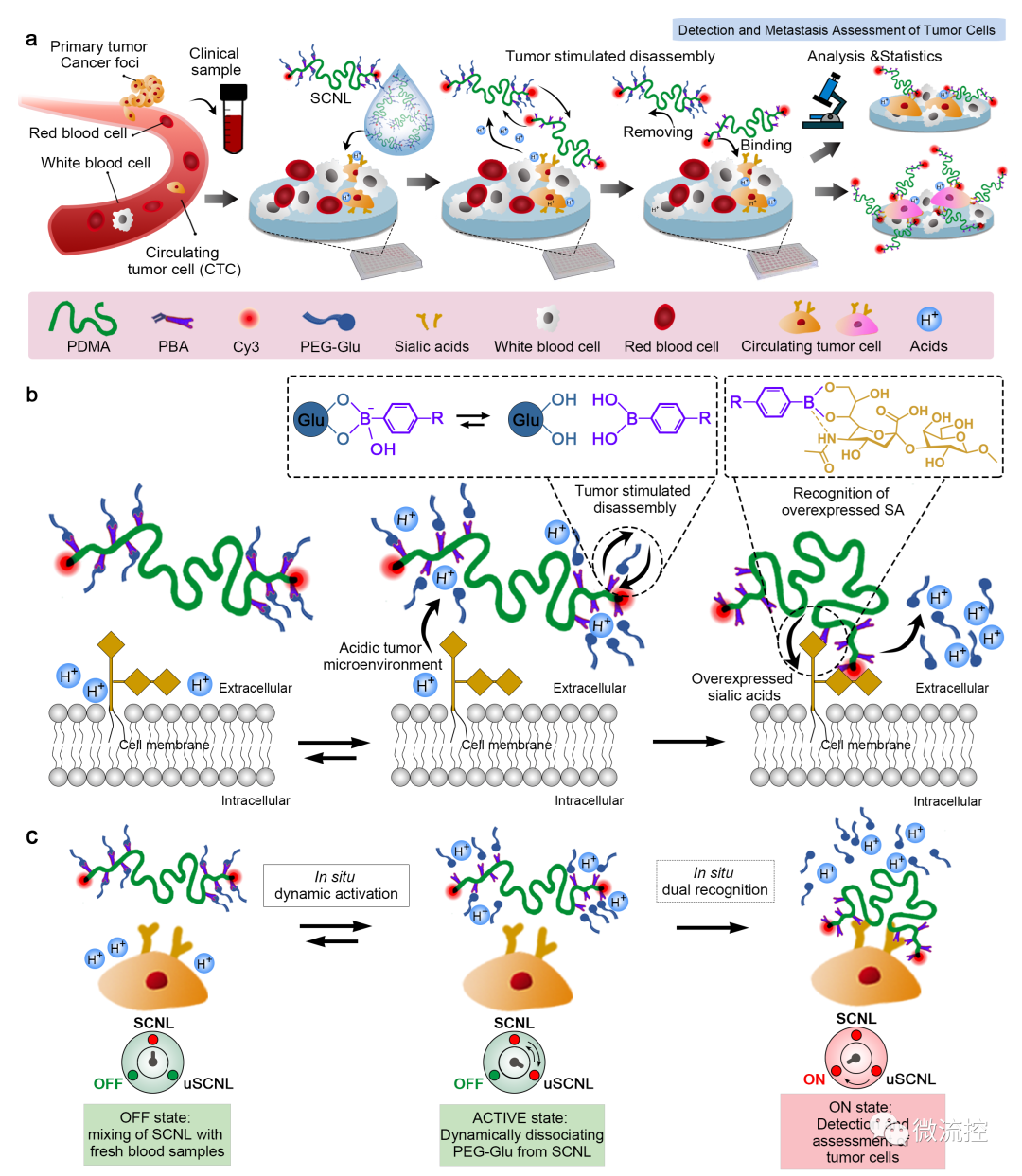
功能化单链纳米锁(SCNL)直接检测肿瘤细胞和评估癌症转移的原理示意图(来源:Biosens. Bioelectron.)
具体来看,这项研究采用动态结合策略,设计了一种具有锁结构的功能化单链纳米探针,可在酸性微环境及过量表达的唾液酸(SA)双重刺激下动态打开并与肿瘤细胞相结合。当SCNL遇到肿瘤细胞时,肿瘤细胞周围的酸性微环境会刺激嵌段单链聚合物(block single chain polymer)与PEG-Glu保护基团之间的预结合解离,因此保证了SCNL对肿瘤细胞的检测特异性。在酸性微环境下解锁后,由于SCNL上的苯硼酸官能团(PBA)可与SA同时形成共价键和配位键,与葡萄糖相比,解锁后的SCNL(uSCNL)会主要与肿瘤细胞表面过表达的SA分子结合。此外,保护基团上的PEG片段也有助于减少单核吞噬细胞对SCNL的识别和吸收,从而进一步提高了肿瘤细胞检测的特异性。综上,柔软的单链锁结构有利于SCNL对肿瘤细胞的逐步协同识别。这种单链层面上的分级识别进一步保证了SCNL与CTCs之间的结合效率和准确性。
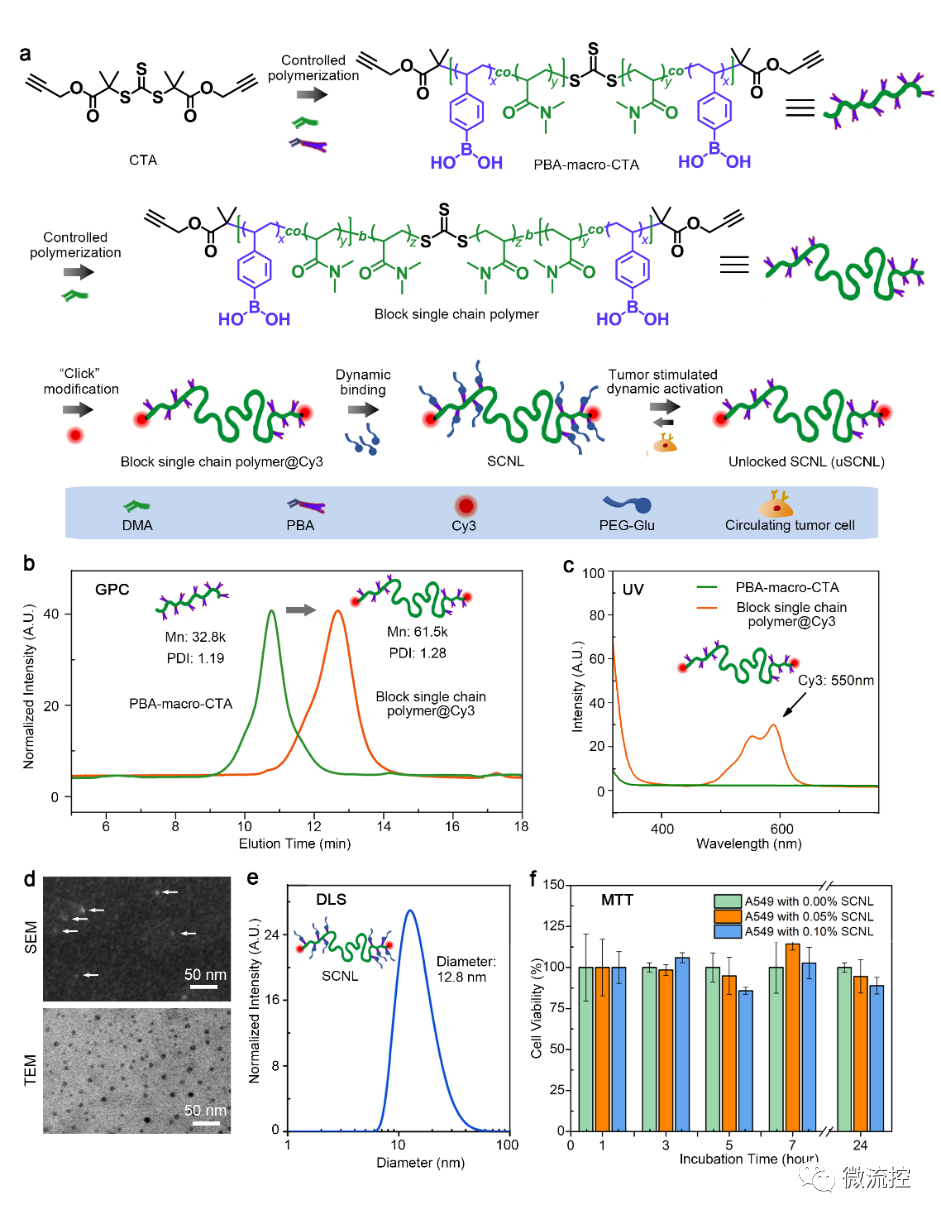
功能化单链纳米锁(SCNL)的制备与表征
(来源:Biosens. Bioelectron.)
本项研究以S,S ‘-双(ɑ’ɑ‘-二甲基-ɑ“-醋酸丙炔基)三硫代碳酸酯(BDPT)为对称链转移剂(CTA),通过催化可逆加成断裂链转移(RAFT)聚合反应生成ABA型嵌段单链聚合物。首先将N,N-二甲基丙烯酰胺(DMA)与丙烯酸-苯基硼酸(acrylate-PBA)共聚形成PBA-大分子CTA(PBA-macro-CTA)作为第一个A嵌段。A嵌段中的共聚丙烯酸酯-PBA促进了单个聚合物链上多价PBA官能团的形成,与使用单价PBA修饰方法相比,可以显著提高单链纳米凝胶探针与癌细胞的结合亲和性。在第二步B嵌段的聚合中,DMA被引入做为单体并进行聚合,为两端链尾端带有PBA官能团的A嵌段增加一个柔软灵活的连接部分。中间polyDMA嵌段的灵活性可以有效地促进功能性PBA基团向癌细胞表面的唾液酸(SA)基团呈递,最终促成癌细胞与嵌段单链聚合物的结合。以上得到的嵌段单链聚合物会继续用Cyanine 3(Cy3)荧光基团进行标记,并与聚乙二醇修饰的葡萄糖保护基团结合形成最终的工作探针SCNL。工作探针SCNL的制备过程,结构和性质是通过凝胶渗透色谱、紫外吸收光谱、核磁共振(1H NMR)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、动态光散射(DLS)及细胞毒性实验(MTT)来进行验证的。
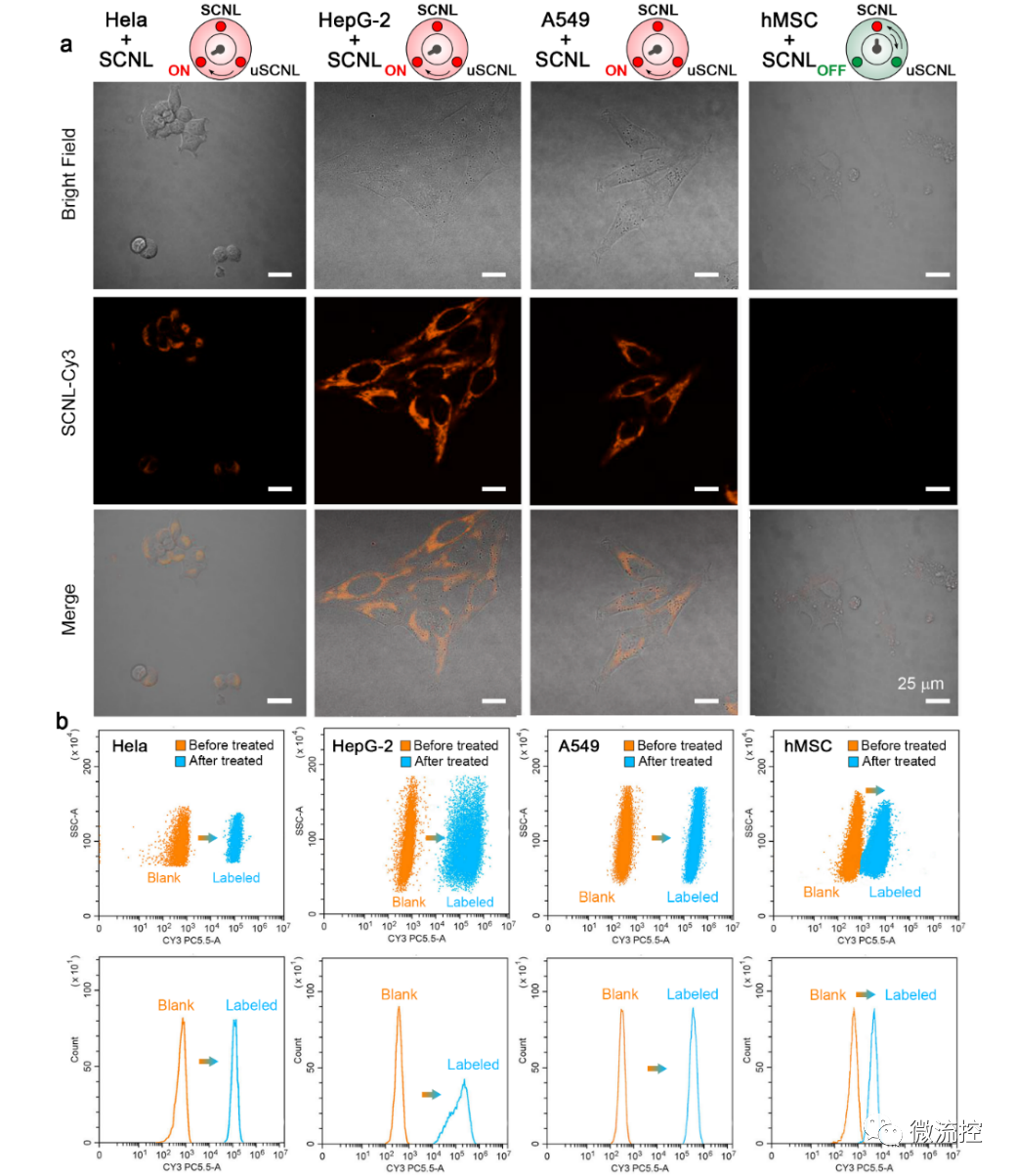
功能化单链纳米锁(SCNL)用于检测不同类型的肿瘤细胞(来源:Biosens. Bioelectron.)
研究首先使用Cy3标记的SCNL来鉴别不同SA表达水平的Hela细胞、HepG-2细胞和A549细胞与正常对照细胞间的信号差异。从共聚焦激光扫描显微镜(CLSM)的结果来看,三种癌细胞经SCNL探针孵育后,细胞膜上的荧光强度均显著增加。SCNL孵育后的Hela细胞信号的显著增加表明,与之前报道的其他基于PBA的探针相比,SCNL探针具有更高的灵敏度和标记效率。此外,研究继续利用流式细胞术和荧光显微镜技术证实了SCNL探针对Hela、HepG-2、A549、H1299、H4006、MDA-MB-231和MCF-7细胞系的靶向能力,进一步验证了SCNL检测不同类型肿瘤的普遍适用性。
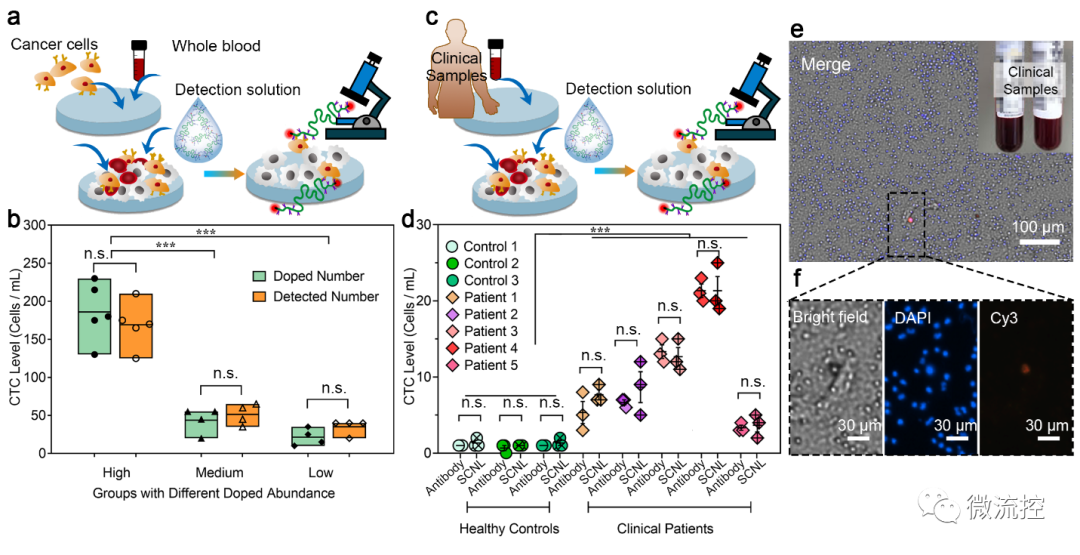
功能化单链纳米锁(SCNL)用于检测模拟样本和临床样品中的CTCs(来源:Biosens. Bioelectron.)
而后,研究进一步将该方法应用于3例健康人和5例非小细胞肺癌患者的临床样本CTCs检测中。其中,健康人群的血液样本中只检测到极低的CTCs水平(《3 CTCs/mL)。但所有5例患者的样本均检测到具有显著个数的CTCs,这证实了SCNL探针的样本高检出率。为了进一步验证检测方法的准确性,研究将同一个人的血液样本中基于SCNL的CTCs的检测结果与基于EpCAM抗体和CD-45抗体的免疫荧光染色方法的检测结果进行了比较。抗体法和SCNL探针法检测到的CTCs数量水平相似,验证了SCNL探针在CTCs临床样本检测中的准确性和适用性。
综上所述,该研究开发了一种基于SCNL的方法,用于特异性结合和检测表面过表达SA分子的癌细胞。通过识别癌细胞周围的酸性微环境和癌细胞表面过表达的SA分子,动态PEG-Glu保护基团和PBA-SA识别机制保证了SCNL探针对癌细胞的特异性靶向作用。其设计原理和结合机制使功能化SCNL探针对CTCs具有较高的检出率。由于SCNL探针在癌细胞表面具有较高的稳定性、灵活性和标记密度,对于SA表达相对较低的Hela细胞,SCNL方法也表现出较高的敏感性和选择性。同时,SCNL探针还显示出对癌细胞转移风险进行评估的潜能来预测肿瘤的恶性程度。该方法可与微流控技术相结合,实现高通量和床旁检测,以满足精准医疗的要求。此外,这项工作还可能激发新一代单链纳米探针的开发,用于如癌症转移和其他糖蛋白相关疾病的临床检测。
-
白介素ELISA检测试剂盒信息2014-09-02 3135
-
BIAcore-生物分子相互作用分析仪原理和操作注意事项2011-02-08 2907
-
研究团队发现石墨烯一重要作用:可分辨普通细胞与癌细胞2016-12-28 1010
-
WLCSP封装在机械性能方面的特异性2017-08-17 13071
-
新型追踪筛查系统有望靶向杀灭肿瘤细胞2018-11-14 3703
-
CTC的富集和分析方法2018-12-12 20196
-
应用转基因检测试剂盒时需要注意的事项有哪些2020-10-28 1012
-
细菌检测仪的检测原理2021-05-21 2297
-
表面洁净度检测仪的特性及参数2021-09-29 840
-
表面洁净度检测仪的应用、特性及参数2021-10-11 685
-
射频功率放大器在超声实现离体肿瘤细胞研究的应用2023-04-27 1140
-
用于单分子无标记定量检测的数字胶体增强拉曼光谱技术2024-04-22 1581
-
ATA-320功率放大器在免疫磁珠法分离细胞实验中的应用2024-09-25 1378
全部0条评论

快来发表一下你的评论吧 !

