

BM-NSCLC细胞与脑肿瘤微环境(BTME)之间的微妙联系
描述
非小细胞肺癌(NSCLC)脑转移患者具有存活率低和发病率高的特点。虽然肿瘤脑转移(BM)的诊断技术和治疗策略不断进步,但由于大脑本身具有不同于其他器官的独特特征,使得BM-NSCLC细胞与脑肿瘤微环境(BTME)之间的微妙联系仍有待研究。星形胶质细胞和脑特异性内皮细胞(BECS)是BTME的两个主要组成部分,BM-NSCLC与两种类型的BTME细胞相互作用,会影响BM-NSCLC的恶性转移,以及耐药性的增加。
鉴于此,为更好的了解BM-NSCLC与BTME之间微妙的关系,韩国国家癌症中心的Lee团队基于星形胶质细胞、BECS和患者来源的BM-NSCLC细胞构建了一种3D微流控装置,该装置为阐明潜在抗癌药物的分子靶点和针对转移的癌细胞与BTME之间的相互影响提供了一种工具。
为了模拟BM-NSCLC与BTME之间的微妙的作用关系,研究人员选用患者来源的肿瘤细胞(BM-ADC,BM-Sqcc)、星形胶质细胞和BECS设计了一种微流控装置,以达到共培养三种细胞的目的。该装置具有四个单元,每个单元具有四个培养基通道(通道#1和#3)和三个水凝胶通道(通道#2和#4)。其中BM-ADC或BM-SqCC引入通道#4,星形胶质细胞引入通道#2,BECS培养在通道#1中。在单独培养BM-NSCLC细胞(BTME-)或与星形胶质细胞和BECS(BTME+)共培养的条件下,保持BM-NSCLC细胞的干性,并通过CD44与CD133证实。共培养7天后,发现BM-NSCLC细胞活力增强。
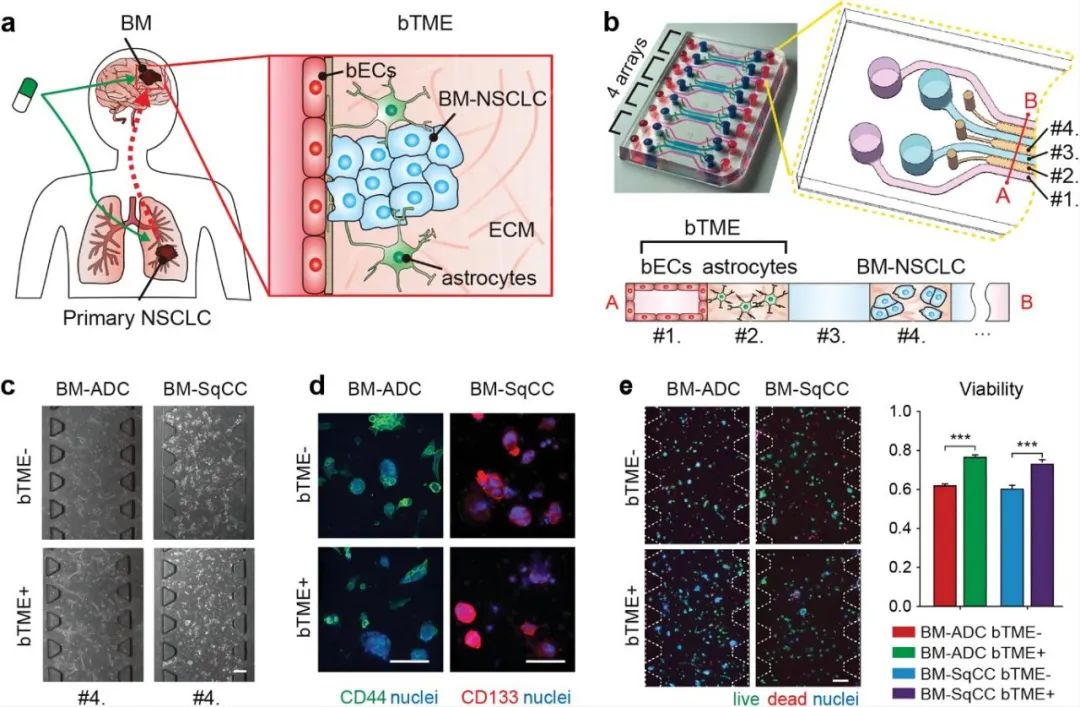
图1 非小细胞肺癌细胞的脑转移生态位示意图及微流控装置
研究人员为更好分析三种细胞之间的相互影响,开发了一种独特的细胞和培养基收集方法,可以选择性地收集各种细胞与培养基。首先收集通道#3的培养基进行细胞因子分析,然后收集通道#1的BECS细胞,接着再分别收集通道#4中的BM-NSCLC细胞和通道#2中的星形胶质细胞。为了只获取通道#4中的BM-NSCLC细胞,首先将胶原酶注射到通道#3中,并控制胶原酶的流动方向,使其仅能将通道#4中水凝胶分解,最后收集通道#2中的星形胶质细胞,该方法的成功率约为80%。
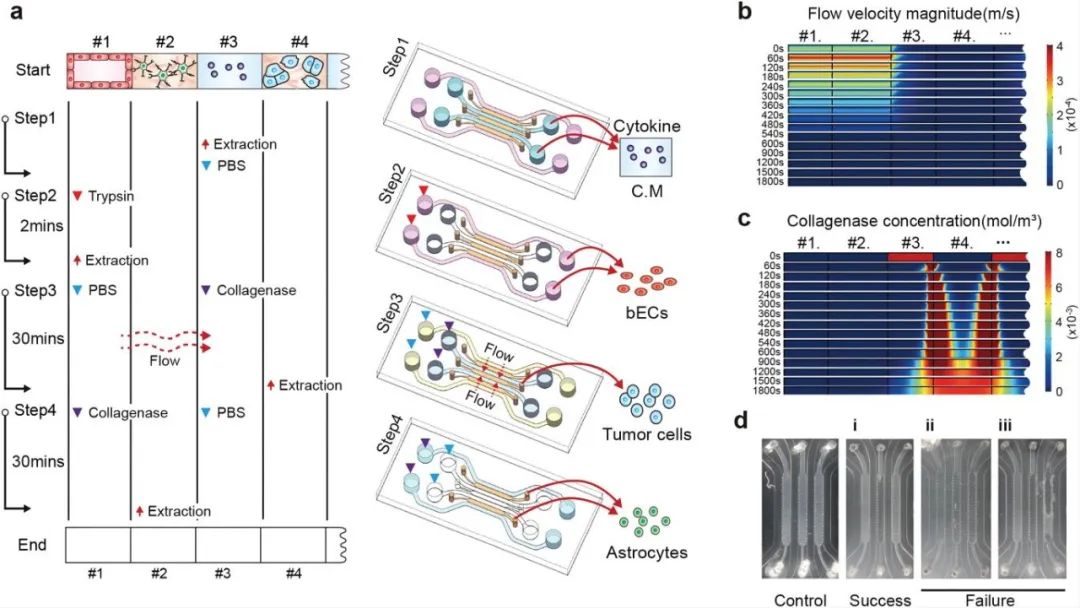
图2 微流控装置中分离提取培养基和细胞的步骤
通过对培养基中三种与患者组的生存率降低有关的细胞因子分析发现,在BTME+状态下,三种细胞因子,即丝蛋白E1(Serpin E1)、白介素8(IL-8)和分泌型磷蛋白1(SPP-1)均增加,Luminex分析证实了这一点。且由于BM-NSCLC细胞的消耗,所有BTME-病例的SPP-1浓度均低于正常对照(神经基础培养液培养)。对Serpin E1的分子扩散进行模拟,发现其从BTME扩散到了BM-NSCLC细胞(通道#4),并且BTME细胞分泌的IL-8也在12h内扩散到了BM-NSCLC细胞(通道#4)。与Transwell模型对比发现,微流控装置中细胞因子的浓度是Transwell模型中的10倍。
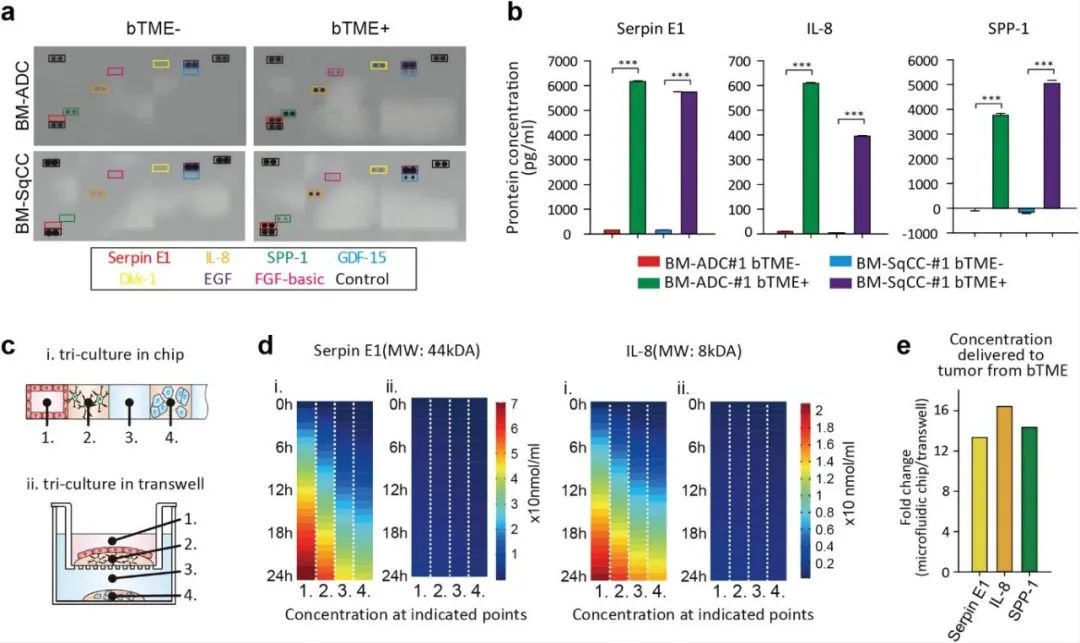
图3 微流控装置中细胞因子水平
研究人员分别对有无BTME的BM-NSCLC细胞、有无BM-NSCLC细胞的BECS细胞和有无BM-NSCLC细胞的星形胶质细胞进行基因分析。发现BTME+BM-NSNLC细胞上调与免疫反应相关的基本分子、激活肿瘤坏死因子信号通路(TNF)和NF-kB转录因子活性等,进一步证实了之前的研究结论,即BTME促进BM。
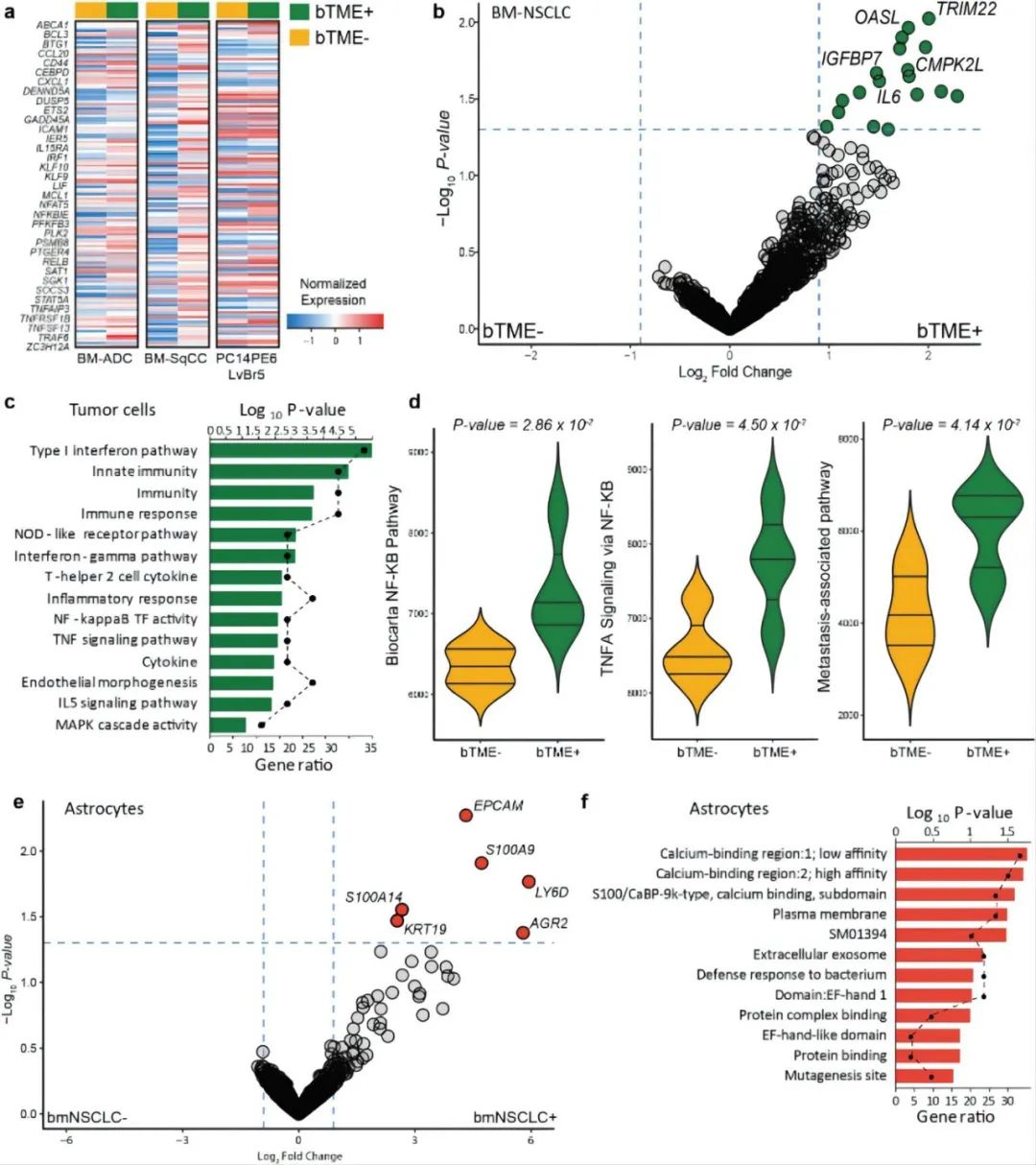
图4 TME中肿瘤细胞转录图谱
研究人员接下来测试了FDA批准的6种临床药物(包括Afatinib、PKI587、Palbociclib、Ceritinib、Dasatinib和Trametinib)治疗BTME-和BTME+BM-NSCLC细胞的效果。根据Cancer SCAN基于5095个临床样本预测了6种药物的使用效果。将预测结果与微流控装置和Transwell中有无BTME的BM-NSCLC细胞的药物筛选结果进行了比较,发现BTME-BM-ADC细胞对Afatinib和PKI587敏感,对Ceritinib、Dasatinib和Trametinib耐药,与预测相反的是对Palbociclib耐药,并且BTME+BM-ADC细胞对Afatinib和PKI587也耐药。根据Cancer SCAN预测结果显示BM-SqCC的遗传性状可能是野生的,且对于BM-SqCC细胞,BTME对细胞存活率有明显的增强作用。然而在Transwell中,培养的BM-NSCLC细胞在筛查结果和预测结果之间也显示出良好的相关性,在Transwell中与BTME共培养时没有观察到显著的药物反应变化。
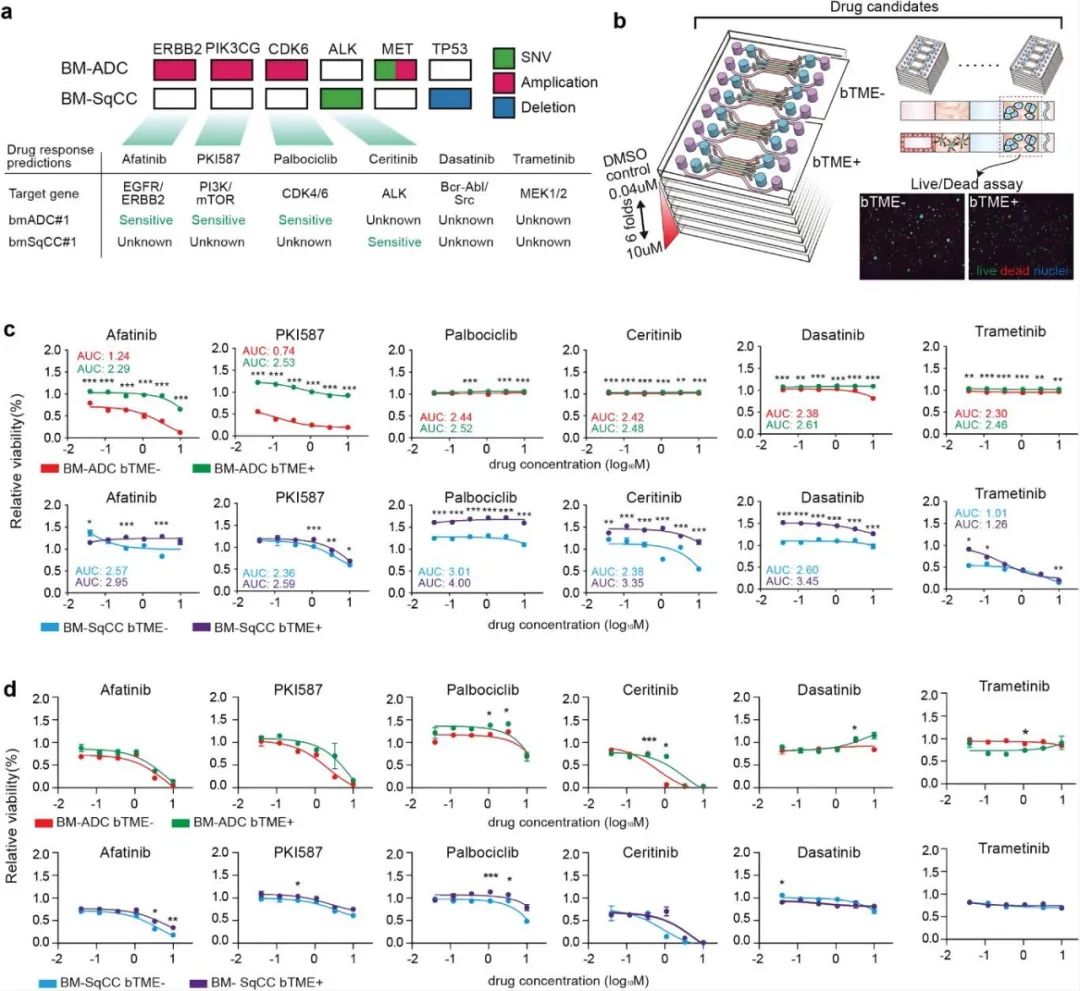
图5 基于微流控装置进行药物筛选
总之,研究人员基于患者来源的肿瘤细胞、星形胶质细胞和BECS构建了一种能够模拟BM-NSCLC复杂BTME的3D微流控装置,并开发一种可以单独收集各种细胞和培养基的方法,以便进行更深入的分子研究。该模型为精准治疗和临床前评估针对转移和耐药肿瘤的全新治疗方案提供了一种潜在的药物筛选模型。
-
用于治疗脑肿瘤和癫痫的新型柔性传感器2022-02-26 941
-
诊治脑肿瘤的希望--AI“虚拟活检”2018-07-11 757
-
T 细胞打入肿瘤细胞要先对好“暗号”2019-06-19 4300
-
牛海涛团队首先利用微流控芯片模拟肿瘤微环境体外建立仿真实验系统2020-07-08 4767
-
研究人员利用微流体技术构建3D肿瘤组织模型2020-10-10 2508
-
基于原子力显微镜的肿瘤转移过程中单细胞及微环境机械特性的探测与表征2021-03-09 2274
-
基于微纳操作机器人的肿瘤转移过程中多尺度机械特性研究综述论文2021-03-11 1998
-
一种基于微流控的微型肿瘤芯片2022-05-19 2264
-
mTORC1高活性的干细胞样状态肿瘤细胞类型分析2022-10-10 2866
-
SLS和IS对肿瘤微环境的潜在不同影响2022-10-11 2121
-
研究者如何研究SLS和IS的肿瘤免疫微环境2022-10-25 2221
-
一种能够模拟BM-NSCLC复杂BTME的3D微流控装置2022-10-27 1034
-
利用微流控芯片高通量收集血液中的循环肿瘤细胞检测癌症2023-07-21 5299
-
利用惯性-磁微流控技术实现恶性肿瘤细胞的快速、高纯度分离2023-10-30 2352
-
如何利用微流控技术制备一种用于脑肿瘤靶向的超小型仿生纳米囊泡呢?2024-01-18 2958
全部0条评论

快来发表一下你的评论吧 !

