

癫痫组织中的免疫微环境为DRE和神经炎症疾病的介入治疗提供指导
描述
编者按
癫痫(复发性无因癫痫)十分常见,但目前对于其发病机制尚不清楚。抗惊厥药物是目前的一线治疗方法,但是三分之一的患者患有药物难治性癫痫(DRE)。目前只有切除性癫痫手术,即切除部分引起癫痫的脑组织,才能提供治愈方法。因此,深入研究癫痫的发病机制是十分重要的。研究者做出假设,不适当的促炎机制可能是人类患者的难治性癫痫(对抗癫痫药物无反应性)的发病机制。通过CITE-seq,揭示手术切除的癫痫病变组织的免疫转录组。本研究揭示了一种促炎微环境,包括小胶质细胞的广泛激活和其他促炎免疫细胞的浸润。通过配体-受体(LR)相互作用分析提供了小胶质细胞和T细胞之间的潜在浸润机制和直接的物理相互作用的证据,从而验证了上述发现。总之,这些数据提供了对癫痫组织中的免疫微环境的理解,并且可能为DRE和一些其他神经炎症疾病的介入治疗提供指导。
1. 定义癫痫患者大脑中的驻留性和浸润性的免疫细胞
为了确定影响癫痫发生的免疫机制,研究者对手术切除的癫痫病灶组织进行了单细胞转录组和表面蛋白测序(CITE-seq)。首先从6个体患者的11个脑组织样本中分离免疫细胞,并使用10x Genomics单细胞平台进行测序,分析了85780个细胞和22968个基因数据。对基因表达水平进行聚类和t-SNE分析,共鉴定26个聚类。接下来进一步利用表面蛋白标记物鉴定集群,结果显示:簇0-7、9-12和14(共13个簇)被鉴定为小胶质细胞(CD45lo),簇8、15-17、19和21(共6个簇)被鉴定为浸润性免疫细胞(CD45hi)。通过单细胞测序分群,能够同时识别大脑中的小胶质细胞、免疫细胞和非免疫细胞,并能够定量谱系特异性表面蛋白和基因表达水平。
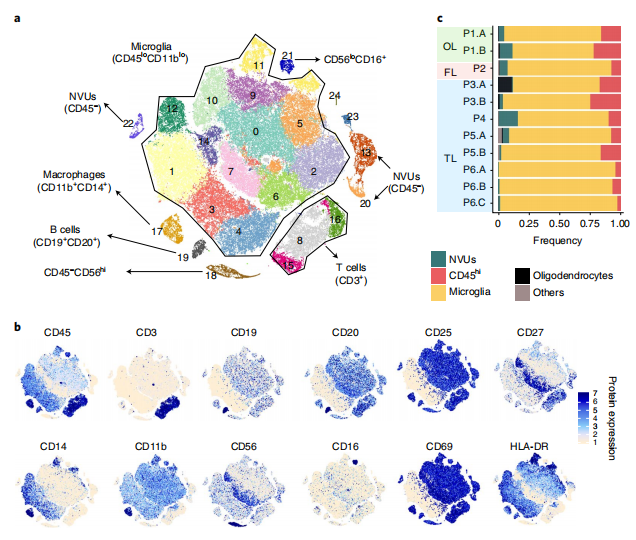
Fig.1 DRE患者脑组织中的小胶质细胞和浸润性免疫细胞
2. 小胶质细胞在DRE组织中表现出促炎表型
接下来,为了研究在DRE组织中的小胶质细胞中是否可以发现炎症通路的激活,研究者分别通过单核细胞测序(snRNA-seq)和scRNA-seq,对来自非神经系统疾病对照组和ASD患者的脑组织、以及来自于在癫痫手术中被病理评估为正常的切除的人类脑皮层组织mRNA的表达进行分析。结果显示,在snRNA-seq和scRNA-seq数据中,来自非神经系统疾病对照组和ASD患者的小胶质细胞都表达了特征性的小胶质细胞标记物。来自DRE患者的小胶质细胞显示了促炎细胞因子和趋化因子基因的表达。然而,在snRNA-seq数据集中,来自非神经系统疾病对照组或ASD的小胶质细胞并没有显示出这些促炎细胞因子和趋化因子的表达。通过比较DRE患者、非神经系统疾病对照组和ASD个体的小胶质细胞基因表达,可以发现DRE小胶质细胞的炎症反应明显升高。研究者通过免疫组化(IHC)成像分析对大脑微环境进行成像,进一步验证了上述发现。
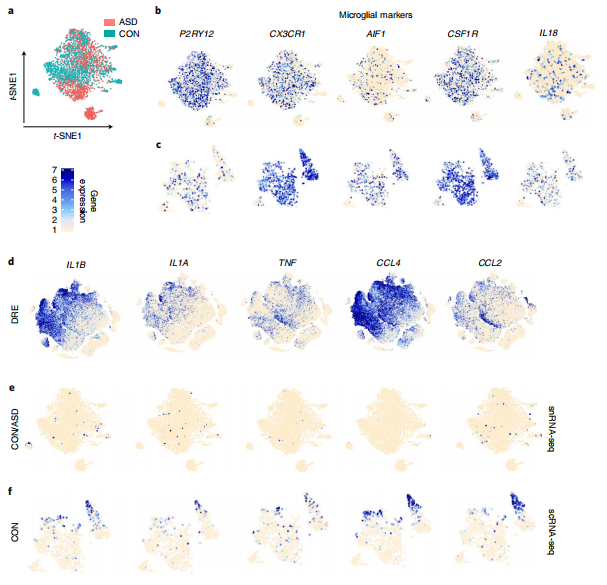
Fig.2 DRE患者、非神经系统疾病对照组和ASD患者脑组织中促炎基因和小胶质细胞特异性基因的表达
3. NVUs与免疫细胞之间的功能性配体-受体相互作用
为了研究来自DRE-M的NVUs与浸润性白细胞之间的相互作用,研究者创建了一个NVUs内的细胞与浸润性免疫细胞之间的配体-受体(LR)相互作用的细胞网络,结果发现节点之间共有809个LR相互作用,其中有265对独特的LR对(有206对出现在NVU和CAM集群之间)。接下来,研究者进一步探讨了这种关系机制,结果发现所有三个CD4+节点均富集了IL7R的表达,编码其同源受体的TSLP在NVUs中富集;TNF、CCL5和TGFB1在免疫细胞簇中表达,而它们的同源受体TNFRSF21、ACKR1和ACRL1在NVUs中表达,并使用CellChat R包进一步验证了它们之间的互作结果。总之,LR相互作用组网络定义了免疫细胞浸润偏向DRE-M的机制。
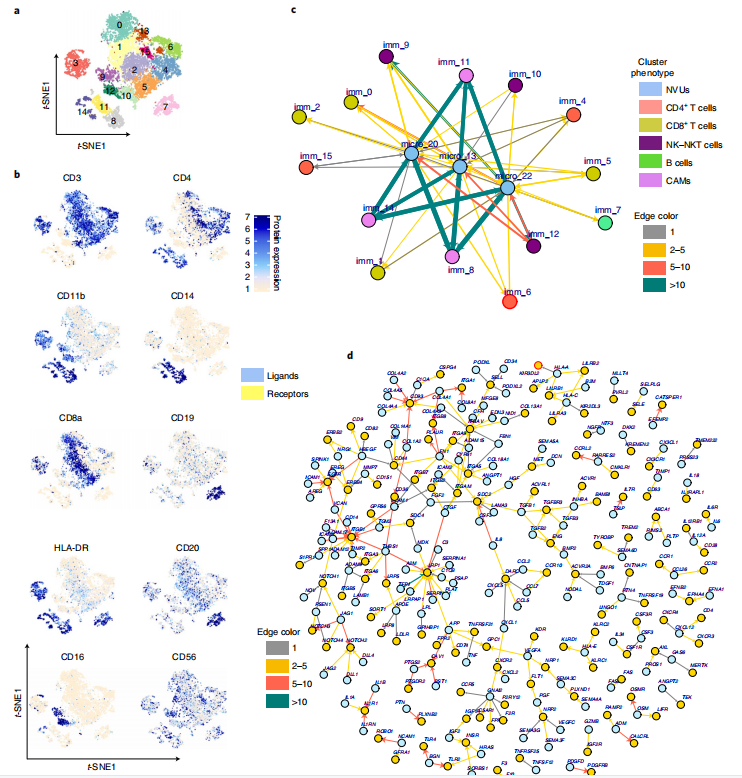
Fig.3 癫痫人脑免疫细胞及其与NVU细胞的相互作用
为了进一步验证上述发现,研究者建立了TLE小鼠模型进行单细胞测序。RNA-seq数据分析发现,与对照组小鼠相比,TLE小鼠中有1600个基因显著改变,有122个LR基因在人类DRE中富集。在这些LR基因中,许多关键的LR对,包括趋化因子和细胞因子及其受体基因在TLE小鼠大脑中上调。总之,动物癫痫模型进一步的证实了人类单细胞测序的数据。

Fig.4 LR基因在TLE癫痫小鼠模型中显著调节
4. 小胶质细胞和T细胞之间的直接相互作用
Cluster 3表达CD3、CD11b和HLA-DR表面蛋白,说明该群是T细胞和小胶质细胞和/或巨噬细胞的双态簇。接下来研究者使用主要谱系蛋白表达标记对Cluster 3进行重新聚类,进一步分析了这些双态簇的成分。结果共获得6个cluster,包括CD8+ T细胞群(Cluster 0)、CD4+ T细胞群(Cluster 1)、B细胞群(Cluster 4)、NK细胞(Cluster 2)和巨噬细胞簇(Cluster 5)。研究者使用物理相互作用细胞测序(PICs)(PIC-seq),寻找由于物理相互作用而被调节的基因,随后将差异表达的基因与来自两种细胞类型的小胶质细胞和T细胞的预期贡献进行比较。结果显示,在物理相互作用后,促炎和细胞毒性功能相互增强。最后,研究者使用IHC和流式细胞术验证了T细胞-小胶质细胞双重免疫复合物,结合PIC-seq和IHC分析,发现与未直接接触的小胶质细胞和T细胞相比,小胶质细胞免疫细胞双细胞明显显示出增加的促炎功能。
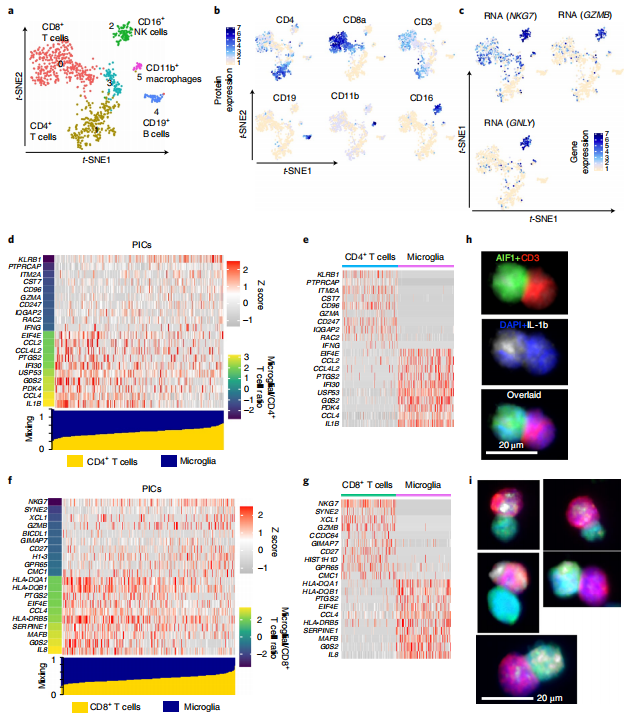
Fig.5 难治性癫痫患者脑组织中小胶质细胞与浸润性T细胞的直接相互作用
主要结论
本研究通过单细胞转录组和表面蛋白测序(CITE-seq),揭示手术切除的癫痫病变组织的的促炎微环境,包括小胶质细胞的广泛激活和其他促炎免疫细胞的浸润,同时还提供了小胶质细胞和T细胞之间的潜在浸润机制和直接的物理相互作用的证据,从而验证了上述发现。总之,这些数据提供了对癫痫组织中的免疫微环境的理解,并且可能为DRE和一些其他神经炎症疾病的介入治疗提供指导。
-
血脉通多功能治疗仪电路原理2009-11-28 6821
-
怎样治疗儿童癫痫才能增加成功率呢2012-09-07 1313
-
女性癫痫病的治疗要找到病因2012-09-25 2687
-
李光磊:心血管疾病精准医疗领域的研究2017-11-17 4200
-
基于免疫微传感器的微流体系统2018-11-15 1901
-
裕策生物获IDG领投的亿元B轮融资 推动肿瘤免疫诊疗发展2018-12-23 5581
-
用于治疗脑肿瘤和癫痫的新型柔性传感器2022-02-26 948
-
利用现代代码模拟大脑发育,以找到治疗疾病的方法2018-11-08 2954
-
德国开发可用于治疗老年痴呆症等神经性疾病的虚拟现实游戏2018-11-16 1473
-
飞利浦收购Intact Vascular扩充外周动脉疾病微创治疗方案2020-09-11 2456
-
基于白介素6的微流控电化学磁免疫传感器2022-09-02 2312
-
研究者如何研究SLS和IS的肿瘤免疫微环境2022-10-25 2225
-
神经介入治疗技术与市场2023-04-26 4042
全部0条评论

快来发表一下你的评论吧 !

