

FEC+DME电解液新配方
描述
一、全文概要
已经提出了多种电解质工程策略来延长锂金属电池(LMB)的循环寿命。这些策略在很大程度上可以分为两类:诱导溶剂驱动的策略与诱导阴离子驱动的固态电解质界面(SEI)层的策略。尽管每种策略都已被证明对控制SEI有效,但它们尚未得到充分研究。
在这里,来自首尔大学Jang Wook Choi和高丽大学Dong-Joo Yoo团队系统地筛选了具有不同解离能力的锂盐。在筛选的那些锂盐中,发现具有高最低未占分子轨道(LUMO)水平的高解离双(三氟甲烷)磺酰亚胺锂(LiTFSI)通过促进溶剂氟代碳酸亚乙酯(FEC)的还原而具有增强的可循环性。
此外,1,2-二甲氧基乙烷(DME)作为助溶剂,通过形成具有均匀分布的含氟成分的SEI层,从溶剂化鞘中诱导游离FEC,从而进一步提高循环寿命。这项研究通过控制溶剂化环境来实现高性能LMB,揭示了游离溶剂分子的有用性。研究以题目为“Strategy for Stable Interface in Lithium Metal Batteries: Free Solvent Derived vs Anion Derived”的论文发表在储能领域著名期刊《ACS Energy Letter》。
二、正文部分
1、文章亮点
1、筛选了一系列具有不同解离能力的锂盐,发现双(三氟甲烷)磺酰亚胺锂(LiTFSI)由于其作为盐的出色解离性和高最低未占分子轨道(LUMO)能级,最适合用于诱导具有优异可循环性的FEC驱动界面。
2、强调了通过使用多种盐溶剂来实现高度竞争的LMB来结构化溶剂化鞘的重要性,特别是通过涉及可以在分解后转化为有用成分的游离溶剂。
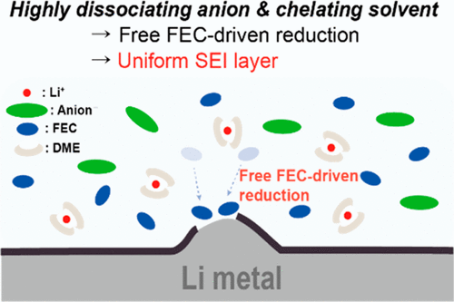
2、正文导读
为了利用广泛的阴离子溶剂池中的锂溶剂化结构,考虑了各种锂盐和溶剂;选择双(三氟甲烷)磺酰亚胺锂(LiTFSI)、双(氟磺酰基)酰亚胺锂(LiFSI)、六氟磷酸锂(LiPF6)和三氟乙酸锂(LiTFA)作为锂盐,氟代碳酸亚乙酯(FEC)和1,2-二甲氧基乙烷(DME)用作溶剂。记录了FEC中各种锂盐的拉曼光谱以及裸FEC的拉曼光谱(图1a)。
对于该分析,使用密度泛函理论(DFT)计算计算了FEC和Li+溶剂化FEC以及单个阴离子的拉曼光谱。由于TFSI-(720 cm-1)、FSI-(690 cm-1)和PF6-(710 cm-1)的主峰与FEC中729 cm-1的峰大部分重叠,因此906和922 cm-1分别被指定为游离FEC和Li+-溶剂化FEC的特征。游离电解质溶剂的可用性与锂盐的离解程度直接相关;当盐更易解离时,可用的游离FEC会减少,但会牺牲其与锂离子的配位。基于此逻辑,LiTFSI有望成为最可分离的,因为它在其拉曼光谱中表现出最高的无配位FEC比率,其次是LiFSI、LiPF6和LiTFA。
此外,对FEC中的各种锂盐进行线性扫描伏安法(LSV)测量,以研究它们在形成SEI层时的分解趋势。LiTFSI、LiFSI和LiPF6的FEC还原电位相当,而由于FEC的弱配位和TFA-与Li+的强配位,LiTFA的电位在2.0 V左右更高。这一观察结果与已知的事实一致,即配位阴离子的还原电位高于配位溶剂(即FEC)。
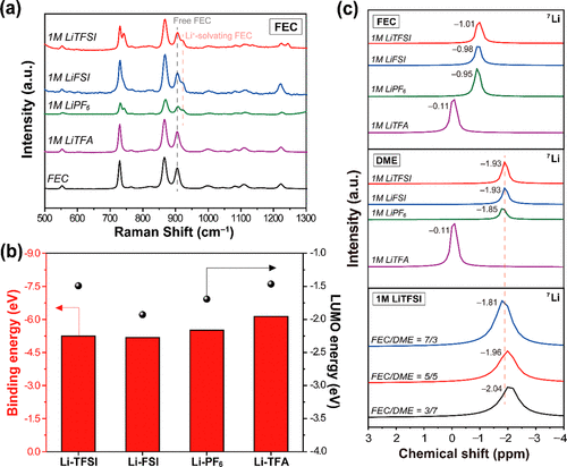
【图1】(a)FEC和FEC中不同盐的拉曼光谱。(b)TFSI、FSI、PF6和TFA阴离子与Li阳离子的结合能和LUMO能级。(c)FEC或DME中不同盐和1 M LiTFSI在不同FEC/DME比例下的7Li NMR光谱。
通过DFT计算估计每个阴离子与锂离子的结合能和锂盐的LUMO能级(图1b)。结合能的趋势与上述拉曼结果相称。TFSI-和FSI-分别与锂离子表现出-5.25和-5.18 eV(绝对值)的低结合能,表明在测试的锂盐中锂离解程度较高。在TFA-的情况下,与锂离子的结合能相对较高,为-6.13 eV,表明盐解离程度最低。另一方面,LUMO能级可以作为还原优先级的描述符,这样较低的LUMO能级会发生更早的还原。LiTFSI的LUMO能量最高,为-1.49 eV,而LiFSI的最低能量为-1.93 eV,这意味着它的优先还原和FSI驱动的SEI层的可能性。
因此,在LiTFSI和LiFSI之间,LiTFSI对还原会更稳定。综合考虑上述结果,LiTFSI最适合形成FEC衍生界面,因此能够对传统LIB的界面进行基准测试。但是,虽然目前的DFT计算没有像实际电解质一样考虑包含周围分子的连续介质,但它们对于观察不同电解质之间的趋势仍然很有价值。
为了阐明锂离子在不同电解质条件下的溶剂化环境,对作为助溶剂的FEC、DME和FEC/DME中的各种锂盐进行了核磁共振(NMR)分析(图1c)。在NMR光谱中,向较低值的化学位移(高场位移)是指相关原子周围电子密度的富集,从而使原子核免受外加磁场的影响。
因此,可以从NMR光谱中检索有关电解质中目标原子环境的信息。根据7Li NMR光谱(图1c),DME中各种Li盐的化学位移比FEC中的更显著,表明DME的给电子性高于FEC。1 M LiTFSI在以FEC和DME作为助溶剂的FEC/DME中的化学位移始终与DME中的相似,无论DME部分如何,这意味着当FEC和DME一起存在时,DME主导Li溶剂化鞘。1 M LiTFSI在FEC/DME的拉曼光谱中Li+溶剂化FEC峰的消失进一步证明了这种解释(体积为5/5)。同样,在LSV分析中,与单独使用FEC的情况相比,FEC/DME(5/5)中1 M LiTFSI的Li-FEC峰基本上消失了。
值得注意的是,几乎没有观察到Li+溶剂化DME在897 cm-1处的拉曼峰,因为它与游离FEC的900 cm-1处的峰重叠。此外,考虑到DME对还原的高稳定性,DME在溶剂化鞘中对FEC的优势促进了非配位FEC参与SEI层的形成,具有以下优点:(1)与配位FEC对应物相比,非配位FEC具有较低的还原电位,(2)它的迁移是在较小程度上由电场驱动。
额外的分析进一步证实了游离FEC的存在。在单独的LiTFSI-FEC和FEC的拉曼光谱中(图2a),分配了Li+-溶剂化FEC和游离FEC峰,并且随着FEC中LiTFSI中盐浓度的增加,Li+溶剂化FEC的相对峰强度增加较大部分的FEC与锂离子配位。还对具有各种FEC/DME比率的FEC/DME中的1 M LiTFSI进行了拉曼分析(图2b)。随着FEC/DME中DME比例的增加,Li+溶剂化FEC峰逐渐降低,当FEC/DME比例超过7/3时几乎消失。
考虑到在FEC/DME(7/3)中的1 M LiTFSI中DME与Li的摩尔比为2.9,从拉曼结果得出结论,DME溶剂化Li离子仅用于FEC/DME比率小于7/3;FEC/DME=7/3接近于众所周知的Li+-(DME)3配位。这一观察结果与分子动力学(MD)模拟的结果一致(图2c)。根据1 M LiTFSI在FEC/DME中的径向分布函数(5/5),Li+-ODME的峰值远强于Li+-OFEC和Li+-OTFSI-,DME的平均配位数为2.94,而FEC为0.033。
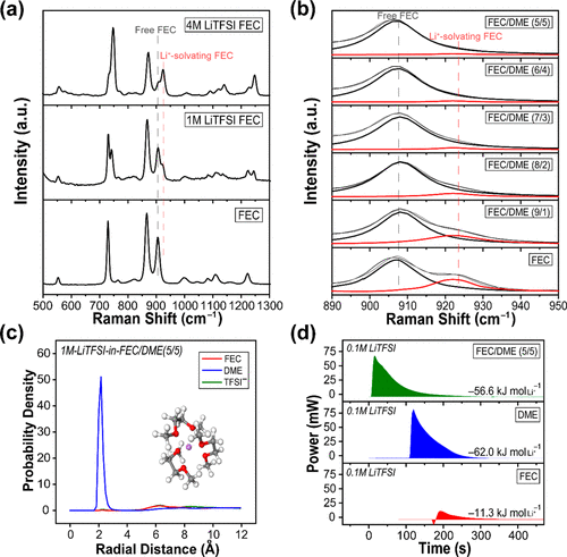
【图2】(a)FEC、FEC中的1 M LiTFSI和FEC中的4 M LiTFSI和(b)FEC/DME中的1 M LiTFSI的拉曼光谱,具有不同的溶剂比(v/v)。(c)来自MD模拟的FEC/DME(5/5)中的1 M LiTFSI中的Li+-OFEC、Li+-ODME和Li+-OTFSI-的径向分布函数。插图:最可能的溶剂化结构。(d)通过微反应量热法将FEC、DME或FEC/DME(5/5)注入0.1 M LiTFSI盐后的热释放曲线。摩尔溶解热(kJ/molLi+)通过将功率曲线与时间积分并根据盐量对其进行归一化来计算。
DME的优先Li配位也通过微反应量热法得到验证,该量热法测量每种溶剂溶解0.1 M LiTFSI时释放的热量(图2d)。溶解热是一个总称,由与离子-溶剂相互作用相关的焓变以及与系统中离子和溶剂分子的统计行为相关的熵变决定(ΔGdiss=ΔHdiss-TΔSdiss)。
与DME(-62.0 kJ mol-1)相比,FEC的溶解热较低,为-11.3 kJ mol-1。FEC/DME(5/5)共溶剂的值为-56.6 kJ mol-1,接近DME的值。溶解熵的变化与溶液状态和溶剂状态之间的构型差异有关。助溶剂系统具有比其单一溶剂对应物更高的熵,因为助溶剂系统在将溶剂分子排列在给定体积中时具有更多的选择。助溶剂系统的较高熵在其中溶解盐时产生较小的熵变化。这一推理表明,FEC/DME(5/5)的熵变化必须小于每种溶剂的熵变化,并且FEC/DME(5/5)的大(负负)溶解热强烈支持热力学在FEC/DME中溶解LiTFSI(5/5)主要由DME决定。
为了进一步研究电极表面的动力学,FEC中各种锂盐的交换电流密度(I0)从它们的Tafel图测量(图3a)。1 M LiTFSI在FEC中的优异界面动力学从其最高的交换电流密度(I0=3.2×10-3 A cm-2)可以看出;事实上,该值比FEC中1 M LiTFA的值大3000多倍(I0=1.0×10-6 A cm-2)。
与盐的影响相反,FEC/DME溶剂混合物的不同体积比对交换电流密度没有显著影响。交换电流密度的趋势与锂盐解离的趋势一致,得出结论:锂盐解离是决定界面动力学的主要因素。这可能归因于去溶剂化行为和SEI特性的综合影响,尽管需要深入研究来证实这一点。
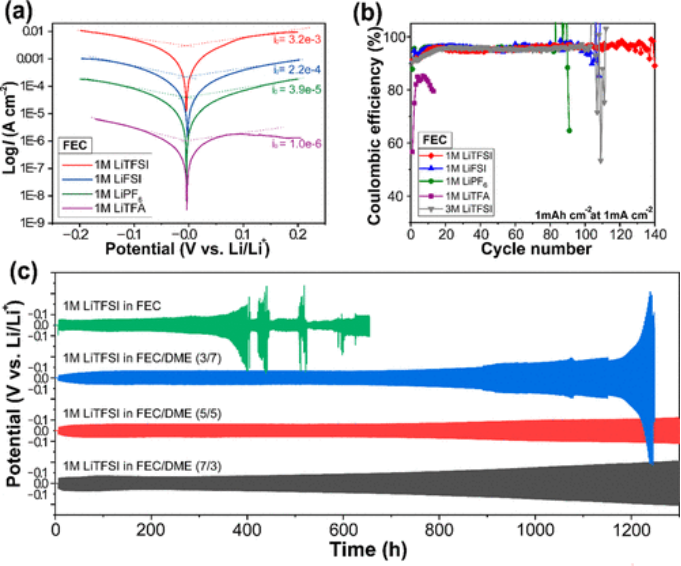
【图3】(a)Tafel图和(b)在FEC中不同盐的Li-Cu非对称电池的库仑效率,在1 mA cm-2下沉积锂容量为1 mAh cm-2。(c)具有1 M LiTFSI的Li-Li对称电池在不同比例的FEC和DME下的电压曲线。
通过对具有不同Li盐的FEC基电解质进行Li-Cu不对称电池测试来评估Li盐对电化学特性的影响(图3b)。当电池在1m A cm-2下以1 mAh cm-2的固定容量循环时,它们与不同盐的CE表现不同。FEC电池中的1 M LiTFSI在130多个循环中保持相对较高的CE水平(>95%),而FEC中的1 M LiFSI和FEC电池中的1 M LiPF6仅在80个循环中保持相似的CE水平(>95%),FEC中的1 M LiTFA仅完成10个循环,最低CE约为80%。为了阐明这种独特的性能,通过X射线光电子能谱(XPS)分析了SEI层的化学成分。
在C 1s分支中,-CF3的峰值主要在LiTFA电解质中观察到,这是由于TFA-的还原。在F 1s分支的情况下,LiTFSI电解质表现出最高的LiF与CF3峰值比,为2.07,而其他两种电解质的比值较低,在0.94-1.53范围内。这些观察结果表明,锂盐的解离很大程度上影响了SEI的组成,总体上影响了表面动力学和电化学性能。考虑到这种溶剂化结构,LiTFSI最适合诱导FEC衍生的SEI层,因为它具有最高的解离能力。除此之外,由于LiTFSI具有最高的LUMO能级,因此这种锂盐的抗还原稳定性比较优越。
在FEC中对3 M LiTFSI的测试表明,循环性能不如其1 M对应物(图3b),因为形成了高浓度的TFSI-衍生SEI层。此外,电化学阻抗谱(EIS)分析表明,在前五个循环中,FEC中的1 M、3 M和5 M LiTFSI中的三个之间的体电解质和界面电阻相似。
然而,3和5 M LiTFSI在FEC中的界面电阻在循环后显著增加。这再次证实了3 M和5 M LiTFSI在FEC循环中的较差性能与不稳定的界面形成有关,而不是由于较高的盐浓度导致它们的较低离子电导率。这一观察传达了一个重要信息:即FEC衍生SEI层的策略与阴离子衍生方法的策略相反,因为后者通常依赖于(异常)高盐浓度。 为了利用DME对锂金属负极的相对还原稳定性,对FEC/DME混合物在1 mA cm-2下容量为1 mAh cm-2的Li-Li对称电池进行了测试(图3c)。FEC电池中的1 M LiTFSI仅在300小时内保持稳定的过电位,并通过短路停止运行。
当FEC/DME以5/5的比例(v/v)混合时,可实现最佳可循环性,使过电位保持低(<120 mV)超过1300小时。相比之下,FEC/DME=3/7和7/3电解质在循环过程中的过电位逐渐增加(对于FEC/DME=3/7和FEC/DME=7/3,在1050和1030小时后达到150 mV)可能是由于SEI的持续增长。该系列电解质的比较循环性能意味着DME的引入提供了显著提高循环性能的机会,并且存在能够稳定SEI层的最佳组成。 为了进一步阐明添加DME对SEI特性的影响,获得了在FEC/DME=5/5中循环的锂金属电极的XPS F 1s光谱,同时改变了氩离子蚀刻时间(图4)。
这些分析是在1 mA cm-2下容量为1 mAh cm-2的Li沉积和剥离5次循环后进行的。在686.9、685.1和684 eV处观察到的峰分别对应于-CF3、C-F和Li-F键。如上所述,与Li-F键相关的峰主要归因于FEC分解,而分配给-CF3和C-F的峰主要来自TFSI-的分解。在FEC中1 M LiTFSI的情况下,LiF峰的强度随着氩离子蚀刻而降低,而在长达360秒的整个蚀刻期间,-CF3和C-F峰不规则地出现(图4a)。另一方面,观察到FEC/DME(5/5)中1 M LiTFSI中的Li-F、C-F和CF3峰在整个蚀刻期间分布得更加均匀,反映了SEI层的稳定性和鲁棒性(图4b)。
这种现象可以通过DME优先占据Li溶剂化鞘来解释,这导致游离FEC溶剂的浓度梯度驱动的垂直均匀分解。DME的优先占据也得到了自由能计算的支持,该计算揭示了两种溶剂不同的最佳溶剂化结构。所有这些结果使假设当FEC衍生的SEI形成时,自由FEC在形成均匀的SEI层中起关键作用。
FEC(与锂离子配位)的溶剂化导致其在整个SEI层深度的不均匀分解,因为溶剂化的锂离子在电极表面附近的强电场驱动下不规则迁移。作为参考,电池的工作电位(即LIB电池约为3.8 V)被同心地施加在界面上,其厚度小于几纳米,从而在其中产生极强的电场。
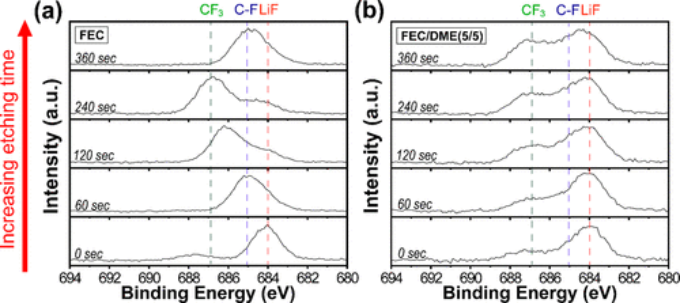
【图4】在(a)FEC和(b)FEC/DME(5/5)中具有1 M LiTFSI的Li负极在1 mA cm-2条件下容量为1 mAh cm-2的5次锂沉积和剥离循环后的XPS F 1s深度分布。溅射蚀刻时间范围为0到360秒。
通过将300或40 μm厚的锂金属负极与LiNi0.8Co0.1Mn0.1O2(NCM811)正极配对,在全电池配置中进一步评估了不同电解质的电化学性能(图5)。恒电流循环测试在0.2 C下进行三个预循环,然后在1 C下进行后续循环。FEC/DME(5/5)电池中的1 M LiTFSI提供了显著优越的循环性能,150次循环的容量衰减率为每循环0.23%(图5a)。
相反,在FEC中具有1 M LiTFSI和在EC/DEC(1/1)中具有1 M LiPF6的电池分别在15和20个循环后迅速衰减。考虑到在Li-Cu不对称和Li-Li对称电池测试中,FEC中的1 M LiTFSI比EC/DEC中的1 M LiPF6(1/1)表现出更有效的Li可逆性,1 M的性能更高相对于FEC电池中的1 M LiTFSI,全电池中的EC/DEC(1/1)电池中的LiPF6相当特殊。这一观察结果认为FEC电解质中的1 M LiTFSI与NCM811正极的相容性可能是一个问题。为了解决这个问题,对使用不同电解质循环的NCM811正极进行了XPS和扫描电子显微镜(SEM)分析。F 1s和C 1s XPS曲线在FEC/DME(5/5)中的1 M LiTFSI和FEC中的1 M LiTFSI中循环的正极组成方面没有显著差异。
然而,根据SEM分析,在FEC电池中的1 M LiTFSI的循环正极上观察到大量副产物,而这些副产物在FEC电池中的1 M LiTFSI上形成的程度要小得多。FEC/DME(5/5)正极。这意味着游离FEC也有利于形成均匀的正极电解质界面(CEI)层,这可能基于与锂金属负极相同的逻辑,尽管这需要更详细的研究。1 M LiTFSI在FEC/DME(5/5)中的优势在使用薄锂金属负极(40 μm)的全电池测试中得以保留(图5b)。
FEC/DME(5/5)电池中的1 M LiTFSI在120次循环后保持其原始容量的88.0%,而FEC中的1 M LiTFSI和EC/DEC(1/1)电池中的1 M LiPF6仅在分别为15和30个循环。电池之间的一系列比较结果揭示了游离FEC在两侧电极上形成均匀稳定界面的有效性。
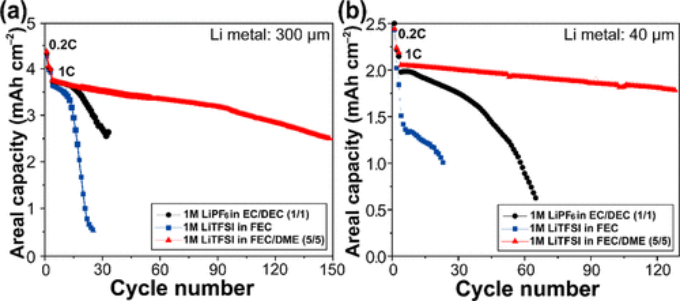
【图5】不同电解质的Li-NCM811全电池的循环性能。Li金属的厚度为(a)300 μm和(b)40 μm。
3、总结与展望
阐明了盐解离程度和由此产生的FEC与Li离子的配位在确定SEI和CEI层的主要特性以及相应LMB电池的关键性能驱动因素方面的影响。TFSI阴离子的循环性能,具有高盐解离度和高抗还原性,优于其他测试的阴离子。此外,作为助溶剂添加的DME优先溶剂化锂离子,从而产生游离的FEC溶剂分子。自由FEC在界面处自由扩散时分解,因此有助于形成具有均匀分布的含氟成分的SEI和CEI层。
1 M LiTFSI在FEC/DME(5/5)中在各种电池配置中的增强循环性揭示了游离FEC的有用性,这是调整溶剂化结构的结果。这些发现通常可以作为LMB电解质工程的指南:通过控制锂溶剂化环境,促进游离溶剂在分解后转化为有用的界面组分。
审核编辑:刘清
-
锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?2024-01-11 2501
-
电解液与SEI的关系?电解液对SEI的影响?2023-11-10 1486
-
深度解读钴酸锂体系电解液应用2021-04-17 8008
-
电解液宽温性能的影响因素和宽温电解液研究进展2020-10-21 12285
-
锂电池电解液的组成部分_锂电池电解液的危害2020-08-03 11670
-
电池电解液和电解质的区别_电池电解液和电解质的两种形态2020-04-16 25399
-
锂电池电解液是什么_锂电池电解液主要成分2020-03-30 50687
-
电解液——锂电池的‘血液’2018-08-07 5926
-
PNNL新电解液配方 使电池使用寿命翻7倍2018-04-06 8473
-
电解液电容器老化电压与电解液火花电压的关系2013-12-30 4288
-
电解液比重2009-11-16 9289
-
锂离子电池材料之电解液(详细篇)2009-11-03 20020
-
锂离子电池电解液是什么?2009-10-27 14653
全部0条评论

快来发表一下你的评论吧 !

