

天下苦锂电池久矣,金属-空气电池前来救驾
描述
用空气制造的终极蓄电池有望在不久的将来出现。这种电池不需要传统的电极,重量是现有锂电池的1/5。《日本经济新闻》在近日的报道中指出,全世界多个国家和多家企业正积极推进空气电池研发,期待能借此实现尽快脱碳的目标。
金属-空气电池具备倍率性能好、能量密度大、低碳可持续等优点,是一种半储能半燃料式电池,被认为是新一代的储能与转化装置。著名学者Leclanche于1868年研制出世界第一个金属-空气电池,现如今,已发展出多种金属-空气电池。由于大多数金属-空气电池的正极反应以氧气参与为主(此外还有二氧化碳、氮气等),充放电过程基于正极区发生的氧气还原(ORR)和氧气析出(OER)反应,本篇仅列举这类示例。
常见金属-空气电池(图源:王焕锋,《金属空气电池双功能正极催化剂的制备及电化学性能研究》)
锂-空气电池
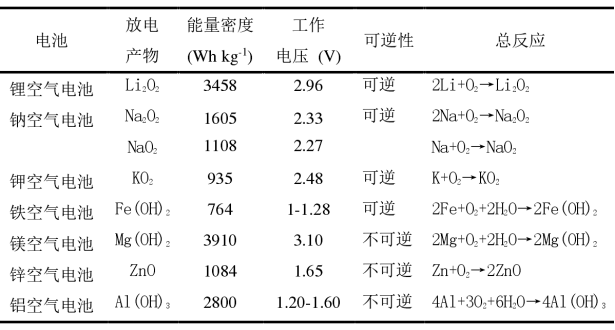
锂-空气电池的研究最早可以追溯至1976年,由Littauer和Tsai首次提出。电池负极为金属锂,正极为具有合理孔结构带有ORR催化活性的复合材料,隔膜为玻璃纤维或者PP膜,电解液一般为1M的LiTFSI溶解在TEGDME或者DMSO。放电时,负极锂失去电子变为Li+,Li+跨越隔膜后迁移至正极。而正极侧在催化剂的协助下,氧气获得外电路电子发生ORR反应产生中间体离子O2−,Li+与O2−结合成LiO2,之后经过进一步电化学还原或者化学还原生成最终放电产物Li2O2。充电时,Li2O2发生氧化反应生成LiO2-x后进一步被分解为Li+和O2,Li+迁移回到负极并重新生成金属锂。
锂-空气电池原理图(图源:王晓雪,《高比能锂氧气/锂二氧化碳电池正极关键问题及新型策略研究》) 在整个电池的反应过程中,氧气是真正的正极反应物。而作为锂氧气电池重要组分的多孔正极,其功能是承载活性材料,提供氧气和锂离子之间电化学反应的“气-液-固”三相界面及在充放电过程中作为ORR/OER过程的催化剂。
铝-空气电池
早在19世纪,金属铝就在电池材料中使用了。1960年,Zaromb等人在燃料电池中研究了铝阳极在空气电池系统中的理论,并对其可行性进行了探讨。1962年,Holzer F在实验中研究了金属铝-空气电池。之后,经过不断的发展,在1979年,A.R.Despic等使用海水作为铝-空气电池的电解液并在电动汽车上进行应用。1990年起,各领域都有了铝-空气电池的身影,如在化学电源、电动汽车、水下潜艇方面的应用等。
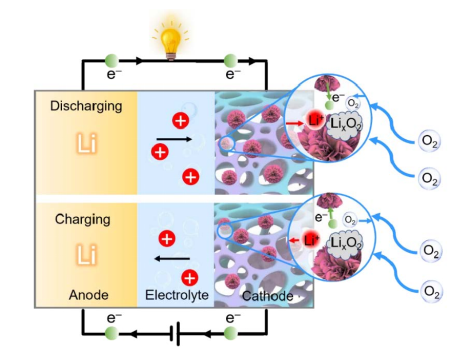
铝空气电池原理图(图源:王心英,《铝空气电池阴极材料的设计、制备及电化学性能研究》) 铝-空气电池的负极消耗金属铝,由高纯铝或铝合金构成;正极消耗氧气,由防水透气膜、催化剂及导电材料构成;电解液消耗水,由碱性溶液或盐性溶液构成。电池工作过程中,金属铝在电解液中溶解形成白色金属氢氧化物Al(OH)3,氧气透过防水透气膜进入正极,与水在催化剂的作用下发生电化学反应生成OH-,物质的化学能转换为电能。
锌-空气电池
锌-空气电池的研究最早可以追溯到1879年,麦歇等用锌片作为电池的负极,空气电极采用碳和少量的Pt粉作为载体用以制造,氯化铵水溶液作为电解质装配成历史上最早的锌-空气电池。 锌-空气电池由锌负极、电解液、空气正极和隔膜分离器构成。其负极可以使用纯锌板、锌箔、锌合金等;电解液通常使用具有良好导电性和O2扩散系数的6mol/L的氢氧化钾溶液;其空气正极制备的质量是锌空电池的核心,通常由气相的气体扩散层、固相的催化剂层以及液相的集流体层构成一个三相界面。隔膜分离器不仅要求其密封性较高避免发生漏液现象,又要保证催化剂层与空气接触良好便于反应进行。
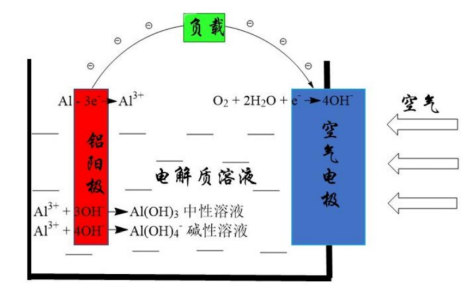
锌空气电池原理图(图源:赵璐,《锌-空气电池电化学反应模型及枝晶生长抑制研究》) 锌-空气电池在放电过程中,电池负极的锌在电解液中被氧化,形成游离的锌酸盐离子(Zn(OH)42-),并向外电路释放电子,当达到饱和状态后,Zn(OH)42- 离子逐渐生成难溶于水的ZnO;在电池正极的三相界面处,空气中的O2接受来自负极的电子,在催化剂层上发生还原反应变成OH-,用于补充负极消耗的OH-来保持电化学平衡。而充电过程是放电的逆反应过程,即Zn(OH)42-得到电子在阳极被还原恢复成Zn,同时阴极则是OH-失去电子并实现O2的脱附。
钠-空气电池
钠-空气电池起步较晚,在2011年由Peled等人提出,采用液态熔融钠替代金属锂作为阳极,获得105~110℃范围内正常工作的钠空气电池。近年来,钠-空气电池的研究获得了空前的发展势头。钠-空气电池是由多孔碳质材料作为空气/氧气阴极,原始钠金属作为阳极组成。这两个电极夹在一个包含非质子电解质的隔板之间。阴极的反应物O2在放电过程中从周围中的空气扩散到多孔炭里面。
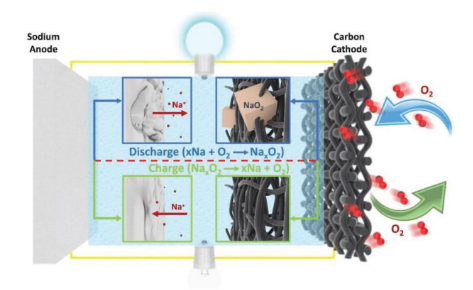
典型的非水充电Na-O2电池的结构示意图和工作原理(图源:刘秋男,《钠-气体电池电化学反应机理的原位电镜研究》) 在放电过程中,金属钠被氧化成钠离子(Na+),该Na+通过有机电解质迁移到阴极。同时,O2在阴极表面被还原以形成还原的氧(O2-或O22-),然后与迁移的Na+结合形成金属氧化物作为放电产物。当电池充满电后,反应将以相反的方向进行,阳极处的Na-metal电镀层和阴极处的氧气逸出。
镁-空气电池
镁-空气电池一般以Mg及其合金作为负极,以6mol/L的NaOH或KOH作为电解液,而正极为空气电极,在空气电极上会负载催化剂和导电碳黑的混合物。在镁空气电池的放电工作中,镁金属和电解质反应放出电子,电子经外电路到达空气电极的三相交界处和氧气以及水反应生成氢氧根离子。 目前关于镁-空气电池仅有少量的实验和理论报告,尚处于发展初期,并且其循环能力非常有限。
钾-空气电池
钾-空气电池通过简单的单电子过程实现电流的供给,而无需使用昂贵的电催化剂。在放电时由于K+间的空间斥力更易得到热力学稳定的KO2,而且KO2是唯一的放电产物;充电过程中KO2分解为K+和O2,整个电极反应通过单电子氧化还原电对O2/O2-实现。
铁-空气电池
铁-空气电池采用金属铁作为阳极,空气电极作为负极,以碱性或者中性盐溶液作为电解质,其阳极一般不采用块状铁,而是采用活性铁粉的形式制成袋式电极。为提高其活性,往往在铁粉中添加氧化物或其他元素,提高铁电极放电容量。 相对于其他金属-空气电池,铁-空气电池的放电电压和比能量密度都较低,开发使用成本较高,因此目前对于铁空气电池的研究较少。影响铁空气电池电极性能的最重要因素是高倍率放电下铁电极表面的钝化以及充电过程中电池内部严重的析氢反应,其中析氢反应消耗掉约一半的电池能量,大大降低了法拉第电流效率。
总结
金属-空气电池是以轻质活性金属作为阳极材料,具有能量密度高、放电平稳的优点。另外其产物主要是金属氧化物,对环境无任何污染,是兼具能量和环保的先进能源技术。目前,金属-空气电池已成为全球范围内深入研究的主题,并且在过去十年中取得了巨大进步。未来有望在新能源汽车、便携式设备、固定式发电装置等领域获得应用。
审核编辑 :李倩
-
动力型锂电池与普通锂电池的差别2016-01-07 7606
-
锂电池如何科学使用?2017-09-11 3387
-
延长锂电池使用寿命的方法2017-09-15 4608
-
锂电池与铅酸电池的不同之处2018-03-31 5107
-
锂电池VS聚合物锂电池,谁才是未来的主角?2018-08-17 7079
-
锂电池的优点和缺点2019-05-05 6643
-
锂电池跟蓄电池的区别2019-06-25 4399
-
【浩博电池资讯】如何正确使用锂电池2019-07-26 2983
-
锂电池的种类有哪些2019-08-21 4602
-
服务丨锂电池上证,安全运天下2021-07-27 1341
-
回收锂电池 回收锂电池模组 回收软包锂电池回收 回收圆柱锂电池 回收动力锂电池回收2021-10-30 1575
-
锂电池回收 锂电池模组回收 软包锂电池回收 圆柱锂电池回收 动力锂电池回收,回收电池,2021-12-09 1467
-
锂电池之后的新电池——锂-空气电池2009-12-02 1066
-
锌空气电池优缺点_锌空气电池与锂电池哪个好2017-12-19 45019
-
什么是锂电池?锂电池起火爆炸原因2023-09-11 1860
全部0条评论

快来发表一下你的评论吧 !

