

硫化物固态电解质与氧化物正极的热稳定性
描述
【摘要】
本工作从基本燃烧元素的角度对硫化物SE的热稳定性能进行了验证,系统地研究了典型硫化物SEs(Li3PS4 , Li7P3S11 , Li6PS5Cl, LSPSCl, Li4SnS4 )和具有不同脱锂状态的氧化物阴极Li1–xCoO2 的热力学和动力学特性。
【研究背景】
电动汽车和储能站日益增多的火灾事故严重制约了能量密度更高、安全性更好的锂离子电池的发展。最终消除此类风险的最佳途径是在材料层面提高电池的安全性,用不易燃/易挥发的固体电解质(SE),包括聚合物、氧化物和硫化物,取代易燃易挥发的有机液体电解质(LEs)。
然而,由于其优良的性能和常识的干扰,SE和固态电池的安全性一直被忽视。对于固体聚合物电解质(SPEs),其热稳定性主要受聚合物单体和锂盐的特性影响,而其与电极材料的热稳定性则与它们的种类和电极材料的状态相关。作者团队回顾了最近关于SPEs及其与阴极材料的热稳定性的报告。
结果表明,SPEs的分解温度在200到400℃之间,而它们与阴极材料的热反应温度相对较低,在150-350℃之间。对于氧化物SEs,尽管其合成温度较高,但在与电极材料接触时仍表现出明显的放热行为,这可能导致电池的热失控。
2017年,Mukai等人设计了一种特殊的差示扫描量热法(DSC)测试电池,发现全固态电池(ASSB)在初始温度范围为200-300℃时仍有放热行为,这与阴极释放的氧气有关。同年,Kang小组发现Li1.5Al0.5Ge1.5(PO4)3 (LAGP)和金属锂在加热到200℃时,即使在惰性气氛(Ar)中也会经历剧烈的燃烧。
他们认为,在这个反应中会释放出氧气,从而进一步加剧化学反应。Li小组对四种典型的氧化物SE与金属锂的热稳定性进行了系统研究,其顺序为LAGP
上述报告表明,并非所有的SE都是绝对热稳定的,特别的考虑到它们与电极材料的界面稳定性。 与聚合物和氧化物SEs相比,硫化物SEs与电极有良好的界面接触,具有理想的可加工性,以及较高的室温离子传导率。然而,关于硫化物SEs/ASSBs的热稳定性的研究很少被报道,因为它们对仪器有很强的腐蚀性,对测试环境的要求很高,在空气/水中不稳定,而且容易释放有毒气体(例如,H2S,SO2 )。
尽管如此,作者团队通过建立合适的理论模型和参数,系统地研究了典型硫化物SE的热稳定性,并揭示了典型硫化物SE的热稳定性顺序为Li6PS5Cl > Li4SnS4 > Li9.54Si1.74P1.44S11.7Cl0.3 (LSPSCl) > Li3PS4 > Li7P3S11 。由于LIB的阴极材料通常具有高氧化电位,硫化物SE和氧化物阴极材料之间的热稳定性应该引起更多的关注。
Tsukasaki等人研究了75Li2S-25P2S5 玻璃电解质(LPS)-LiNi1/3Mn1/3Co1/3O2 (NMC)界面在高温下的演变过程。结果显示,LPS在150-175℃的温度范围内明显收缩,在DSC中出现了复合阴极在带电状态下的明显放热过程。此外,Tsukasaki等人还发现,在400℃时出现了杂质Li4P2S6 和Li2S,LPS玻璃电解质被氧化成Li3PO4 ,同时在400℃以上形成了MnS和CoNi2S4 等杂质。
更多的实验结果表明,阴极分解过程中释放的氧气会进一步加剧放热反应过程。此外,通过类似的实验还研究了Li4SnS4 -NMC的热稳定性,显示出比LPS-NMC更高的初始放热温度。然而,目前只研究了少量的硫化物SE,没有考虑硫化物SE的自我分解、热化学反应的热力学和动力学因素以及有效的改进方法。
因此,硫化物ASSBs的安全评估一直无法有效开展,这大大限制了其工业发展和大规模应用。
基于以上问题,近日,中科院物理所吴凡研究员团队详细研究了硫化物SEs的可燃性以及ASSB中典型硫化物SEs与电极材料之间的热化学反应,从不同角度揭示了硫化物SEs的可燃性以及其与电极材料之间存在的严重放热反应。作者通过设计一个直接/间接接触的热处理系统,发现硫化物SEs和Li1–xCoO2 在400-500℃下发生反应。
系统地研究了硫化物SEs的热稳定性、空气稳定性和分解产物对上述反应过程的影响,同时发现硫化物SEs的分解产物在反应过程中起到了重要作用。随着Li1–xCoO2 脱锂程度的加深,硫化物SEs的空气稳定性在上述化学过程中的影响将逐渐突出。
基于一系列热化学反应的基本数据,通过基辛格法(Kissinger)得到了硫化物SEs和Li1–xCoO2 化学反应的关键动力学参数。此外,它们的热化学反应主要可以分为两个阶段,即起始反应过程和剧烈反应过程。
发现不同的硫化物SE和Li1–xCoO2 ,在动力学参数上存在明显的差异。有了上述对热稳定性的认识,采用涂层和真空系统成功地抑制了硫化物SEs和Li1–xCoO2 之间的热化学反应,从而获得了优异的电化学性能。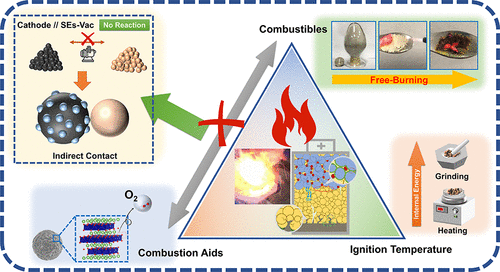
【研究内容】
硫化物SE及其电池材料的可燃性 电池的热安全风险主要是指由电池内部严重的化学反应引起的热失控。因此,对关键材料的热稳定性及其界面热反应的研究,有利于避免热失控和提高热安全性。热失控本质上是一个燃烧过程,为此需要三个条件(也称为 "燃烧三角",如图1a所示),即助燃剂、可燃物和着火温度。助燃剂一般是氧化性物质,在氧化还原反应中获得电子,而可燃物一般是还原性物质,在广义上的氧化还原反应中失去电子。
当环境温度达到燃点时,可燃物和助燃剂直接接触后将发生氧化-还原反应。这个过程会释放出大量的热量,使反应继续激烈发生,最终导致燃烧和更严重的放热反应。结论是,只有当这三个必要条件同时得到满足时,才能发生燃烧或热反应。从温度的角度来看,很难防止 "燃烧三角 "的条件,因为较低的环境温度通常会影响电池的性能,而且由于相变内热材料的导热性差,防止剧烈的热扩散的效果并不理想。
在LIB中,尽管可以通过隔膜或其他绝缘层来防止阴极(助燃剂)和阳极(可燃物)的直接接触,但由于LEs的挥发性、可燃性和热稳定性差,接触的风险仍然存在。因此,有望通过用SE取代LE来解决上述热失控问题。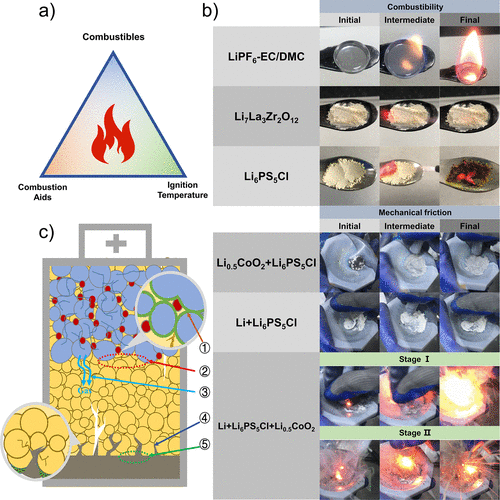
图1.硫化物SE及其电池材料的可燃性实验。(a) 燃烧三角形的示意图,即引起燃烧的三个必要因素。(b) 硫化物SE及其电池材料的电解质可燃性和机械研磨燃烧的实验照片。
其中,上部为1M LiPF6 EC/DMC(v/v = 1:1)LE、Li7La3Zr2O12氧化物SE、Li6PS5Cl 硫化物SE在空气中的点燃实验。下部显示了Li6PS5Cl + Li0.5CoO2 ,Li6PS5Cl + Li,以及Li6PS5Cl + Li + Li0.5CoO2 在Ar中的研磨燃烧实验。(c)可能导致ASSB热失控的内部因素示意图。
然而,SE的可燃性很少被报道,特别的具有高离子传导性的硫化物SE。这是因为硫化物SEs与表征设施严重反应,产生有毒气体(H2S,SO2 ),导致严重的腐蚀和环境污染。作者团队通过建立内在的理论热力学范式/模型和证实实验证据,系统地研究了典型硫化物SE的热稳定性。结果表明,硫化物SEs在加热过程中会分解并释放出挥发性/可燃性硫。
这充分表明,在硫化物ASSB的热失控过程中或在其他适当的条件下,硫化物SE可以燃烧。图1b显示了1M LiPF6 EC/DMC(v/v = 1:1)LE、Li7La3Zr2O12氧化物SE和Li6PS5Cl 硫化物SE在空气中的加热燃烧实验。实验照片显示,1M LiPF6 EC/DMC(v/v = 1:1)LE在空气中容易燃烧,其燃烧火焰明显且呈圆锥形。
这说明EC/DMC溶剂容易挥发,形成锥形火焰。Li7La3Zr2O12 氧化物SE的形态在加热后没有变化,加热过程中也没有火焰产生。这一现象说明Li7La3Zr2O12 氧化物SE在空气中是不可燃的,并且具有良好的热稳定性。最典型的硫化物SE,Li6PS5Cl,在加热过程中产生小火焰,没有明显的烟雾,显示出暗红色的火花,逐渐扩散和燃烧。
可以得出结论,Li6PS5Cl在空气中也是可燃的,但在加热/燃烧过程中没有产生明显的挥发性/可燃性成分,这与我们小组以前报告的实验结果一致。通过上述燃烧实验,可以推断出硫化物ASSB具有一定的热安全风险,特别的在高环境温度或内部温度下。
电池内部的高温通常是由不同的电极材料直接接触引发的内部短路引起的。机械研磨在一定程度上像加热一样增加了材料的内能,而内能是由机械能转化而来的。为了方便手套箱内的热处理实验,避免连续加热过程中的污染或反应,采用机械研磨作为反应激发方式,代替传统的平板加热。
值得注意的是,机械研磨法不能有效量化,手工研磨的机械能比高温加热的机械能低得多。为了模拟Li-Li6PS5Cl-LiCoO2 电池的热失控过程,在Ar中Li6PS5Cl、Li和Li0.5CoO2 电池材料之间进行了机械研磨燃烧实验(图1b)。在这样的混合物中,Li6PS5Cl在以前的实验中表现出一定的还原性和可燃性,而具有强氧化能力的Li0.5CoO2 可以作为燃烧助剂。
然而,通过直接接触的机械研磨,在Li6PS5Cl和Li0.5CoO2 之间没有观察到燃烧现象,说明没有发生氧化还原或燃烧反应。根据燃烧三角形,这可能是由低于燃点的低环境温度造成的。Li6PS5Cl和Li的研磨也显示没有燃烧,有助于形成含有Li2S、LiCl和P的稳定界面,防止后续反应。值得注意的是,并不是所有的硫化物SE在与金属锂/活性阳极直接接触后,在惰性气氛条件下都不发生经过验证的燃烧现象。
其他一些硫化物SE可能与金属锂发生严重的燃烧反应。Li3PS4 会与金属锂反应产生严重的燃烧现象,而Li6PS5Cl却没有。实验结果表明,不同的硫化SE与金属锂之间的燃烧现象有明显不同。
然而,当Li6PS5Cl、Li和Li0.5CoO2 电池材料混合研磨后,出现了明显的燃烧现象,类似于电池的内部短路燃烧。阴极和阳极直接接触释放的大量热量引发了Li6PS5Cl和电极材料之间的进一步连锁反应。根据反应强度和火焰形态,整个燃烧过程可以分为两个阶段。
第一阶段从零星的火花开始到明显的燃烧火焰,并伴有烟雾,随后第二阶段从小火焰到爆炸性的放射性溅射燃烧,并伴有明显的灰尘。可以推断,由电极材料直接接触引起的化学反应所释放的热量将进一步加剧硫化物SE的燃烧反应。此外,可能导致ASSB热失控的内部因素如图1c所示,包括:①阴极材料颗粒与SE颗粒的接触反应;②正极与SE层的接触界面反应;③阴极材料释放的氧化性气体;④负极的锂枝晶的生长;⑤负极与SE层的接触界面反应。在这些因素中,阴极和SE的关系对ASSB的整体热稳定性起着至关重要的作用。
总之,硫化物SE本身具有还原性和可燃性,会导致严重的放热反应。当它与Li0.5CoO2 和阳极材料Li混合时,容易发生剧烈的燃烧。因此,考虑到在高温下硫化物SE和阴极材料之间可能发生放热反应甚至燃烧,即使在完全惰性的气氛中,硫化物ASSB也不是绝对的热安全。
因此,研究硫化物SE和阴极材料之间的热稳定性是必要的,而且具有实际意义,这有利于深入分析ASSB的热安全性。 典型硫化物SE和钴酸锂之间的热稳定性 以前的工作详细报道了硫化物SE在加热过程中会发生不同的分解反应,其起始温度远远低于氧化物SE的温度。
例如,Li7P3S11 在大约300℃时显示出明显的硫沉淀,并有初步的分解产物(Li3PS4 ,Li2PS3 ,和S)。分解产物Li3PS4 将进一步分解为Li2S和S,这几乎是所有硫化物SE的常见反应产物。Li2S和S都有很强的还原性和可燃性。在一定温度下,这些分解产物可能直接与Li1–xCoO2 接触,并导致放热反应或燃烧。
为了研究这一过程,将这些硫化物SE(Li2S/S)和LiCoO2 的分解产物密封在石英管中,并加热到设定的温度(图2a)。混合粉末的颜色随着温度的升高而逐渐加深,表明这些分解产物和LiCoO2 之间发生了一些反应。此外,根据颜色的变化和石英管的腐蚀情况,它们在S和LiCoO2 之间的反应似乎比Li2S的反应更激烈。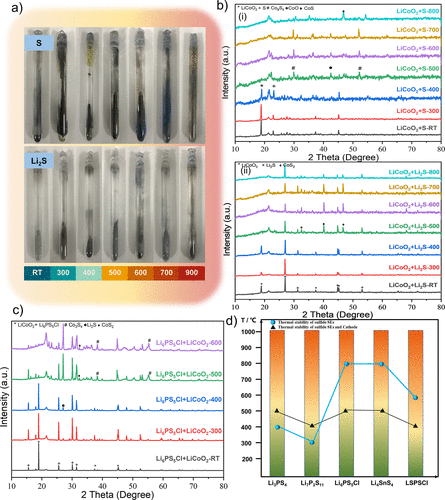
图2.硫化物SEs和LiCoO2 之间的热稳定性实验。(a) 硫化物SEs(S/Li2S)和LiCoO2 的主要分解产物之间的加热反应的实验照片。(b) (i和ii)加热上述混合粉末后的产品的XRD图谱。(c) 在不同温度下加热Li6PS5Cl + LiCoO2 混合粉末得到的产品的XRD图谱。(d) 典型的硫化物SE(如Li3PS4 , Li6PS5Cl, Li7P3S11 , Li4SnS4 , LSPSCl)和硫化物SE + LiCoO2 的混合粉末的热稳定性。蓝色球体指的是硫化物SE的热稳定性,黑色三角形指的是硫化物SE和LiCoO2之间的热稳定性。
为了进一步确定分解产物(Li2S/S)和LiCoO2 之间的氧化还原反应的热力学反应产物,通过X射线衍射(XRD)对其产物的相分析进行了表征(图2b)。图2b-i显示了S和LiCoO2 的反应产物的XRD图谱。在300℃以下没有发现其他物质的衍射峰,表明在这个温度范围内LiCoO2 和S之间没有反应。当温度上升到400℃时,LiCoO2 的主峰强度明显下降,这与结晶性差的S的衍射峰强度非常接近。
因此,LiCoO2 和S的化学反应的起始温度可能在400℃左右。当温度达到500-700℃时,LiCoO2 的主峰完全消失,杂质峰(Co9S8 ,CoO和CoS)逐渐加强。当温度上升到800℃时,CoS峰变得突出,表明部分CoO与S进一步反应,形成CoS。从XRD图谱可以得出结论,S和LiCoO2 在300-400℃开始反应,主要的反应产物是Co9S8 ,CoO和CoS。
图2b-ii显示了Li2S和LiCoO2 的反应产物的XRD图谱。与S + LiCoO2 的反应不同,Li2S在400℃以下没有与LiCoO2 反应。然而,LiCoO2 的主峰在500 °C时突然消失,同时出现了杂质CoS2 的峰。提高到800℃后,杂质峰的强度减弱,而Li2S峰加强,这可能是由于Li2S在此温度下的再结晶造成的。
通过比较Li2S/S和LiCoO2 之间反应产物的XRD图谱,可以推断出S与LiCoO2 的反应比Li2S更严重。此外,这两个反应过程产生不同的热力学产物。S和LiCoO2 的反应产物主要是Co9S8 、CoO和CoS,而Li2S和LiCoO2 的反应产物则主要是CoS2 。
根据分解产物(S/Li2S)和LiCoO2 的热稳定性实验结果,系统地研究了硫化物SE和LiCoO2 之间的热稳定性。文献中报道的硫化物SE主要是Li3PS4 、Li6PS5Cl、Li7P3S11 、Li4SnS4 和LSPSCl,它们具有不同的晶体结构和离子传导性。
例如,Li3PS4 是γ-Li3PO4 结构(空间群:Pmn21 ),Li6PS5Cl 是具有Ag8GeS6 结构(空间群:F4̅3m)的Argyrodite类型, Li7P3S11 是高离子传导性Ag7P3S11 结构(空间群。P1̅),Li4SnS4 是一种高空气稳定性的Ag8GeS6 结构(空间群:Pnma),LSPSCl是一种超离子导电的LGPS结构(空间群:P42 /nmc)。
将这些混合粉末加热到指定温度后,通过XRD对其反应产物的晶体结构演变进行了表征,从中推断出化学反应过程。LiCoO的主要衍射[003]峰2 ,其强度最高,可作为化学反应的一个指标。Li6PS5Cl和LiCoO2 的热稳定性的实验结果总结在图2c。
结果显示,Li6PS5Cl和LiCoO2 在400℃以下没有化学反应,除了少量的Li2S杂质峰。当温度上升到500-600℃时,LiCoO2 的主峰逐渐减弱,而反应产物(Co3S4 ,CoS2 , Li2S)的衍射峰加强。因此,Li6PS5Cl和LiCoO2 之间的化学反应也发生在大约500℃,并在600℃完成,这与Li3PS4 和LiCoO2 之间的现象相似。
实验结果表明,不同的硫化物SE和LiCoO2 之间的热分解产物和反应温度是不同的。例如,Li3PS4 ,Li6PS5Cl和Li4SnS4 系统在500℃时开始反应,而Li7P3S11 和LSPSCl系统则在400℃。这一现象似乎与硫化物SE的热稳定性和分解产物密切相关。
通过分析硫化物SE和LiCoO2 的热稳定性,Li3PS4 、Li6PS5Cl和Li4SnS4 的反应起始温度非常接近,而Li7P3S11 和LSPSCl的反应起始温度则相对较低。大多数硫化物SE与LiCoO2 在400-500℃时发生反应,这与Li2S/S和LiCoO2 的热稳定性相似。
例如,这些硫化物SE在500℃时的主要Co-S分解产物是Co9S8 ,这与S和LiCoO2 的情况相同。因此,推测分解产物在这些典型的硫化物SE和LiCoO的反应中起着重要作用2 。根据以前的实验,可以推断出S与氧化物阴极的反应性要高于Li2S。
因此,推测Li7P3S11 和LiCoO2 在400℃下的反应是由Li7P3S11 本身及其分解产物S的热稳定性差引起的。此外,由于Li6PS5Cl具有良好的热稳定性,其分解产物主要是Li2S,Li6PS5Cl和LiCoO2 的初始反应温度更高(约500℃)。此外,反应产物主要是Co3S4 、CoS2 、Li2S,这与Li2S和LiCoO2 的反应产物类似。
图2c实验结果(黑色实心三角)和硫化物SEs的初始分解温度(蓝色实心球)被系统地总结在图2d。发现硫化物SEs和LiCoO2 之间的热稳定性与硫化物SEs有关。容易分解的硫化物SEs经常在低温下与LiCoO2 材料发生反应,而高稳定性的硫化物SEs则不会。
此外,值得注意的是,Li3PS4 /Li7P3S11 的分解温度低于它们与LiCoO2 的初始反应温度,而Li6PS5Cl/Li4SnS4 /LSPSCl 则相反。这一现象表明,硫化物SE的分解产物将影响它们与LiCoO2 的热反应,这与它们固有的热稳定性不同。此外,对于热稳定性差的Li3PS4 和Li7P3S11 ,它们的分解产物主导了它们与LiCoO2 的热化学反应,使得与它们直接接触的化学反应变得次要。
对于Li6PS5Cl, Li4SnS4 , 和具有良好热稳定性的LSPSCl,其反应顺序正好相反。 根据上述实验,发现硫化物SE和LiCoO2 之间的化学反应过程分为两个过程。一个是两个反应物之间的直接接触,而另一个是涉及硫化物SEs的热分解产物的化学反应,没有直接接触。
为了分离这两个反应过程,设计并实施了它们没有直接接触的热稳定性实验(图3)。为了实现两种反应物的完全分离,硫化物SE被压成紧凑的颗粒,并卡在石英管的中间,以避免与底部的LiCoO2 的直接接触。然后将特别设计的石英管加热到500℃,根据以前的实验,这相当于启动反应的温度。
在实验操作过程中,石英管被烧毁,在LiCoO2 和硫化物SE之间形成一个物理间隔(约3-8cm)。密封的石英管可以提供一个无干扰的纯净实验环境(H2O≤0.1ppm,O2 ≤0.1ppm),尽可能减少意外污染对实验结果的干扰。通过表征Li6PS5Cl和Li(更敏感)在密封前后的结构变化,也验证了密封操作过程的可靠性。
此外,通过EDX检测Li6PS5Cl粒子表面的组成。结果发现,Li6PS5Cl的形态和成分在密封前后没有明显变化,这进一步证实了密封操作过程的可靠性。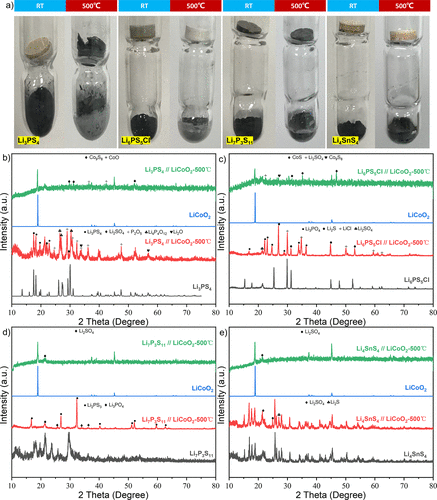
图3.硫化物SE和LiCoO2 间接接触的热稳定性实验。(a) 典型的硫化物SE颗粒和LiCoO2 粉末在加热前和加热后的照片(硫化物SE在上面,LiCoO2 在下面)。(b-e) 这些SEs颗粒和LiCoO2 在间接接触热处理之前和之后的XRD图谱。 图3a显示了在这个特殊装置中加热前和加热后的照片对比。
尽管硫化物SEs颗粒没有与LiCoO2 接触,但在加热过程中,它们的颜色在反应后仍然发生了很大变化。在加热前后对硫化物SEs和LiCoO2 进行了XRD测试,以研究其结构和相变。图3b显示了Li3PS4 和LiCoO2 的结果。加热后LiCoO2 的主要衍射峰没有大的变化,但出现了杂质Co9S8 峰,根据上述实验结果,这可能是LiCoO2 和S的反应产物。
同时,Li3PS4 峰消失了,而Li2SO4 ,P2O5 ,Li4P4O12 ,Li2O 峰出现了(图3b)。这证明了Li3PS4 和LiCoO2 之间的热反应不需要直接接触。
由Li3PS4 产生的分解产物S将优先挥发,然后扩散到阴极材料,诱发与LiCoO2 的氧化还原反应。更有趣的是,LiCoO2 本身在500℃下不会分解或释放氧气,但分解产物(汽化的S)会与LiCoO2 反应,释放出结构受损的O2 气体。然后这种O2 气体会再次与Li3PS4 反应,以促进其分解。
在研究NMC和Li3PS4 的热稳定性时,Tsukasaki等人发现NMC分解成过渡金属硫化物并释放出O2 ,然后Li3PS4 被氧化成Li3PO4 。这个过程与这里观察到的实验证据非常相似。图3c总结了热处理前后Li6PS5Cl和LiCoO2 (无直接接触)的XRD图谱。
加热后,LiCoO2 的[003]峰强度下降,出现了杂质Co9S8 、CoS和Li2SO4 的衍射峰。Li6PS5Cl峰几乎消失,而Li3PO4 、Li2S、LiCl和Li2SO4 峰显现出来。与Li3PS4 和LiCoO2 之间的反应类似,即使Li6PS5Cl和LiCoO2 没有直接接触,少量的挥发性分解产物也会通过扩散过程引起严重的化学反应。
Li7P3S11 和LiCoO2 的实验结果在图3d中展示。LiCoO2 的[003]峰强度明显下降,同时出现了一个杂质峰(Li2SO4 )。Li7P3S11 也转变为Li3PO4 和Li2PS3 。对于Li4SnS4 + LiCoO2 的混合物,LiCoO2 的演变行为与Li7P3S11 + LiCoO2 的演变行为一致(图3e)。
不同的是,Li4SnS4 的主要衍射峰在反应后没有明显变化,但Li2S和Li2SO4 的少量杂质峰出现了。Tsukasaki等人认为,根据 "软硬酸碱理论"(HSAB),Sn是一种比P更软的酸,导致Li4SnS4 对O2 的稳定性高于其他硫化物SE。为了进一步分析硫化物SE和LiCoO2 的两种反应机制,对直接/间接接触化学反应的实验结果进行了比较和分析。
当Li4SnS4 + LiCoO2 的混合粉末被加热到500℃时,LiCoO2 的峰值会明显消失,表明Li4SnS4 和LiCoO2 的直接接触会引起化学反应。然而,在间接接触实验中,Li4SnS4 可以在相同的温度下保持其结构。
因此,对于Li4SnS4 和LiCoO2 之间的热化学反应,直接接触的化学反应可能优先于涉及分解产物的化学反应。另一方面,硫化物SE的空气稳定性在与氧化物阴极材料的热化学反应中也起到了不可忽视的作用。 结论是,即使硫化物SE和氧化物阴极材料(Li1–xCoO2 )没有直接接触,也会通过挥发性的分解产物发生严重的化学反应,这些分解产物主要是由硫化物SE/阴极材料分解产生的S/O化合物。
本节的实验结果表明,硫化物SE和Li1–xCoO2 之间存在两类反应过程(即直接接触反应和间接接触反应)。其中,硫化物SEs及其分解产物的热稳定性在间接接触反应中起着重要作用。
热稳定性差的SE,如Li3PS4 和Li7P3S11 ,在间接接触化学反应中优先与LiCoO2 ,而不是直接接触过程。对于具有良好热稳定性的SE,如Li6PS5Cl和Li4SnS4 ,直接接触的化学反应将优先于间接接触过程。此外,硫化物SE的空气稳定性在涉及分解产物的化学反应中也起着不可忽视的作用,这与HSAB理论一致。
典型硫化物SE和脱锂阴极Li1–xCoO2之间的热稳定性 氧化物阴极材料的热稳定性将随着其脱锂程度的加深而恶化。在对液体LIB的热稳定性研究中,热失控时释放的主要热源是脱锂电极和LE的燃烧热。因此,对脱锂电极材料和电解质之间的热稳定性的研究也很有意义。
为了探索典型的硫化物SE(Li3PS4 , Li6PS5Cl, Li7P3S11 , Li4SnS4 , LSPSCl)和Li1–xCoO2 之间的热稳定性关系,在相同的条件下,采用上述的实验方法分析其晶体结构随直接/间接接触的演变(图4和5)。在研究材料的热稳定性时,化学脱锂是获得脱锂电极材料的一种非常普遍的方法。选择这种方法制备Li1–xCoO2 样品的原因是为了避免电化学过程中粘合剂、导电添加剂和电解质的影响,并满足本实验的用量。
通过化学脱锂法制备了不同脱锂状态的Li1–xCoO2 (x = 0.3, 0.5),如图4a所示。通过电感耦合等离子体光谱(ICP)测试了脱锂的Li1–xCoO2 的Li和Co元素,以评估脱锂材料的制备情况。结果发现,通过化学脱锂方法制备的不同脱锂Li1–xCoO2 (x = 0, 0.3, 0.5)粉末符合设计要求,没有其他杂质。通过SEM-EDX对化学脱锂的Li0.7CoO2 粉末的形态和表面组成进行了分析,如图4b所示。
发现LiCoO2 的颗粒结构有少量的层状裂纹,这与脱锂后的层状氧化物阴极的结构变化相似。颗粒表面没有明显的异常杂质元素,这表明通过化学脱锂法制备的脱锂阴极Li1–xCoO2 具有较高的纯度。图4c中比较了不同脱锂状态的Li1–xCoO2 (x = 0, 0.3, 0.5)的XRD图。
发现当x = 0.5时,虽然LiCoO2 的主要结构仍然存在,但主峰的强度减弱,并转移到一个较低的角度。从不同脱锂状态的Li1–xCoO2 的TG图谱可以发现,随着脱锂程度的加深(x = 0.5),Li1–xCoO2 的失重现象更加严重。这是因为Li1–xCoO2 中的O的稳定性随着锂离子的缺乏而越来越差,随着温度的升高,氧气逐渐释放出来。
比较Li6PS5Cl和Li1–xCoO2 (x = 0, 0.3, 0.5)在不同温度下的反应产物的XRD图谱(图2c,图4d),可以发现Li6PS5Cl和LiCoO2 在400℃时没有发生化学反应,甚至在500℃时LiCoO2 的主峰依然保持。当温度达到300℃时,混合粉末(Li0.7CoO2 + Li6PS5Cl)的衍射图谱没有明显变化,而Li0.5CoO2 混合粉末则出现了明显的杂质峰(26.9°, 36.1°)。将温度提高到400℃,LiCoO2 的主峰完全消失,取而代之的是脱锂状态研究体系中的杂质(Co3S4 ,Li2S,CoS2 ,P2O5 )。
杂质类型与LiCoO2 和Li2S的反应产物一致(图2b)。随着温度的升高,Li6PS5Cl和Li1–xCoO2 (x = 0, 0.3, 0.5)混合粉末的演化行为最终趋于一致。脱锂的Li1–xCoO2 会比LiCoO2 更容易与硫化物SE反应,这与它们不稳定的晶体结构和可氧化性密切相关。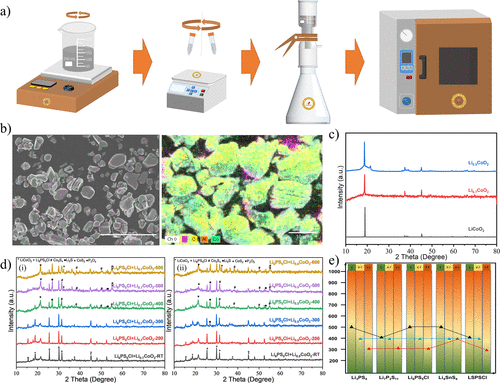
图4.不同脱锂状态的Li1–xCoO2 和典型的硫化物SE(Li3PS4 , Li6PS5Cl, Li7P3S11 , Li4SnS4 , LSPSCl)之间的热稳定性。(a)用化学方法制备不同脱锂状态的Li1–xCoO2 的原理图。(b) 通过SEM-EDX分析化学脱锂的Li0.7CoO2 粉末的形态和表面组成。(c) 具有不同脱锂状态的Li1–xCoO2 的XRD图谱。(d) 热处理后的Li6PS5Cl和Li1–xCoO2 的XRD图谱:(i) Li0.7CoO2 和(ii) Li0.5CoO2 。(e) 混合粉末(硫化物SE和Li1–xCoO2 )的稳定性趋势。黑色、蓝色和红色的三角形分别指LiCoO2 、Li0.7CoO2 和Li0.5CoO2 。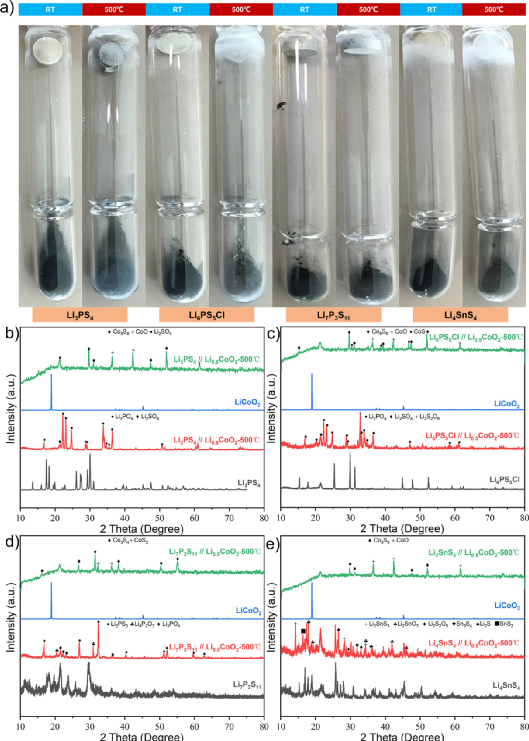
图5.脱锂的Li0.5CoO2 的热稳定性,不与硫化物SE直接接触。(a) 典型的硫化物SE颗粒(Li3PS4 , Li6PS5Cl, Li7P3S11 , Li4SnS4 )和Li0.5CoO2 热处理前后的照片。(b-e) 硫化物SE和Li0.5CoO2 在热处理之前和之后不直接接触的反应产物的XRD图谱。 图4e总结了不同脱锂状态(x = 0, 0.3, 0.5)的Li1–xCoO2 和硫化物SE之间的热稳定性结果。随着x的增加,Li1–xCoO2 和硫化物SEs之间的初始反应温度被降低了。原因是Li1–xCoO2 的氧化性提高,O在晶体结构中的稳定性降低,更容易释放。
Yamaki等人发现,随着脱锂程度的加深,氧化物阴极材料的热稳定性逐渐退化,脱锂的氧化物阴极在加热过程中会逐渐释放氧气。MacNei等人认为,Li0.5CoO2 的热分解过程如下。Li0.5CoO2 → 1/2 LiCoO2 + 1/6Co3O4 + 1/6O2 。由于Li4SnS4 对H2O和O2 有很高的耐受性,Li4SnS4 与Li0.5CoO2 /Li0.7CoO2 的初始反应温度接近(约400℃)。
同样,Li7P3S11 与LiCoO2 /Li0.7CoO2 之间的反应起始温度也是一样的,但主要是由于Li7P3S11 产生S的稳定性差。总之,Li1–xCoO2 和硫化物SE之间的热稳定性受到硫化物SE本身的热稳定性、Li1–xCoO2 的氧化作用、挥发性分解产物和硫化物SE的空气稳定性(由HSAB理论决定)的影响。
根据上述实验结果(图3),LiCoO2 在低温下会释放氧气,并在硫化物SE的分解产物的影响下氧化硫化物SE。由于Li0.5CoO2 比Li0.7CoO2 更容易释放O2 ,它与硫化物SEs的热反应可能更剧烈。
因此,用上述类似的方法对LiCoO2 (具有不同的脱锂状态)和硫化物SE之间的热稳定性进行了描述。图5a中的结果显示了硫化物SE颗粒的明显反应。有趣的是,与图3中的不同,Li0.5CoO2 粉末的颜色变浅,粉末表面出现白色颗粒,这在与Li6PS5Cl的反应中尤为明显。
为了获得热处理后无直接接触的结构变化,对反应前后的粉末进行了XRD测试。图5b显示了Li3PS4 和Li0.5CoO2 热处理前后反应产物的XRD图。
Li0.5CoO2 主要转化为Co9S8 、CoO、Li2SO4 等,Li3PS4 转化为Li3PO4 和少量的Li2SO4 。对于Li6PS5Cl + Li0.5CoO2 混合物(图5c),Li0.5CoO2 主要转化为Co9S8 、CoO、CoS等,而Li6PS5Cl在加热到500℃时,变为Li3PO4 、Li2S2O6 和Li2SO4 。对于Li7P3S11 + Li0.5CoO2 (图5d),Li0.5CoO2 完全变为Co3S4 和CoS2, ,而Li7P3S11 转化为Li2PS3 , Li4P2O7 , 和Li3PO4 。对于Li4SnS4 + Li0.5CoO2 (图5e),Li0.5CoO2 全部转化为Co9S8 和CoO,Li2S2O5 , Li2SnS3 , Li2SnO3 ,Sn3S4 , Li2S,SnS2 , 等,是Li4SnS4 的主要产物。
与Li3PS4 + LiCoO2 的热化学反应相比,Li3PS4 和Li0.5CoO2 的反应更加激烈和完整。图3b显示,LiCoO2 + Li3PS4 的主要结构的衍射峰在500℃时保持不变,但在图5b中Li0.5CoO2 + Li3PS4 的衍射峰完全消失了。这表明Li0.5CoO2 在较低的温度下释放出更多的氧气,从而促进了反应的进行。
关于Li6PS5Cl和Li4SnS4 ,也观察到同样的实验结果。然而,不同的是,Li7P3S11 和LiCoO2 /Li0.5CoO2 之间的实验结果相同,这是因为Li7P3S11 的热稳定性差。此外,尽管Li4SnS4 对氧气有很好的稳定性,但Li0.5CoO2 的大量氧气仍然可以破坏Sn-S键,形成Sn-O键(Li2SnO3 )。
总之,Li1–xCoO2 不仅与硫化物SEs直接反应,而且即使没有直接接触,也会释放出大量的氧气来进一步氧化硫化物SEs。Li1–xCoO2 和硫化物SEs之间化学反应的强度与它们的脱锂程度密切相关。因此,可以合理地认为,脱锂的Li1–xCoO2 分解释放的氧气即使没有直接接触也更容易扩散,并诱发更严重的热稳定性问题或热失控。
硫化物SE和Li1–xCoO2之间的反应动力学
到目前为止,关于硫化物SEs的热稳定性的动力学机制很少被研究。为了补充这些数据,通过DSC技术研究了氧化物阴极材料和硫化物SEs混合粉末在不同状态下的放热过程。通过基辛格方法分析DSC结果,得到了化学反应的动力学参数(即频率因子A和活化能Ea )。
活化能和频率因子是描述化学动力学的关键参数,指的是热化学反应中所需要的能量和有效分子间碰撞的频率。对它们的准确估计对描述LIB成分在高温下的热不稳定性具有重要意义。基辛格方法是一种动力学分析工具,已被广泛用于从不同扫描速率的DSC光谱中提取这两个值。这两个值与实验数据之间的关系如下。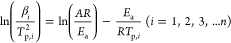
其中,βi 代表温度扫描率,Tp,i 是反应峰值温度,A是频率因子,R是通用气体常数,Ea 代表活化能。i表示从1到n的试验数。用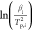 与
与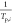 的线性拟合揭示了活化能和频率因子的基本信息,通过计算直线的斜率和垂直截距可以分别确定其数值。 比较了不同脱锂状态的Li6PS5Cl + Li1–xCoO2 (x = 0, 0.3, 0.5)混合粉末的DSC光谱(图6a)。
的线性拟合揭示了活化能和频率因子的基本信息,通过计算直线的斜率和垂直截距可以分别确定其数值。 比较了不同脱锂状态的Li6PS5Cl + Li1–xCoO2 (x = 0, 0.3, 0.5)混合粉末的DSC光谱(图6a)。
在LiCoO2 + Li6PS5Cl混合粉末中发现了两个放热峰。第一个峰值开始于大约375℃,最大热通量信号在400℃,而第二个峰值开始于大约450℃,最大热通量信号在大约475℃。然而,Li1–xCoO2 (x = 0.3, 0.5)和Li6PS5Cl混合粉末有多个放热峰。第一个放热峰的起始温度下降到200℃,峰值温度约为225℃。
类似的现象也发生在其他硫化物SE(Li3PS4 , Li7P3S11 , Li4SnS4 , LSPSCl),相应的放热峰用红色箭头标识。图6b总结了这些硫化物SE+Li1–xCoO2 (x = 0, 0.3, 0.5)的混合物的第一个放热峰的开始和峰值温度。结果表明,随着脱锂程度的加深,它们的放热反应将在较低的温度(150-200℃)下得到促进。
这充分证明了可燃物(硫化物SE)和氧化剂(氧化物阴极材料)在不同的脱锂状态下可以在适当的温度范围内诱发放热反应。有趣的是,这些温度明显低于图4e中的温度。这是因为DSC的精度/灵敏度比马弗炉和XRD测试的温度控制要高得多。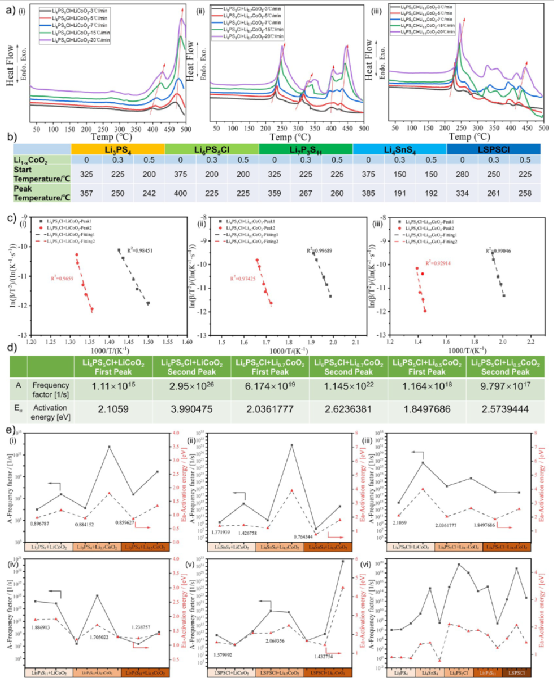
图6.Li1–xCoO2 (x = 0, 0.3, 0.5)和典型的硫化物SE之间化学反应的动力学特征测试。(a) Li1–xCoO2 + Li6PS5Cl混合粉末在不同加热速率(3, 5, 7, 15, 20 °C/min)下的DSC曲线。(b) 不同硫化物SEs + Li1–xCoO2 混合粉末的DSC曲线中第一个放热峰的对应温度。(c, d) Li1–xCoO2 + Li6PS5Cl混合粉末的热分析数据(基辛格法)。(e) 其化学反应的频率因子A和活化能Ea 。 采用基辛格法测定了Li1–xCoO2 + Li6PS5Cl混合粉末的活化能Ea 和频率因子A(图6)。为了提高拟合精度,在混合粉体的多个峰中选择峰形最好的放热峰。
LiCoO2 + Li6PS5Cl混合粉末的第一和第二峰的频率因子和活化能分别为A1 = 1.11 × 1015S–1 , Ea1 = 2.1059 eV和A2 = 2.95 × 1026S–1 , Ea2 = 3.990475 eV。这意味着第一个放热过程更容易发生,但第二个放热过程引起的碰撞频率更高。或者说,第一个放热过程常常作为链式反应的起点,而第二个放热过程促进了反应过程,因为它的反应速率最高。Li0.7CoO2 + Li6PS5Cl混合物的第一个峰的频率因子和活化能为A1 = 6.174 × 1019S–1 ,Ea1 = 2.0361777 eV,第二个峰的频率因子和活化能为A2 = 1.145 × 1022S–1 ,Ea2 = 2.6236381 eV。
第一个放热峰的活化能明显低于LiCoO2 + Li6PS5Cl混合物的活化能,而频率因子更高,这证实了上述实验结果。对于Li0.5CoO2 + Li6PS5Cl混合物,动力学参数为A1 = 1.164 × 1018S–1 和 Ea1 = 1.8497686 eV(对于第一个峰值)和A2 = 9.797 × 1017S–1 和 Ea2 = 2.5739444 eV(对于第二个峰值)。较大的频率因子和最小的活化能表明在三种脱锂状态中,Li0.5CoO2 和Li6PS5Cl之间的反应最为剧烈,这与之前的现象一致。 图6e中总结了典型的硫化物SEs和Li1–xCoO2 (x = 0, 0.3, 0.5)的所有动力学参数。
总的来说,Li1–xCoO2 和硫化物SE之间的热反应可以分为两个过程。第一个放热过程显示出较低的活化能Ea 和较低的频率因子A,表明这个过程是一个起始反应过程,很容易发生,但反应速率很低。相反,第二个放热过程往往具有较高的活化能Ea 和较高的频率因子A,表明这个过程是一个剧烈的反应过程,不容易发生,但反应速率高。但也有例外,如Li7P3S11 + Li1–xCoO2 (x = 0, 0.3)和LSPSCl + Li1–xCoO2 (x = 0, 0.3)。
在LSPSCl + LiCoO2 混合物的三个不同的放热过程中,第二个放热过程的活化能最低(Ea = 1.4546 eV),第一个放热过程的频率因子较高(A = 2.63 × 1012S–1 ),第三个放热过程的频率因子最高(A = 3.06 × 1013S–1 )。同样,在LSPSCl + Li0.7CoO2 混合物的三个不同的放热过程中,第三个放热过程的活化能最低(Ea = 1.645073 eV),而第一个放热过程的频率因子最高(A = 9.05 × 1018S–1 )。
这表明LSPSCl和Li1–xCoO2 (x = 0, 0.3)的第一个过程促进了反应过程,释放了热量,并引发了后续的放热反应。在Li7P3S11 和Li1–xCoO2 (x = 0, 0.3)混合物中,也是第一个放热过程加速了后续反应。这些与图4e中的结果一致,即Li7P3S11 /LSPSCl + Li1–xCoO2 (x = 0, 0.3)的热稳定性差。从机理上看,硫化SE和Li1–xCoO2 之间的热稳定性是由反应热力学和动力学共同决定的,其中Li7P3S11 /LSPSCl和Li1–xCoO2 之间的热稳定性受反应动力学的影响很大。
阻断硫化物SE和钴酸锂之间的热化学反应
通过间接接触实验,发现硫化物SE通过挥发性分解产物与氧化物阴极材料相互作用。从脱锂的Li1–xCoO2 释放的氧气会加剧这一反应过程。为了进一步确认挥发性分解产物在这一过程中的作用,又进行了一个实验,以验证控制分解产物是否会减缓反应。在实时清除挥发性分解产物的前提下,设计了一个小型加热装置来处理硫化物SE和Li1–xCoO2 ,如图7a所示。
利用真空泵和压力控制阀使装有样品的石英管达到一定的真空度,并在整个反应过程中实时去除挥发性分解产物。为了避免真空系统对非挥发性分解产物的干扰,石英管被部分地冷却了。这消除了硫化物SE和Li1–xCoO2 加热过程中挥发性分解产物的干扰。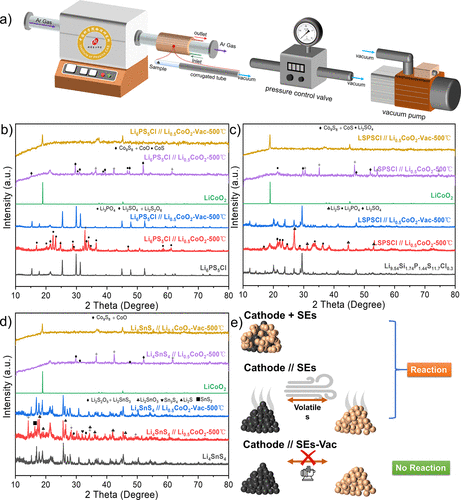
图7.脱锂的Li0.5CoO2 和典型的硫化物SEs之间没有直接接触反应的真空实验。(a) 脱锂Li1–xCoO2 和硫化物SEs之间无直接接触的真空实验示意图,使用真空泵和压力控制阀来实时保持石英管中的真空度。(b-d) Li0.5CoO2 和硫化物SEs、Li6PS5Cl、LSPSCl和Li4SnS4 之间间接接触实验的XRD衍射图。(e) 通过去除挥发性分解产物抑制氧化还原反应进展的机制图。 间接接触实验显示,Li4SnS4 + LiCoO2 和Li4SnS4 + Li0.5CoO2 之间存在很大差异,这很可能是由Li1–xCoO2 的氧气释放差异引起的。
为了进一步证实这一推论,我们选择了在500℃下结构稳定的硫化物SE(Li4SnS4 , Li6PS5Cl, LSPSCl)与Li0.5CoO2 进行真空实验,不直接接触。更重要的是,根据上面的实验结果,这些硫化物SE和Li1–xCoO2 之间的热化学反应主要是通过直接接触进行的。
因此,可以确保本研究中的主要变量是Li1–xCoO2 所释放的氧气。对这三种硫化物SE与Li1–xCoO2 (x=0,0.5)进行XRD测试,研究结构变化(图7b-d)。在间接接触的条件下,Li6PS5Cl(图7b)被完全氧化为Li3PO4 ,Li2SO4 ,Li2S2O6 等,Li0.5CoO2 被完全还原为Co9S8 ,CoO,CoS等。
然而,在真空系统中,Li6PS5Cl和Li0.5CoO2 保持了它们的原始结构。这表明,当挥发性分解产物的运输被切断时,Li6PS5Cl和Li0.5CoO2 的分解会被抑制,它们之间的反应也会被抑制。
在图7c中,在间接接触条件下,LSPSCl仍然被氧化成Li2S, Li3PO4 , Li2SO4 等,其衍射峰完全消失,而Li0.5CoO2 被分解成Co9S8 ,CoS和Li2SO4 ,没有任何原始衍射峰。然而,LSPSCl-Li0.5CoO2 的分解被真空系统明显抑制。在图7d中,具有较好空气稳定性的Li4SnS4 在间接接触条件下与Li0.5CoO2 共聚时,分解为Li2SnS3 ,Li2SnO3 ,Sn3S4 ,Li2S和SnS2 ,而Li4SnS4 + Li0.5CoO2 的衍射峰在真空体系中保持不变。
图7e是硫化物SEs和Li1–xCoO2 在高温下的反应过程示意图。根据以前的实验结果,典型的硫化物SE和Li1–xCoO2 之间会发生严重的放热化学反应。即使它们没有直接接触,也会通过挥发性的分解产物发生化学反应。这个过程与阴极的脱锂状态和硫化物SE本身的热稳定性密切相关。
这与上面的实验结论是一致的。在图3c和e中,Li6PS5Cl/Li4SnS4 和LiCoO2 间接接触的热稳定性结果表明,即使温度远低于Li6PS5Cl和Li4SnS4 的分解温度,其极少量的自我分解产物也会促进其反应。通过真空系统去除硫化物SE的挥发性分解产物,硫化物SE/Li1–xCoO2 的热分解和两种成分之间的化学反应都将受到抑制。
因此,可以通过真空系统或使用吸附剂去除分解反应释放的氧气和硫磺,以防止发生更严重的放热反应(热失控行为)。换句话说,硫化物SE基ASSB的热安全性可以得到有效改善。 在LiCoO2 和Li4SnS4 的间接接触实验中,发现Li4SnS4 的主要衍射峰在反应前后没有变化,只有Li2S 和Li2SO4 的极少量的杂质峰出现。
因此,这里进一步采用了阴极涂层的方法来防止LiCoO2 和Li4SnS4 之间的直接接触,这样可以有效地抑制热反应。
具体来说,Li2O-ZrO2 -涂层的LiCoO2 @LZO(LZO═Li2O-ZrO2 )是通过溶胶-凝胶法制备的,然后与Li4SnS4 混合并进行热处理。图8b显示了LiCoO2 + Li4SnS4 混合粉末在不同温度下的XRD图谱,从中可以看出它们的热化学反应发生在500℃。
然而,在图8c中,Li4SnS4 和LiCoO2 @LZO的主要峰在500℃时仍然存在,这样它们之间没有发生剧烈的热化学反应。结论是,表面涂层可以在一定程度上有效改善硫化物ASSB的界面热稳定性。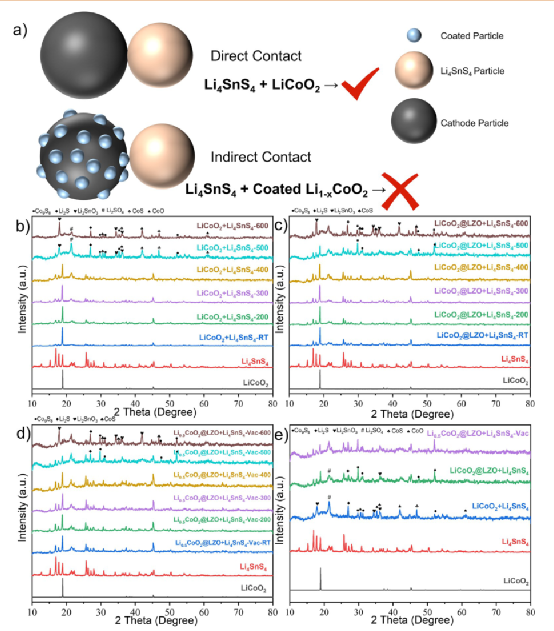
图8.表面涂层的LiCoO2 和Li4SnS4 的热稳定性实验。(a) 未涂层/涂层的LiCoO2 和Li4SnS4 的反应示
意图。(b) LiCoO2 和 Li4SnS4 混合粉末的XRD图谱。(c) LiCoO2 @LZO和Li4SnS4 混合粉末的XRD图谱。(d) LiCoO2 @LZO和Li4SnS4 混合粉末在真空中热处理后的XRD图谱。(e) 未涂层/涂层的LiCoO2 和Li4SnS4 混合粉末在500℃下的XRD结果比较。
此外,结合真空系统,涂层也适用于脱锂的LiCoO2 。Li0.5CoO2 可以在500℃下与Li4SnS4 发生反应,而不需要直接接触,因为它的可氧化性增加了,不管两个成分之间的距离如何。然而,在没有直接接触的真空实验中,Li4SnS4 和Li0.5CoO2 可以在500 °C下保持其原始结构。对于Li0.5CoO2 @LZO + Li4SnS4 混合物,当温度低于400℃时,在真空系统中它们之间没有发生明显的化学反应(图8d)。当温度达到500℃时,只有少量的杂质出现,Li0.5CoO2 和Li4SnS4 的主要衍射峰仍然存在。
直到温度达到600℃,大量的杂质峰出现,Li0.5CoO2 和Li4SnS4 的主要衍射峰相对较弱。因此,Li0.5CoO2 @LZO +Li4SnS4 混合粉末之间的化学反应将在真空系统中被抑制。 图8e总结了上述不同实验条件下混合粉体在500℃下的XRD图谱。该涂层技术可以实现对硫化物SE和LiCoO2 ,有效隔离挥发性分解产物,从而抑制其热化学反应。
这种涂层技术并不限制涂层材料的种类和制备方法。本工作中应用的LZO主要是因为其适当的离子传导性、方便和低成本。此外,一些有效的涂层也值得考虑,如LiNbO3 ,TaO3 ,Al2O3 ,TiO2 ,Li2SiO3 ,Li4Ti5O12 ,LiTaO3 ,LiAlO2 ,Li3 AlF6 ,LiAl5O8 ,以及MgSiO2 。图8d显示了无涂层/有涂层的LiCoO2 和Li4SnS4 之间的反应过程。随着脱锂程度的加深,涂层技术本身不能有效抑制热化学反应。然而,如果结合额外的真空系统,硫化物SE和脱锂的Li1–xCoO2 之间的热化学反应可以有效减少。
尽管真空系统对于小规模的电池系统来说很难实现,但在电池组或电池模块的规模上,它并不特别难实现。此外,能够去除挥发性分解产物的吸附剂也可以发挥真空系统的作用,在电池层面改善硫化物SE和电极材料的热稳定性。 涂层方法可以有效地改善硫化物SE和氧化物阴极材料之间的热稳定性,抑制它们的热化学反应。
然而,涂层是否会影响电池的电化学性能也值得研究。特别的有报道说,LZO可以大大改善硫化物ASSBs中LiNi1/3Mn1/3Co1/3O2 的性能。因此,LIBs(LE:1 M LiPF6 -EC/EMC)和ASSBs(SE:Li6PS5Cl)以金属锂为阳极,LiCoO2 /LiCoO2 @LZO为阴极组装起来进行电化学性能测试(图9)。
令人惊讶的是,LiCoO2 @LZO在LIBs中的性能不如LiCoO2 (图9a)。LiCoO2 /LiCoO2 @LZO LIBs的第一、第五和第八周期的放电容量分别为183.4/171.7 mAh g–1 ,183.1/170.5 mAh g–1 ,和176.8/139.2 mAh g–1 。同时,它们的初始库仑效率分别为94.9%和93.7%,在第80个周期的容量保持率分别为96.4%和81.1%。
只有当充电的截止电压降低到4.2V时,放电容量保持率才能得到适当的改善。这可能是由于在溶胶-凝胶制备过程中,LiCoO2 的轻微腐蚀和LZO涂层的电子传导性差。然而,LiCoO2 @LZO在ASSB中的性能是相当可观的(图9b)。LiCoO2 /LiCoO2 @LZO ASSBs的第一和第五周期的放电容量分别为118.9/121.9 mAh g–1 和 115.8/120.8 mAh g–1 。
最初的库仑效率分别为93.8%和91.8%,这与LIB的性能接近。LiCoO2 @LZO ASSB即使在高的充电截止电压(4.5V)下,仍然有85.9%的初始库仑效率和167.6 mAh g–1 的放电容量。在速率性能测试中,即使在4C的速率下,LiCoO2 @LZO ASSB仍然保持110.1 mAh g–1 的放电容量,容量保持率为90.1%(与0.5C相比)。
经过250次循环,它仍然保持107.3 mAh g–1 ,而LiCoO2 ASSB的放电容量只有91.3 mAh g–1 ,容量保持率为76.3%(与0.5C相比,图9c,d)。总之,虽然通过溶胶-凝胶法得到的LiCoO2 @LZO有一定程度的容量衰减,但仍能有效防止与硫化物SE的界面反应,在ASSB中具有优良的电化学性能。
在保证原有氧化物阴极材料电化学性能的前提下,通过优化涂层制备方法,在表面形成有效的隔离层,硫化物ASSB的热稳定性和电化学性能将得到极大改善。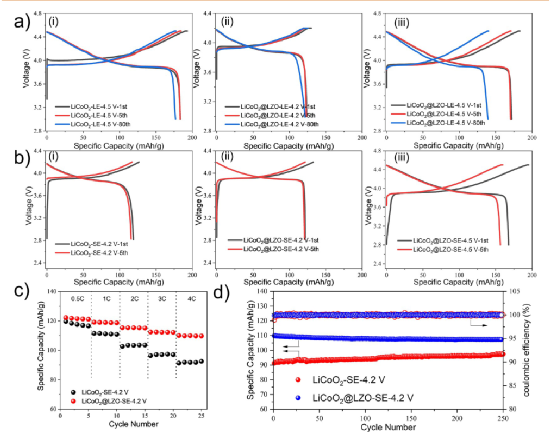
图9.LiCoO2 /LiCoO2 @LZO 的电化学性能,包括循环和速率性能。(a) LIBs中的电化学性能(LE:1 M LiPF6 -EC/EMC),(i) LiCoO2 4.5V,(ii) LiCoO2 @LZO 4.2V,(iii) LiCoO2 @LZO 4.5V。(b) ASSBs(SE:Li6PS5Cl)的电化学性能,(i)LiCoO2 4.2V,(ii)LiCoO2 @LZO 4.2V,(iii)LiCoO2 @LZO 4.5V。(c)这些ASSBs的速率性能比较。所有的ASSB都在55±3°C的2.5-4.2V的电压范围内进行测试。(d) 这些ASSB的长期循环性能的比较(4C,1C=135 mA g–1 )。
【结论】
电化学储能技术的快速发展和电动汽车的快速推广,对储能装置提出了更高的安全要求。与传统的挥发性/易燃性LEs相比,SEs和ASSBs被认为是相对安全的。在发现LAGP和金属锂之间的剧烈燃烧反应后,SEs和ASSBs的热稳定性已成为该领域的主要关注点和热门研究课题。
然而,由于硫化物SEs的稳定性差、腐蚀性强、对测试环境/仪器的要求苛刻,对其进行热研究的报道很少。本文专门设计了两种热处理方法(即直接接触和间接接触),系统地研究了典型硫化物SEs(Li3PS4 , Li7P3S11 , Li6PS5Cl, LSPSCl, Li4SnS4 )和Li1–xCoO2 不同脱锂状态的热力学和动力学特征。
主要结论如下:
(1)发现硫化物SE具有一定的还原性/可燃性,在电池的热失控过程中可以作为可燃物使用。当它们与电极材料混合时,将发生明显的剧烈燃烧。
(2)展示了典型的硫化物SE和LiCoO2之间的热稳定性规律。结果表明,它们热反应的初始温度范围为400-500℃,分解产物在这个热化学反应过程中起着重要作用。即使没有直接接触,硫化物SEs和Li1–xCoO2 之间也会通过挥发性分解产物发生热化学反应。此外,热稳定性差的硫化物SE更倾向于涉及分解产物的热化学反应,而热稳定性好的硫化物SE则更喜欢直接接触的热化学反应。
(3)验证了典型的硫化物SE和不同脱锂状态的Li1–xCoO2 之间的热稳定性规律。结果表明,它们的热稳定性受到硫化物SEs本身的热稳定性、Li1–xCoO2 的氧化特性、挥发性分解产物以及它们的空气稳定性(由HSAB理论决定)的影响。与原始的LiCoO2 相比,脱锂的Li1–xCoO2 具有更高的氧化性能,而且与硫化物SE的热稳定性更差。此外,由于深度脱锂的Li1–xCoO2 释放出大量的氧气,即使没有直接接触,也能氧化高度空气稳定的Li4SnS4 。
(4)通过基辛格方法得到了其热化学反应的两个关键动力学参数(活化能和频率因子)。发现化学反应主要分为两个阶段,即起始反应过程和剧烈反应过程。起始反应过程容易发生,但反应速率低,而剧烈反应过程不容易发生,但反应速率高。因此,硫化SE和Li1–xCoO2 之间的热稳定性由反应热力学和反应动力学共同决定,其中Li7P3S11 /LSPSCl和Li1–xCoO2 之间的热稳定性受反应动力学影响很大。
(5)应用真空系统成功地消除了挥发性分解产物对硫化物SE和Li1–xCoO2 的影响,抑制了单一成分的热分解。从实际应用的角度来看,硫化物SE和Li1–xCoO2 之间的热化学反应可以通过阴极涂层技术、反应产物吸收剂或真空系统的应用得到有效抑制。更重要的是,通过优化涂层材料和制备技术,可以提高ASSB的电化学性能和热稳定性。
虽然上述研究成果从反应热力学和动力学方面证明了硫化物SEs与氧化层阴极之间的热稳定性特征,但仍有丰富的反应机理和反应驱动力需要从不同角度进一步探索。硫化物SEs和氧化物阴极之间的整体反应过程需要详细地逐步解构,需要挖掘出决定性的反应步骤,这决定了提高它们之间热稳定性的关键方向。
对于这些化学反应中的热量、结构、成分、分解产物的有害性(毒性和可燃性)、驱动力等因素,需要更加系统地进行探讨和总结。值得注意的是,本研究中使用的表征方法非常普遍,提供的信息往往不充分,这与硫化物的强挥发性和腐蚀性密切相关。因此,迫切需要开发适合硫化物SE和ASSB的热表征技术,从不同的物理角度丰富信息。
此外,还有必要开发硫化物SEs的表面结构和非晶态成分的微观分析技术。综上所述,我们希望利用我们常用的表征方法,系统地研究典型的硫化物SE和氧化物阴极之间的一系列热稳定性规律,提供一些有价值的参考,并作为该领域未来研究的指南。
审核编辑:刘清
-
钽元素赋能LLZO固态电解质,破解氧化物固态电池产业化密码2025-05-26 2070
-
清华大学:自由空间对硫化物固态电解质表面及内部裂纹处锂沉积行为的影响2025-02-14 798
-
氧化物布局格局一览 氧化物电解质何以撑起全固态?2024-05-16 2424
-
利用三甲基硅化合物改善硫酸盐固态电解质与阴极材料的界面稳定性2023-11-01 2677
-
锂-固态电解质界面如何与堆叠压力演变相关2023-04-13 1892
-
定义充放电离子输运通量概念在固态电池领域的重要作用2023-03-16 3038
-
聚合物电解质离子电导率及界面稳定性的影响因素2023-02-03 5309
-
“梯度包覆策略“,助力高性能全固态锂电池!2023-01-30 3354
-
关于全固态锂金属电池的高性能硫化物电解质2023-01-16 3600
-
固态电池电解质的分类及性能对比2022-11-30 19708
-
关于高空气稳定性的硫化物固态电解质2022-11-02 5877
-
基于氧化物固态电解质的钠电池(OSSBs)的研究进展介绍2022-09-16 3848
-
原位固态化聚合物电解质基高性能准固态软包锂电池2022-06-22 10476
-
固态电池产业化赛道上正在不断涌现新选手2020-11-24 2212
全部0条评论

快来发表一下你的评论吧 !

