

浅析双室微流控芯片用于再现胰腺导管腺癌微环境
描述
胰腺导管腺癌(PDAC)占源胰腺癌症的93%。PDAC被认为是所有癌症中最致命的,并且预后极差。PDAC患者总体上表现出高度的分子肿瘤异质性,使治疗复杂化,并阻碍了临床试验的成功。
目前的体外技术不能充分复制PDAC肿瘤微环境(TMEs)中复杂的基质成分,也不能模拟给定肿瘤的独特遗传表型。因此目前迫切需要开发一种利用肿瘤相关信息预测药物反应的个性化治疗方法。
鉴于此,美国芝加哥拉什大学Faraz Bishehsari教授团队开发了一种肿瘤芯片装置,通过结合患者衍生类器官(PDOs)和基质细胞,特别是胰腺星状细胞(PSCs)和巨噬细胞(U937),成功建立了一个复杂的包含纤维增生间质和免疫细胞的肿瘤环境,延长了PDOs细胞功能和寿命,且证明了靶向基质导致对癌细胞的化疗效果显著增加,从而验证了该肿瘤芯片装置用于药物测试的可行性。
首先,研究人员通过细针活检(FNB)收集PDAC患者的活检样本,经过培养使其在3D基质胶环境中形成球形类器官。
H&E和上皮细胞粘附分子(EpCAM)染色实验验证了类器官细胞与原始组织在结构和功能上的一致性。将基质细胞(PSCs和U937)和类器官共培养,U937和类器官发生双向诱导增殖,且类器官平均直径均明显大于单独培养时,免疫荧光成像显示PSCs分泌了更多的胶原蛋白。
并且在MIA PaCa-2细胞(一种胰腺细胞系)中也观察到癌细胞和U937细胞在共培养时的双向增殖效应。
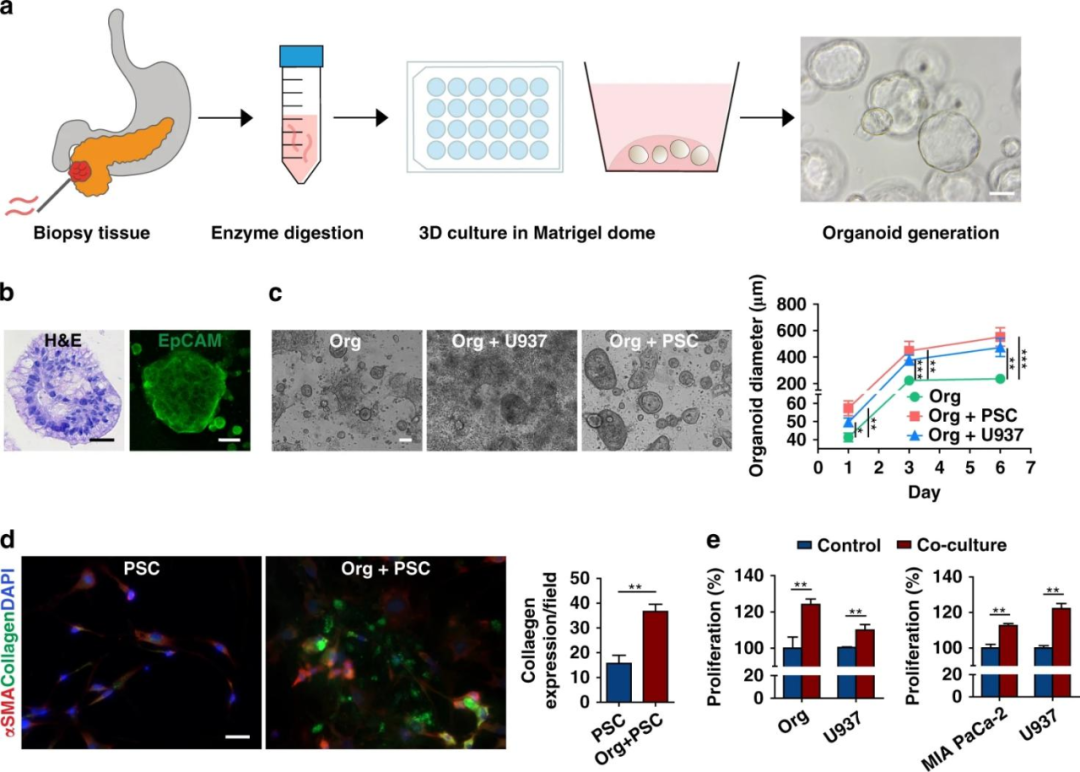
图1 患者来源的类器官(PDOs)的增殖特性,以及与基质细胞的双向促进作用
肿瘤细胞的侵袭性实验显示PCCs在与基质细胞共培养时迁移的距离更大,同时H&E和EpCAM染色证实了迁移的细胞是PCCs。该实验表明共培养时基质细胞能诱导PCCs的侵袭性。
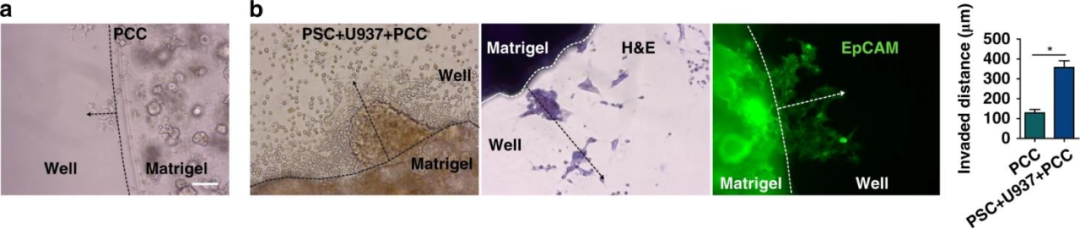
图2 基质细胞增加了癌变上皮细胞(PDOs)的侵袭性
该微流控芯片由两个被多孔膜隔开的腔室组成,从上部腔室的入口装载细胞,下层的腔室入口通过导管与含有培养基(有机类培养基∶RPMI=1∶1)的注射器相连,注射器与泵相连以5ul/h的流速持续灌注介质。为了观察PCCs的生长情况,将2000个类器官悬浮于50%基质胶中,载入每个芯片的上腔室,培养1周后,类器官从球形转化为二维(2D)结构,这些细胞被称为PCCs。
PCCs在16天内占据了该室的整个内部空间。最初,类有机物由基质凝胶支撑,以保持芯片中的3D球形结构,但最终转变成2D层,这可能是基质胶降解的结果。
接下来研究人员进行了活-死生存实验证明了芯片表明2D细胞的存活,同时癌变上皮细胞膜中EpCAM和pERK的表达水平也表明了细胞存活和生长。随后的共培养和药物治疗研究实验均在3D类器官仍存在的9天内进行。
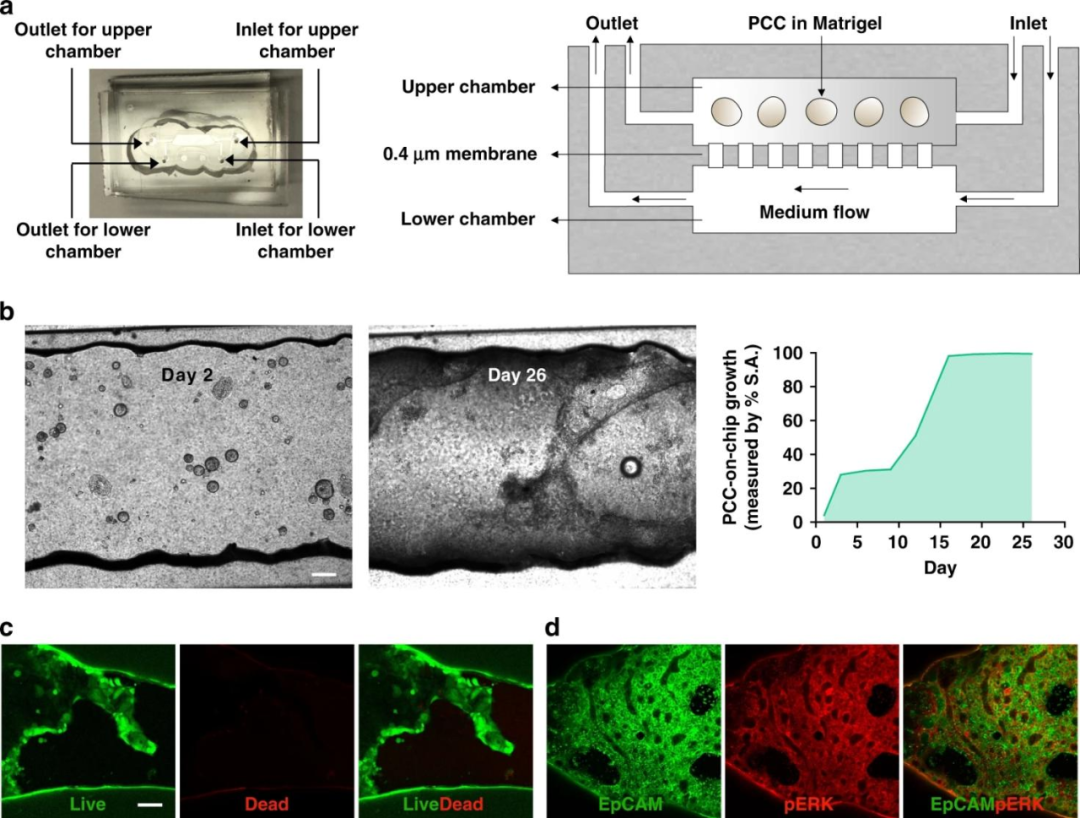
图3 一种用于PDOs的培养和生长的双室微流控芯片
为了概括PDAC TME的特征,研究人员将基质细胞与PCCs结合,并将它们加载到芯片的上腔。在共培养6天里,PCCs生长并发生结缔组织塑性反应。到第6天,基质细胞共培养芯片中的PCC生长明显快于单独培养时,占据了腔室空间的83.6%,证实了基质对芯片中PCC增殖的影响。
与芯片相比,细胞的平行多孔板共培养显示出显著较低的癌细胞生长,这进一步支持了使用芯片作为一个优越的平台来再现癌细胞的旺盛生长。
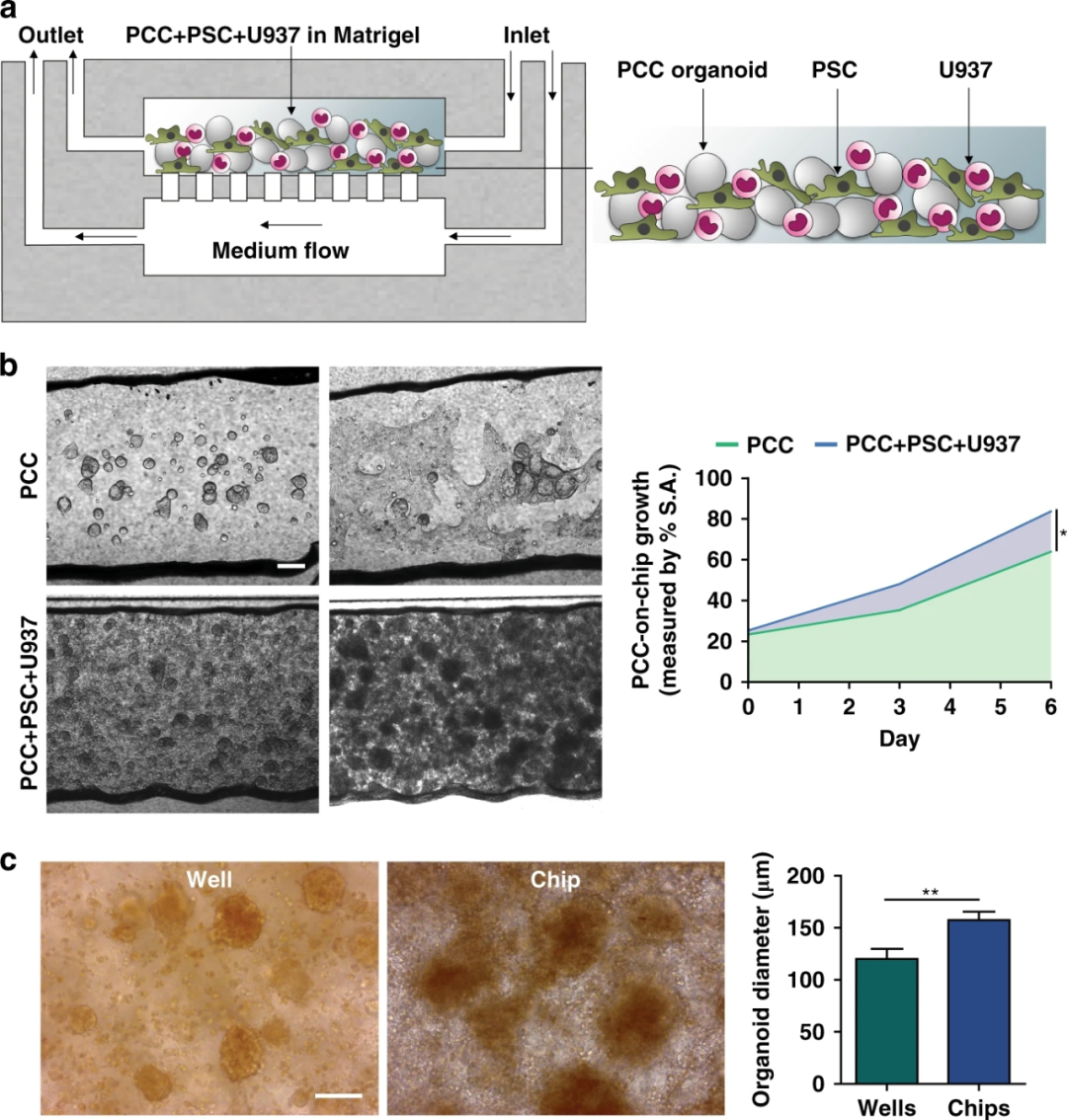
图4 原发癌细胞(PCC)与基质细胞在芯片上的生长
明场成像和H&E染色显示了PCCs与芯片中基质细胞的密切相互作用。U937细胞和PSCs中CD68和α-平滑肌肌动蛋白(α-SMA)的染色分别揭示了PCCs周围基质细胞的存在。
同时几种标记物在基因表达水平上进一步表征了共培养的PSCs和U937细胞。
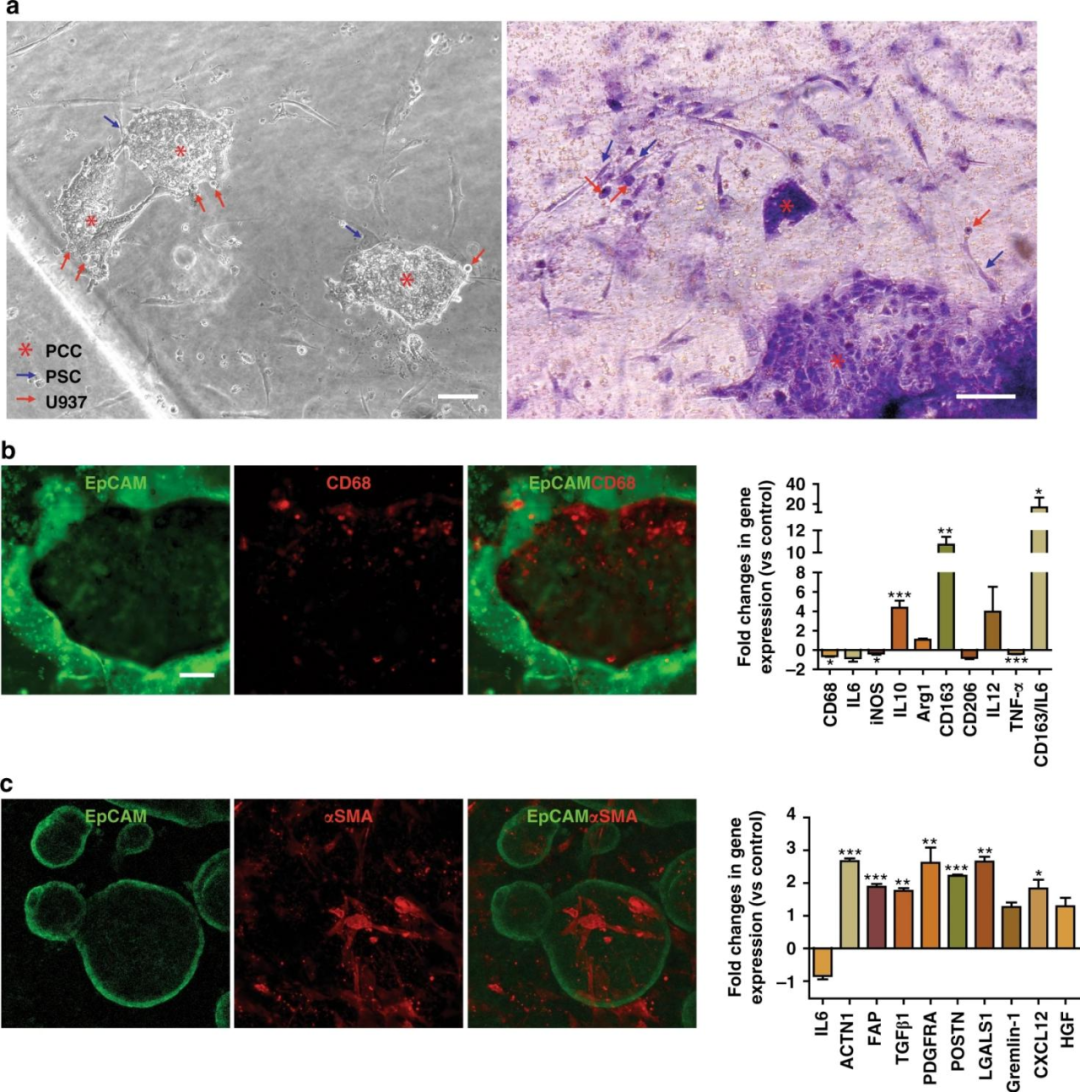
图5 在芯片中PDAC TME的再现
为了表征芯片的药物反应测试功能,研究人员首先分别在PSCs、U937细胞和类器官中测定了ATRA、Clodrosome和吉西他滨的IC50值。且实验表明基质消耗剂的IC50值不影响PCCs或MIA PaCa-2细胞的存活力。
用来自一名患者的类器官考查PCCs的体外药物反应,将细胞与基质细胞一起接种到芯片中,培养6天后,将吉西他滨或吉西他滨与ATRA和Clodrosome以其IC50值灌注芯片72h,然后在第9天PFA固定和染色,与未经治疗相比,吉西他滨诱导的PCC Caspase-3表达可评估显著的PCC凋亡。结果显示,在肿瘤芯片模型中,TME调节剂对化疗的抗肿瘤疗效有增强作用。
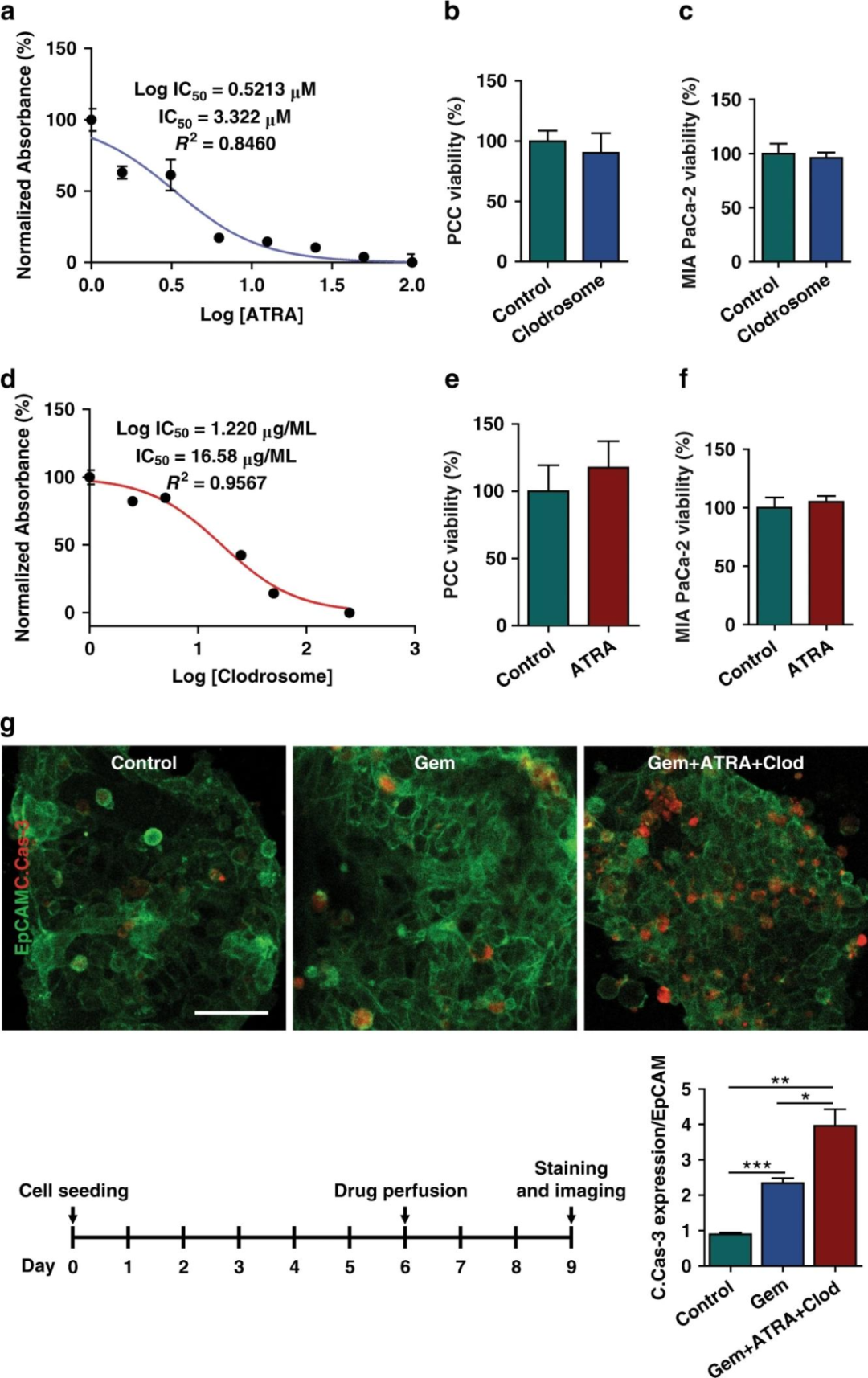
图6 基质消耗在化疗反应中的影响
在这项研究中,研究人员开发了一种最先进的多细胞组织芯片模型,该模型显示了原代PDOs长期细胞存活率的提高,证实了基质细胞在PDAC恶化中的显著影响,以及癌性上皮细胞通过胶原沉积和癌症相关基因表达劫持基质细胞功能以创造有利TME的能力。
PDOs和基质细胞在微流控芯片装置中的共培养可再现特定患者的TME,因此可用于在临床应用前在实验室中评估任何抗癌药物的敏感性。最后,可通过提供所需的技术数据来设计可以优化药物反应的生物测定工具,从而推进PDAC个性化/精准医疗的实施。
论文链接:
https://doi.org/10.1038/s41378-022-00370-6
审核编辑:刘清
-
研究高通量纳米传感器精准检测胰腺癌,提升早期诊断能力。2025-02-20 746
-
常用的微流控芯片类型2024-11-21 1590
-
S型微流控芯片的优势2024-11-01 1168
-
微流控阵列芯片和普通芯片的区别2024-10-30 1220
-
PDMS微流控芯片和PMMA微流控芯片的区别2024-09-25 1799
-
玻璃微流控芯片前景分析2024-07-21 1363
-
AMEYA360报道:微流控芯片基地可年产芯片1亿片!#微流控芯片#器官芯片 #体外诊断 #微流控芯片模具jf_09983350 2023-07-13
-
基于液滴微流体的微流控芯片系统的研究2022-03-02 6176
-
普渡大学研发出微流控芯片,胰腺癌药物发展能更进一步2020-11-13 2055
-
微流控芯片的清洗_微流控芯片的类型2020-04-10 4253
-
胰腺癌使用机器人手术更安全 但也并非适用于所有的患者2020-03-06 3190
-
微流控分析芯片2018-06-22 2411
-
微流控芯片制作方法详解2018-05-10 38530
全部0条评论

快来发表一下你的评论吧 !

