

锂金属电池用高阳离子转移数聚合物电解质
电池技术
描述
研究背景
消费电子产品和电动汽车的迅速普及,以及可再生能源并入电网,对具有优越电化学性能的储能技术产生了很高的需求。固态锂(Li)金属电池(LMB)有望大幅提升能量密度(锂金属负极,双极堆叠设计)和安全性(无液体泄漏,减少火灾危险)。
在不同类型的固体电解质中,聚合物电解质(PE)具有独特的优点:与固体电极界面接触较好,适合大规模生产,柔性。大多数PE由溶解在大分子溶剂(即聚合物链)中的锂盐组成。因此,阳离子和阴离子都可以移动。虽然两种离子的参与传输确实使离子电导率更高,但当电流密度超过各自的阈值时,非活性阴离子的传输将在电池中造成严重的浓差极化,这将阻止电池在高倍率下工作。
成果简介
近日,北京化工大学曹鹏飞教授和南开大学杨化滨研究员在ACS Energy Lett.上发表了题为“A Polymer Electrolyte with High Cationic Transport Number for Safe and Stable Solid Li-Metal Batteries”的论文。该工作通过锂盐存在下常规离子导电单体和单离子导电单体的原位共聚来设计HTPE。HTPE,即聚(VEC10-r-LiSTFSI),具有高的阳离子转移数(0.73),高离子导电性(1.60 mS cm-1),高临界电流密度(10 mA cm-2)和高的正极稳定性(5 V)。
用HTPE构建的锂金属电池在1C下循环1200次后,容量保持率高达70%,它还能在较宽的温度范围和高载量下工作。先进的表征和计算表明,高tLi+和高离子导电性有效地抑制了Li枝晶的生长,避免了大多数聚合物电解质的浓差极化。
研究亮点
(1)本工作通过分子和离子单体在锂盐的存在下共聚,获得高阳离子转移数(tLi+)聚合物电解质(HTPE)。
(2)这种高tLi+聚合物电解质具有高的阳离子转移数(0.73),高离子导电性(1.60 mS cm-1),高临界电流密度(10 mA cm-2)和高的正极稳定性(5 V)。
(3)模拟结果证实,HTPE比PVEC能提供更高的Li溶剂化程度。HTPE中的锚定STFSI-和LiTFSI盐中的TFSI-具有与Li+相近的结合能,具有较高的可溶性和阳离子转移数,即获得高离子导电性和阳离子转移数,同时抑制Li枝晶生长。
图文导读
由于含碳酸盐的五元环上有一个下垂的烯烃基团,且在室温下具有液体性质,因此选择VEC单体原位形成聚合物电解质(示意图1a)。在LiTFSI盐和热引发剂的存在下,通过VEC和LiSTFSI的聚合合成了HTPE,以下称为聚(VEC-r-LiSTFSI)。
VEC与LiSTFSI摩尔比为5:1、10:1和20:1的聚(VEC-r-LiSTFSI)分别被标记为聚(VEC5-r-LiSTFSI)、聚(VEC10-r-LiSTFSI)和聚(VEC20-r-LiSTFSI)。作为参考,在相同的反应条件下,在LiTFSI盐的存在下,VEC单体聚合生成了聚氯乙烯碳酸酯(PVEC),其中阴离子运动不受阻碍。
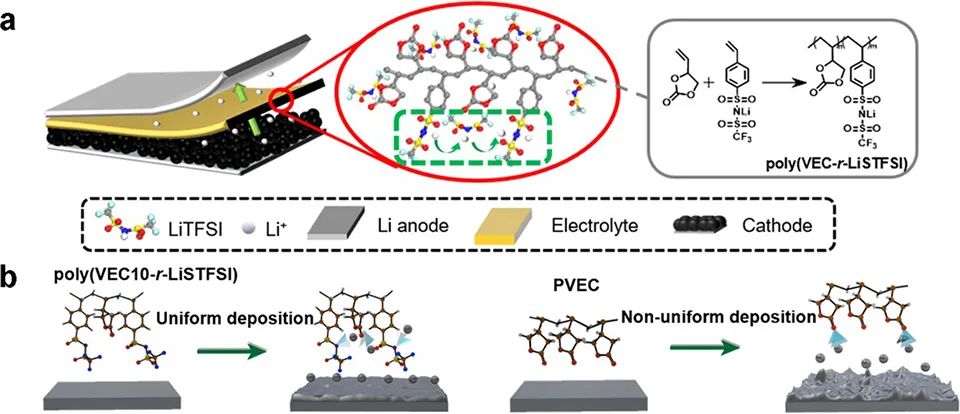
示意图1、HTPE的设计和制备:(a)聚(VEC-r-LiSTFSI)的合成。(b)聚(VEC10-r-LiSTFSI)和PVEC中Li+在Li负极上的电化学沉积示意图。
聚(VEC10-r-LiSTFSI)和PVEC的玻璃化转变温度(Tg)分别为−43和−9.0°C(图1a)。在不同温度下,PVEC和聚(VEC10-r-LiSTFSI)的链段弛豫时间由流变学估算(图1b)。在1000 s的链段弛豫下,聚(VEC10-r-LiSTFSI)和PVEC的Tg分别为−40.5和−5.4°C,与DSC的结果一致。
在30°C时,聚(VEC10-r-LiSTFSI)(~10-7 s)比PVEC(~10-3 s)表现出更快的链段动力学。DSC曲线相对较低的Tg可能是由于两个样品中都存在低聚物和单体,这有助于快速链段动力学。与PVEC相比,聚(VEC10-r-LiSTFSI)的Tg较低,可能是由于相对较低的单体转化率和更多的低聚物的存在。在室温下,聚(VEC10-r-LiSTFSI)和PVEC的储存模量相对较低(G′<1 MPa),因此不太可能通过剪切机械强度抑制Li0枝晶(图1c)。
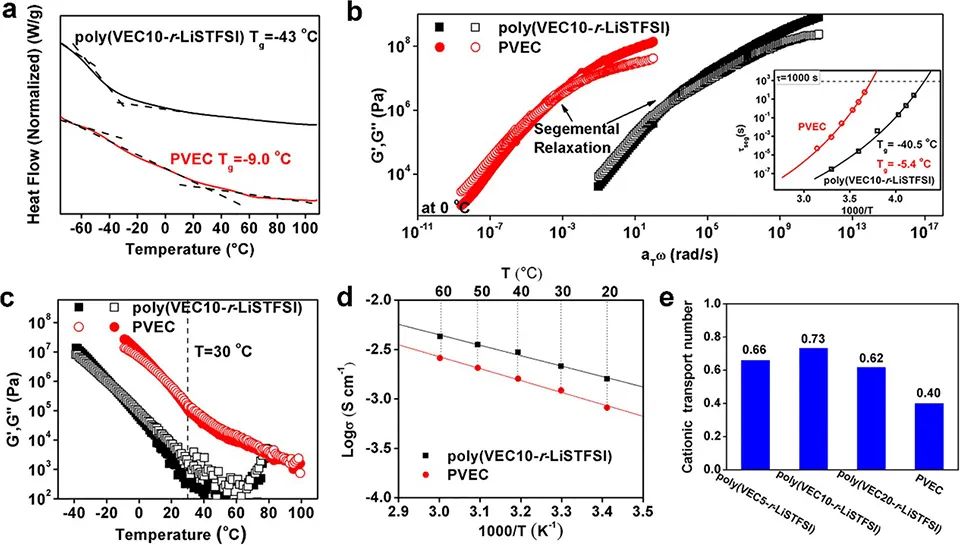
图 1、(a)聚(VEC10-r-LiSTFSI)和PVEC的DSC曲线。(b) 在0°C下,聚(VEC10-r-LiSTFSI)和PVEC的存储模量G’和损耗模量G”。(c)剪切模量的存储和损失部分的温度扫描实验。(d) 在20至60℃下,PVEC和聚(VEC10-r-LiSTFSI)的Arrhenius图。(e)聚(VEC-r-LiSTFSI)和PVEC的tLi+值。
为了研究其离子导电性,将与玻璃纤维复合的聚(VEC10-r-LiSTFSI)与不锈钢(SS)组装在对称电池中,然后通过电化学阻抗谱(EIS)对其进行评估。在20°C下,聚(VEC10-r-LiSTFSI)和PVEC分别具有1.60和0.816 mS cm-1的离子电导率(图1d),远高于基于醚键的PE。
离子电导率的温度依赖性表现出典型的阿伦尼乌斯型行为,并且聚(VEC10-r-LiSTFSI)在宽温度范围内表现出高离子电导率。聚(VEC10-r-LiSTFSI)的tLi+值为0.73,远高于PVEC(tLi+≈0.40)(图1e)。
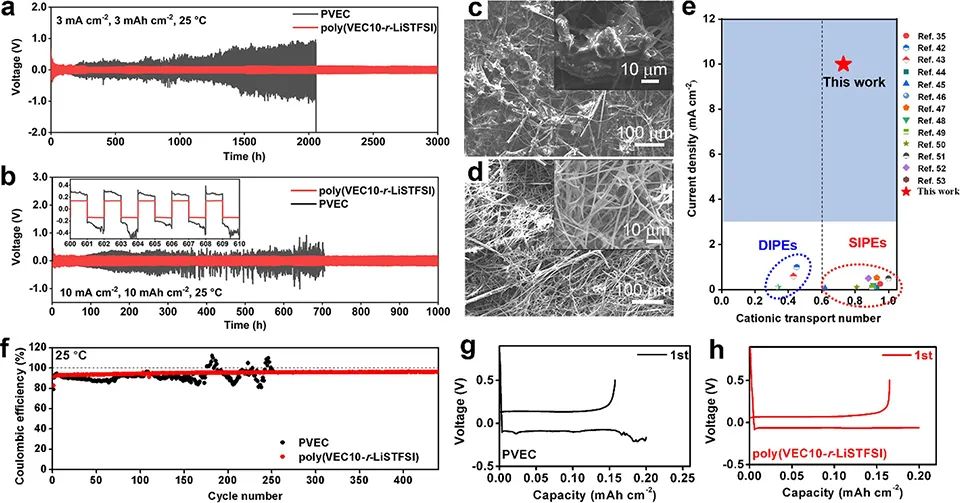
图 2、在(a)3 mA cm-2和(b)10 mA cm-2下,Li/聚(VEC10-r-LiSTFSI)/Li和Li/PVEC/Li电池的剥离/电镀曲线。循环20小时后,(c)PVEC和(d)聚(VEC10-r-LiSTFSI)的表面。(e)SIPEs和其他普通PEs(DIPEs)在以往研究中的电流密度比较。在0.2 mA cm-2@0.2 mAh cm-2下,(f)不同聚合物电解质Li/Cu电池的的库仑效率。含(g)PVEC和(h)聚(VEC10-r-LiSTFSI)的Li/Cu电池电压曲线。
图2a显示,在25°C下,Li/聚(VEC10-r-LiSTFSI)/Li电池表现出较低的过电位。在3 mA cm-2下能够稳定循环超过3000小时。而Li/PVEC/Li电池有更大的过电位。此外,即使在10 mA cm-2(图2b),Li/聚(VEC10-r-LiSTFSI)/Li电池仍能稳定循环超过1000小时。
在报道的PEs中,能够耐受如此高的电流密度是非常罕见的,特别是对于那些具有高阳离子转移数的聚合物电解质(图2e)。 图2f显示,Li/PVEC/Cu电池的初始库伦效率和平均库伦效率(100循环)分别为79%和86%。相比之下,Li/聚(VEC10-r-LiSTFSI)/Cu电池的CE随循环次数增加而增加,100次循环后稳定在94%以上,表明Li沉积更加均匀。
以PVEC为电解质的Cu的电压平台在初始循环波动明显,具有较高的极化电压,而Li/聚(VEC10-r-LiSTFSI)/Cu电池则保持平稳稳定的电压分布,表明电极-电解质界面稳定(图2g,h)。
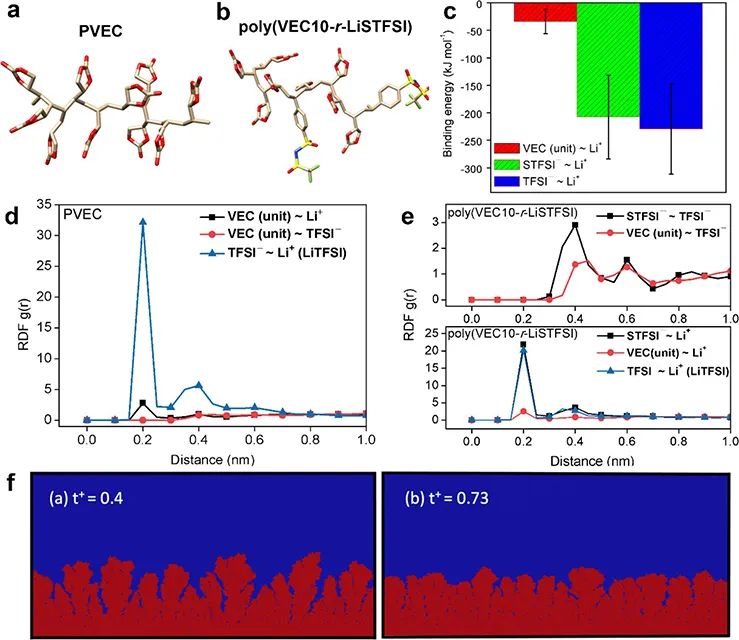
图 3、(a)用于模拟的PVEC分子构型。(b)用于模拟的聚(VEC10-r-LiSTFSI)分子构型。(c)VEC与Li+、STFSI-与Li+、TFSI-与Li+之间的结合能。(d)PVEC仿真系统的RDF。(e)聚(VEC10-r-LiSTFSI)仿真系统的RDF。(f)不同tLi+数下,枝晶生长和形态的计算结果((a) PVEC(tLi+=0.4);(b)聚(VEC10-r-LiSTFSI)(tLi+=0.73))。
接下来进行了分子动力学模拟,以证明聚(VEC10-r-LiSTFSI)的溶剂化环境(图3)。结合能计算(图3c)显示,与TFSI-相比,PVEC与Li+的结合能力较低。从图3d中径向分布函数(RDF)的分子/离子分布可以看出,只有少量的Li+与PVEC配位,大部分Li+仍然结合在TFSI-上(蓝色曲线)。
TFSI-和Li+的紧密结合使得LiTFSI的可解离性较低。此外,在0.25 nm附近的小峰(黑色曲线)表明,PVEC对Li+的结合力高于TFSI-。这些结果表明PVEC具有较低的Li+解离能力和迁移率。与PVEC相比,由于接枝的STFSI-单元和无TFSI-阴离子与Li+的结合能相当(图3c),含LiTFSI的聚(VEC10-r-LiSTFSI)体系可以使Li+在接枝的STFSI-单元与无TFSI-的阴离子之间轻松迁移,从而实现高度的Li+溶剂化,从而提高离子导电性。
也有报道称,如果聚合物对离子的结合能力太强,离子迁移率就会降低。由于PVEC对Li+的结合能高于对TFSI-的结合能。因此,阳离子的迁移率会略低于阴离子的迁移率。对于聚(VEC10-r-LiSTFSI),当聚合物链上接枝大量STFSI-单元时,整体阴离子迁移率会降低,从而产生较高的阳离子转移数。
这突出了使用STFSI-和VEC作为共聚单体的优势。STFSI-和TFSI-对Li+的结合能差小,使得Li离子可以很容易地跨越能垒,在STFSI-单元和TFSI-负离子之间迁移,增加了阳离子转移数,同时保持了较高的溶剂化程度。 这些模拟结果表明,与PVEC相比,聚(VEC10-r-LiSTFSI)基质中Li盐的更高的可溶性和转移数量与聚(VEC10-r-LiSTFSI)和TFSI-周围Li离子的相对数量有关。
此外,聚(VEC10-r-LiSTFSI)与TFSI-的高度相互作用(图3d和图3e)也会降低阴离子的迁移率,提高阳离子的转移数。 为了更好地理解tLi+对枝晶生长的影响,通过电极-电解质界面计算模型进行了计算建模。
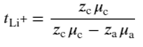
-
锂金属电池室温固态聚合物电解质的锂离子传导机制2023-04-15 4028
-
聚合物电解质离子电导率及界面稳定性的影响因素2023-02-03 5254
-
固态电解质引入特殊官能团实现高电压锂金属固态电池2022-11-16 4230
-
氟化石墨烯增强聚合物电解质用于固态锂金属电池2022-09-28 4099
-
固态聚合物锂电池中电解质的技术研究2020-06-05 7449
-
锂电池VS聚合物锂电池,谁才是未来的主角?2018-08-17 7064
-
聚合物锂电池工作原理表现2013-06-14 3836
-
聚合物锂离子电池的构成2013-06-06 3347
-
聚合物锂电池的生产2013-05-10 3915
-
对聚合物锂电池的优点和缺点进行分析2012-11-29 4950
-
无机纳米粒子在复合聚合物电解质中作用的研究进展2011-02-23 890
-
锂离子电池聚合物电解质导电机理2009-12-09 2687
-
锂离子电池聚合物电解质导电机理是什么?2009-10-29 7617
-
聚合物电池的分类,锂聚合物电池的结构2009-05-24 4002
全部0条评论

快来发表一下你的评论吧 !

