

利用纳米阱阵列阻抗传感器实现皮摩尔水平的蛋白质无标记传感
描述
蛋白质、细胞因子和核酸的检测与分析在广泛的应用实践中发挥着关键作用,其中包括癌症的早期诊断、疫苗的发现,甚至是用于确定致命传染病(如新冠病毒(SARS-CoV-2))感染的血清学分析。基于亲和力的生物传感器,例如蛋白质阵列技术,是进行蛋白质组学分析的有用平台。目前,蛋白质微阵列已被证实可用于基因、转录组蛋白质和抗体的研究和分析。
据麦姆斯咨询报道,近期,美国罗格斯大学(Rutgers University)的研究人员提出了一个由低噪声锁定放大器组成的前端模拟电路接口,用于开发一种便携式读出系统,该系统通过使用尺寸约为35平方厘米的纳米阱(nanowell)阵列阻抗传感器,能够可靠地检测低至0.1%的阻抗变化,从而实现皮摩尔水平的蛋白质无标记传感。相关研究成果以“A portable analog front-end system for label-free sensing of proteins using nanowell array impedance sensors”为题,发表于Scientific Reports期刊。
纳米阱阵列阻抗传感器
纳米阱阵列阻抗传感器的设计如图1c所示。当传感器浸在电解液环境中并施加驱动电压时,两个电极之间会形成离子电流路径。探针抗体被物理吸附在微阱中。两个电极之间的阻抗随着靶蛋白与固定在微阱中的抗体的结合而增加,如图1e所示。阻抗增量的幅度与输出电流的变化成正比,并与样品中靶蛋白的浓度有关。此外,该传感器还受益于样品的高盐浓度。盐浓度越高,电流越大,则靶蛋白与抗体结合时对应的阻抗变化越大。
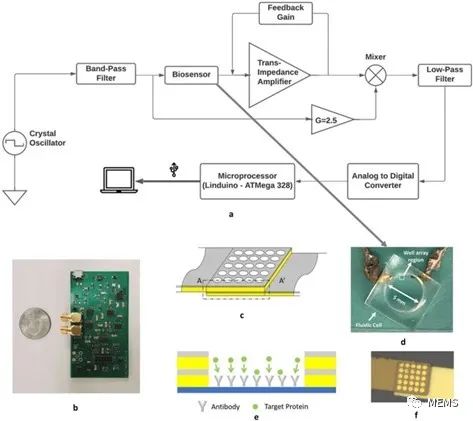
图1 (a)便携式电子读出系统示意图;(b)所设计的锁相放大器定制PCB实物照片,包括具有小尺寸(80 mm × 43.6 mm)焊板的板载ADC;(c)纳米阱阵列阻抗传感器示意图;(d)纳米阱阵列阻抗传感器实物照片;(e)纳米阱阵列阻抗传感器原理:抗体和靶蛋白结合阻断电流路径,导致阻抗增加;(f)5 × 5纳米阱阵列显微图。
蛋白质检测
为了验证所提出的电子读出系统的可行性,研究人员进行了蛋白质检测实验。实验方案如图2a所示。首先将20μl 1 × PBS溶液添加到空的纳米阱传感器中,可以看到阻抗突然下降(图2b)。待响应稳定下来之后,向纳米阱传感器中继续添加3μl PBS(图2c)。待响应再次稳定后,向传感器中加入3μl抗体溶液。此时,由于抗体被吸附到传感器表面,阻断了电流路径,阻抗偏移初始基线后呈指数增长(图2d-2e)。随后,等待约10分钟,待抗体被充分吸附在传感器表面后,取出额外的溶液,再次加入20μl PBS(图2f)。最后,加入3µl待测蛋白质溶液进行检测。
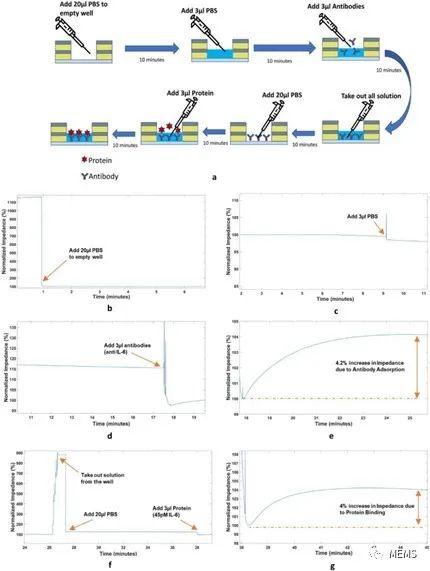
图2 蛋白质检测实验
虽然该检测过程所遵循的实验方案时长设定为45分钟,但通过跳过添加PBS的验证步骤,直接将蛋白质添加到功能化的传感器表面,实际操作可以在10分钟内完成。研究人员使用人/灵长类IL-6单克隆抗体和重组人冠状病毒SARS-CoV-2刺突糖蛋白S1作为阴性对照。阴性对照实验的实验方案和分步结果如图3所示。蛋白质定量试验和阴性对照试验均重复3次。相关实验结果总结如图4c中箱型图所示。
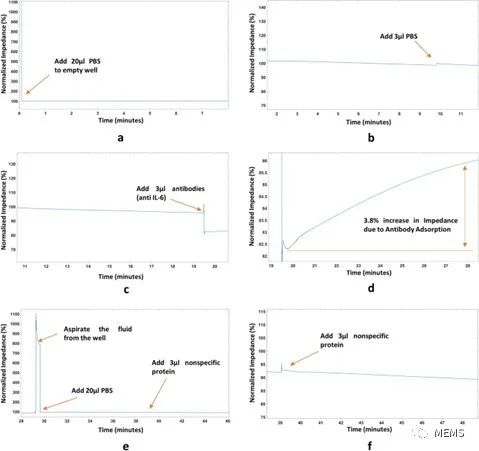
图3 非特异性蛋白实验(阴性对照)
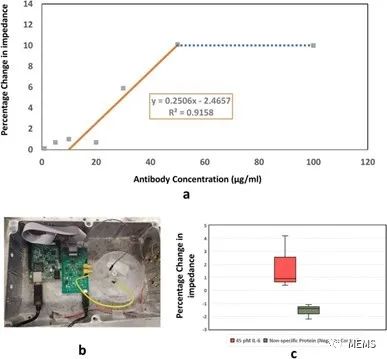
图4 (a)用不同浓度抗体进行的抗体吸附实验中所观察到的阻抗变化百分比。(b)实验装置。(c)PBS中蛋白质检测实验箱线图。
综上所述,该研究提出了一种便携式、低噪声电子读出系统,用于与纳米阱阵列阻抗传感器相结合,以实现蛋白质的无标记传感。相关实验结果证明了该系统具有量化抗体浓度的能力。此外,尽管在实验中采用了时长较长的检测方案以确保鲁棒性,但在实际环境中使用时,该系统能够在10分钟的周期内实现“样品进结果出”的蛋白质快速检测。另外,除了可以用于蛋白质检测以外,该系统也可用于抗体和蛋白质结合动力学的研究和测量。
审核编辑:郭婷
-
电子感觉传感器技术发展动态2009-07-19 3425
-
有测脂肪蛋白质的单片机程序和电路图提供参考一下吗?2018-04-10 2594
-
以色列面向生物传感器和电路的蛋白质纳米线2018-11-20 2041
-
面向生物传感器和电路的蛋白质纳米线2018-12-03 1914
-
蛋白质组学技术与药物作用新靶点研究进展 精选资料分享2021-07-26 1625
-
点成分享 | 蛋白质浓度测定之BCA法2022-12-20 4602
-
氧化还原蛋白质电化学研究2009-07-16 1289
-
使用NTA或者抗组胺抗体捕获组氨酸标记的蛋白质2011-02-11 1005
-
基于PPI网络与机器学习的蛋白质功能预测方法2018-04-17 1423
-
如何利用红外传感器追踪蛋白质构象变化设计出高效药物?2018-08-15 2178
-
日本人工合成蚊子蛋白质,开发出高敏感度气味传感器2021-01-19 2746
-
基于衰减系数的动态蛋白质预测网络模型2021-06-15 811
-
奶粉蛋白质检测仪的特点及功能2021-08-05 736
-
蛋白质测定仪工作原理是怎样的2021-11-15 3173
-
通过石墨烯生物传感器同时检测蛋白质和RNA生物信号2023-06-18 2269
全部0条评论

快来发表一下你的评论吧 !

