

锂空电池放电过程中LiOH的形成机理研究
描述
01、导读
锂空气电池是一种以金属锂为负极,以空气中的氧气为正极的锂离子电池,放电时,一般在正极生成Li2O2,充电时Li2O2分解。与锂离子电池相比,锂空电池的能量密度达到3400 Wh/kg,是下一代锂离子电池的有力竞争者。但是,正极生成的Li2O2导电性差、充电时不能完全分解,导致现有锂空电池存在能量效率低、倍率性能差、循环寿命短的问题。除了Li2O2,锂空电池还会生成LiOH、LiO2和Li2O等产物。基于LiOH的电池在室温下表现出良好的能量效率和循环倍率性能,还可以在高湿度环境下运行,比Li2O2更耐CO2,实用性更强,因而受到研究者的广泛关注。
锂空电池放电过程中LiOH的形成机理非常复杂,还有许多关键问题存在争议,阐明其形成过程对于锂空电池的实用化具有重要意义。
02、成果背景
近期,Angewandte Chemie International Edition上发表了一篇题为Unravelling the Complex LiOH-Based Cathode Chemistry in Lithium–Oxygen Batteries的文章。为全面了解锂空电池中LiOH正极的形成机理,该工作制备了Ru/碳纳米管(Ru/CNT)正极催化剂和一系列含水率可控的电解液,组装成锂空电池,采用多种表征手段和从头计算方法,对锂空电池中LiOH的形成机理进行了研究,发现在Ru/CNT的催化下,LiOH是通过四电子还原反应形成的。随着酸性质子的不断累积,与OH*结合,还会形成质子耦合水,导致一个新的高电压平台的形成,从头计算结果和密度泛函理论均支持了上述结论。这一成果为LiOH基锂空电池的实用化铺平了道路,为理解其它金属-空气电池中的四电子反应机理提供了新的见解。
03、关键创新
将实验表征和从头计算方法相结合,阐明了锂空电池中LiOH的四电子还原形成机理;解决了高活性OH*是否存在的争论,解释了高电压平台的形成原因。
04、核心内容解读
1、正极催化剂结构表征
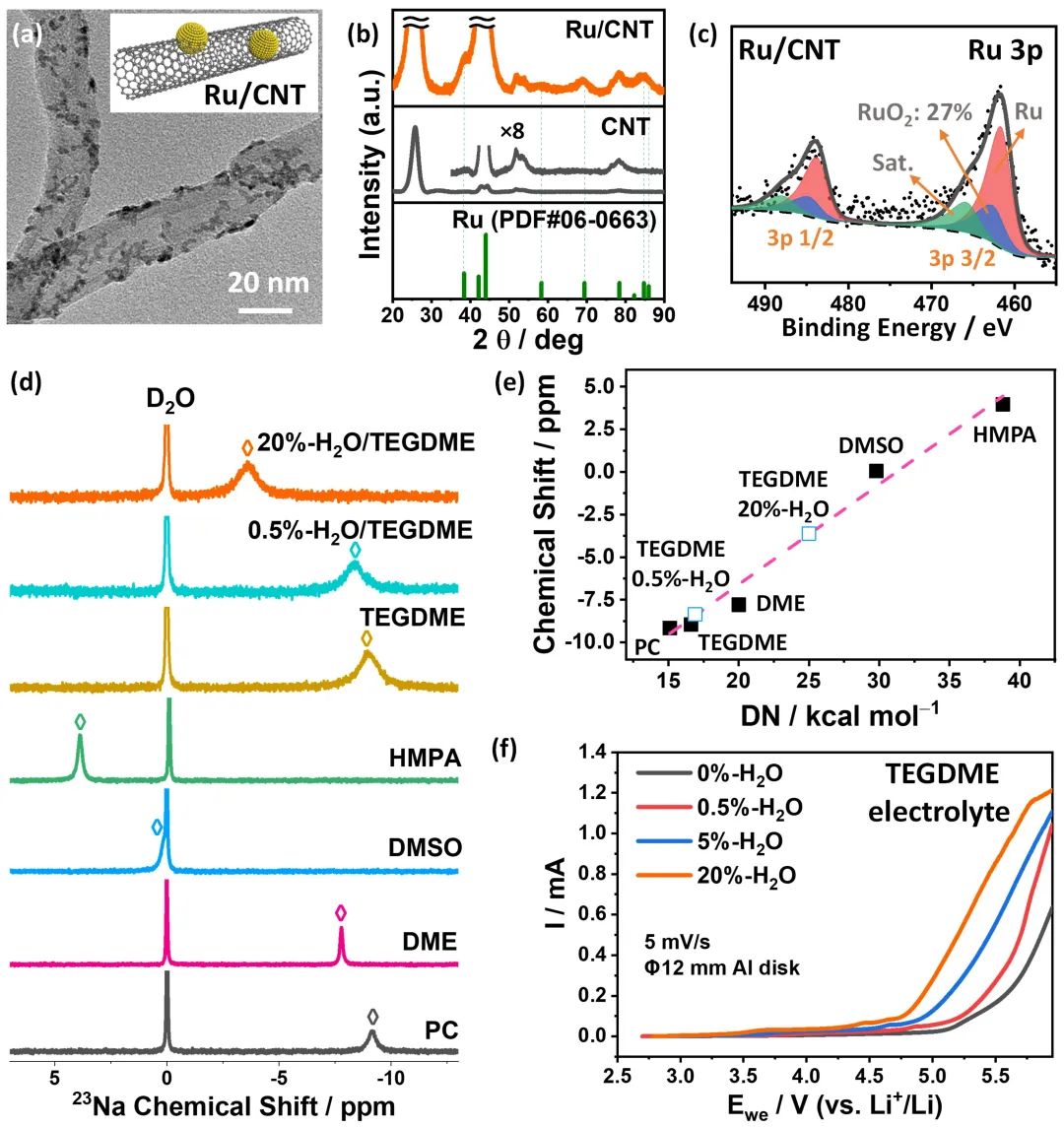
图1. Ru/CNT催化剂及TEGDME基电解液的表征。(a-c)Ru/CNT催化剂的TEM、XRD和XPS结果;(d)各种电解质溶剂的23Na核磁共振谱图;(e)各种电解质溶剂的核磁共振化学位移与给电子数(DN)的线性关系;(f)不同含水率的TEGDME基电解液的阳极LSV曲线。@ Wiley
鉴于Ru基材料在析氧反应(OER)中良好的活性,研究者以Ru/CNT催化剂作为正极材料,通过TEM、EDS和XRD对其结构进行了表征,发现Ru以3-5 nm的颗粒形式均匀分散在CNT上(图1a-b)。
以水为氢氧化锂形成的质子源,制备了含水率在0-20wt%的H2O/TEGDME混合电解液溶剂,水还可以影响电解液的溶解能力,给电子数DN越高,对放电中间产物的溶解能力越强。研究者用23Na核磁共振分析了溶剂的DN数,发现加入20wt%的H2O后,TEGDME的DN从最初的16.6增加到25.0 kcal·mol-1(图1d-e)。
线性扫描伏安法(LSV)用于评价了混合电解液的电化学稳定性,结果表明,当水分含量从0增加到20wt%时,电解液电化学稳定窗口从0.82-5.1缩短到了1.88-4.75 V(图1f)。也就是说,加水提高了溶剂的溶解能力,但降低了其电化学稳定窗口。
2、LiO2中间产物演变机理的分子动力学模拟
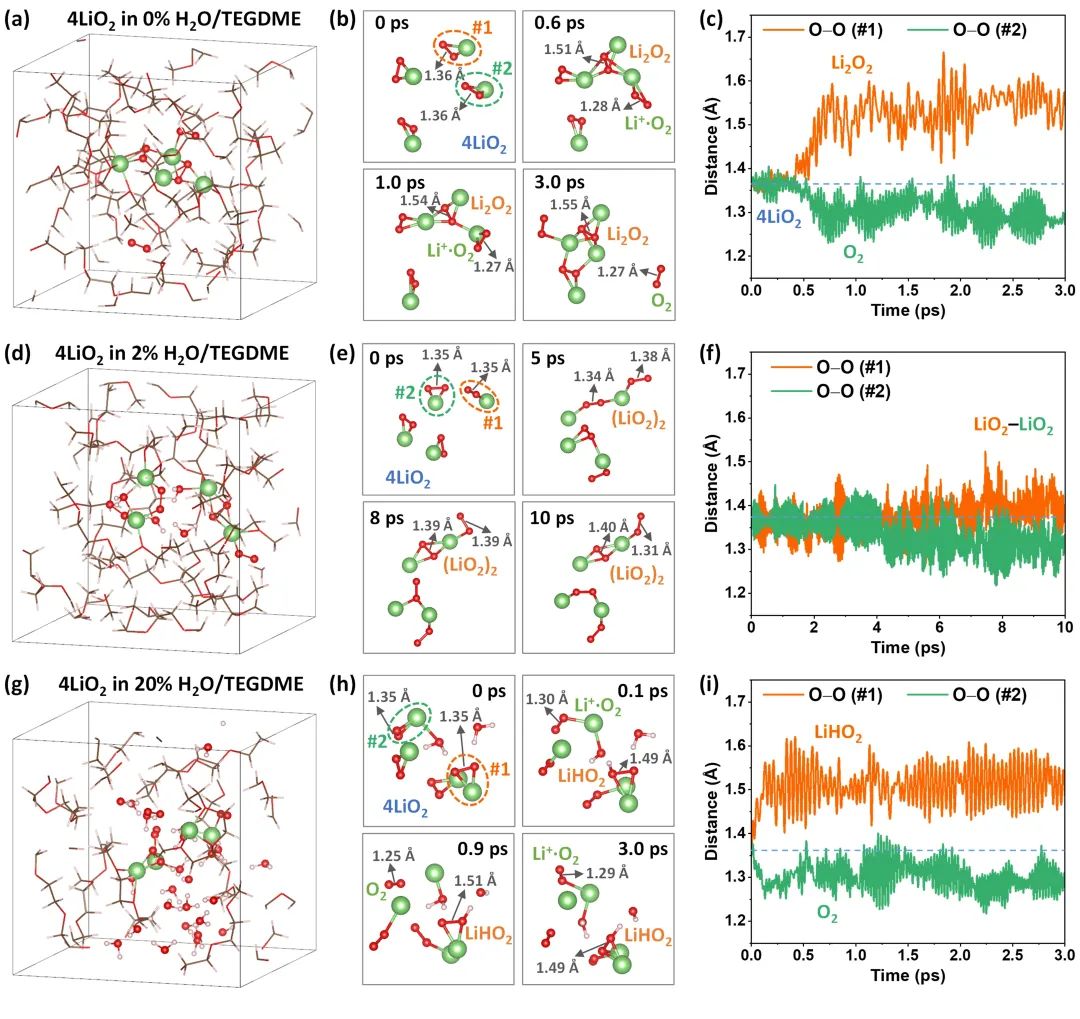
图2. TEGDME基电解液中LiO2中间产物的AIMD模拟。(a,d,g)分别是3.0 ps时0%、2%和20%-H2O/TEGDME体系中LiO2的快照;(b,e,h)从AIMD模拟轨迹中提取的不同含水率的TEGDME基电解液中LiO2随时间演化的结构快照;(c,f,i)原始LiO2分子中O-O对的距离曲线。@ Wiley
在锂空电池中,LiO2是一种重要的中间产物,但其形成机理尚不明确。研究者利用从头计算分子动力学模拟(AIMD),在300K下,以0.5 fs为时间步长,对0%、2%和20%水含量的TEGDME基电解液中LiO2的形成机理进行了研究。
结果表明,在0wt%H2O/TEGDME电解液中,LiO2在约0.5 ps后发生歧化反应生成了Li2O2和O2(图2a-b),原始LiO2分子的O-O对距离曲线(图2c)表明,其中一个O-O对距离突然从1.36 Å (LiO2)增加到了约1.55 Å (Li2O2),而另一个O-O对距离突然从1.36 Å (LiO2)减少到了约1.27 Å (O2),进一步证明了LiO2发生了歧化反应。但是,在无水电解液中LiO2的歧化反应是比较缓慢的,也没有观察到LiO2的直接水解。
在20 wt% H2O/TEGDME电解液中,LiO2在约0.1 ps后就直接水解成LiHO2和O2(图2g,h),原始LiO2分子的O-O对距离曲线(图2i)表明,一个O-O键突然从1.35 Å (LiO2)增加到了约1.49 Å (LiHO2),而另一个O-O对突然从1.35 Å (LiO2)减少到了约1.29 Å (O2),证实了上述过程。他们还发现,即使在10 ps的模拟时间内,也没有观察到LiHO2进一步水解为H2O2。
根据上述AIMD模拟结果,研究者提出了LiO2中间产物的演变机理:在无水或者低含水率电解液中,LiO2首先歧化生成Li2O2和O2,然后在催化剂的帮助下,Li2O2水解成LiOH;在高含水量电解液中,LiO2首先水解成LiHO2,然后进一步歧化成LiOH和O2。
3、LiOH反应的不可逆性
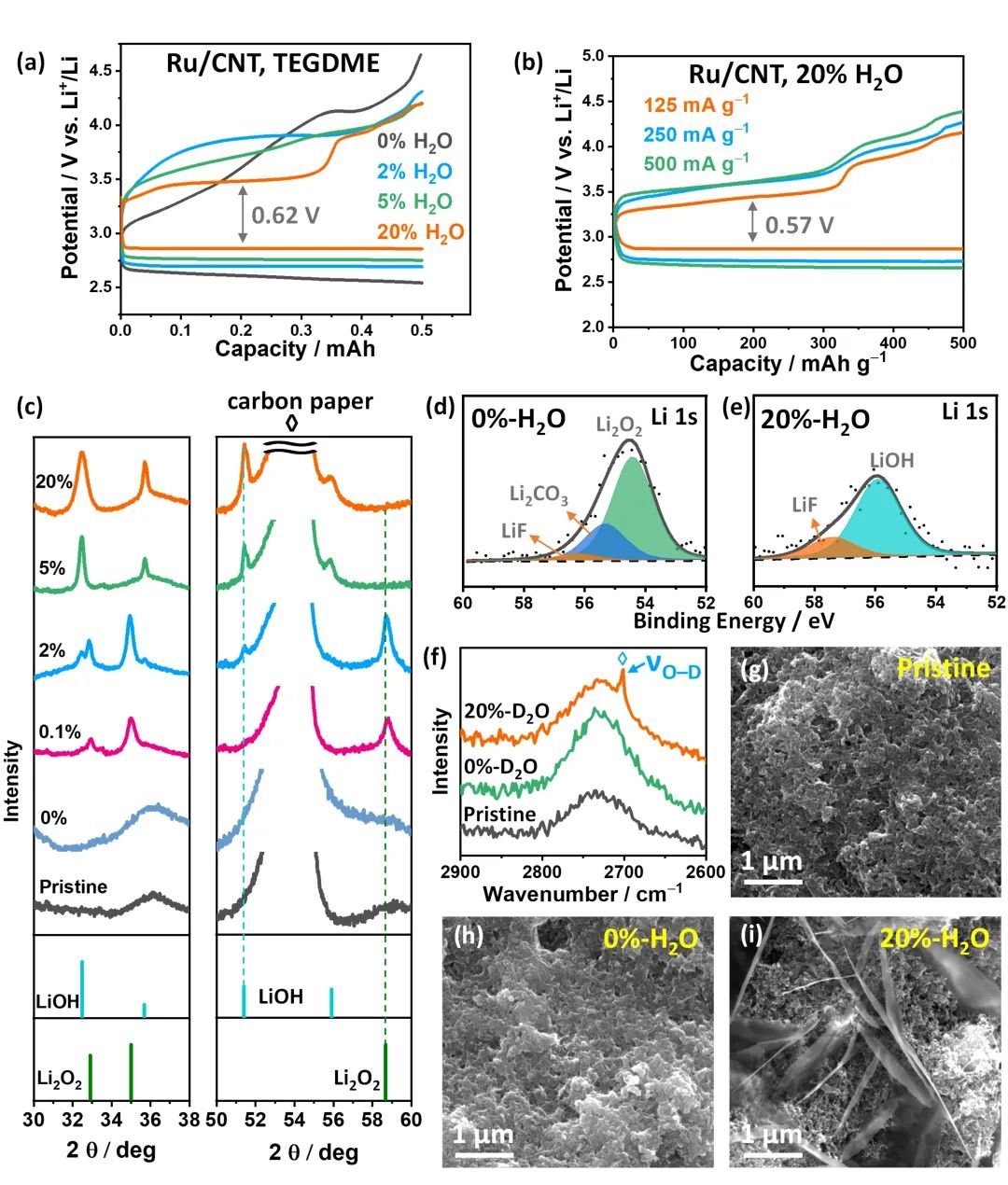
图3. TEGDME基电解液中放电产物的非原位表征。(a)Ru/CNT在0-20%H2O/TEGDME电解液中的电压曲线;(b)在125、250和500 mA·g-1的电流密度下20%-H2O/TEGDME电解液中Ru/CNT的倍率性能;(d-e)放电时Ru/CNT在无水和20%水的电解液中的XRD谱图;(f)对应的拉曼谱图;(g-i)原始和放电后的Ru/CNT在无水和20%水电解液中的SEM图像。@ Wiley
研究者以氧正极、LiFePO4参比电极组装了锂空电池,以H2O/TEGDME/双(三氟甲烷)磺酰亚胺锂盐(LiTFSI)为电解液,研究了其电化学性能。在20%H2O/TEGDME电解液中,Ru/CNT的充放电压差最低为0.62 V(图3a)。利用XRD和XPS,他们发现当电解液中水含量从0增加到20%时,放电产物最初为无定形的Li2O2,然后是Li2O2/LiOH混合物,最后为LiOH,说明水是LiOH形成所必需(图3c-e)。当用D2O取代H2O时,拉曼光谱显示在20%-D2O/TEGDME电解液中,在Ru/CNT上形成了LiOD,进一步证实了水是氢氧化锂的质子源(图3f)。在无水电解液中,放电产物形貌与20%-H2O/TEGDME中的不同,在有水状态下形成了微米尺寸的片状结构(图3h-i)。
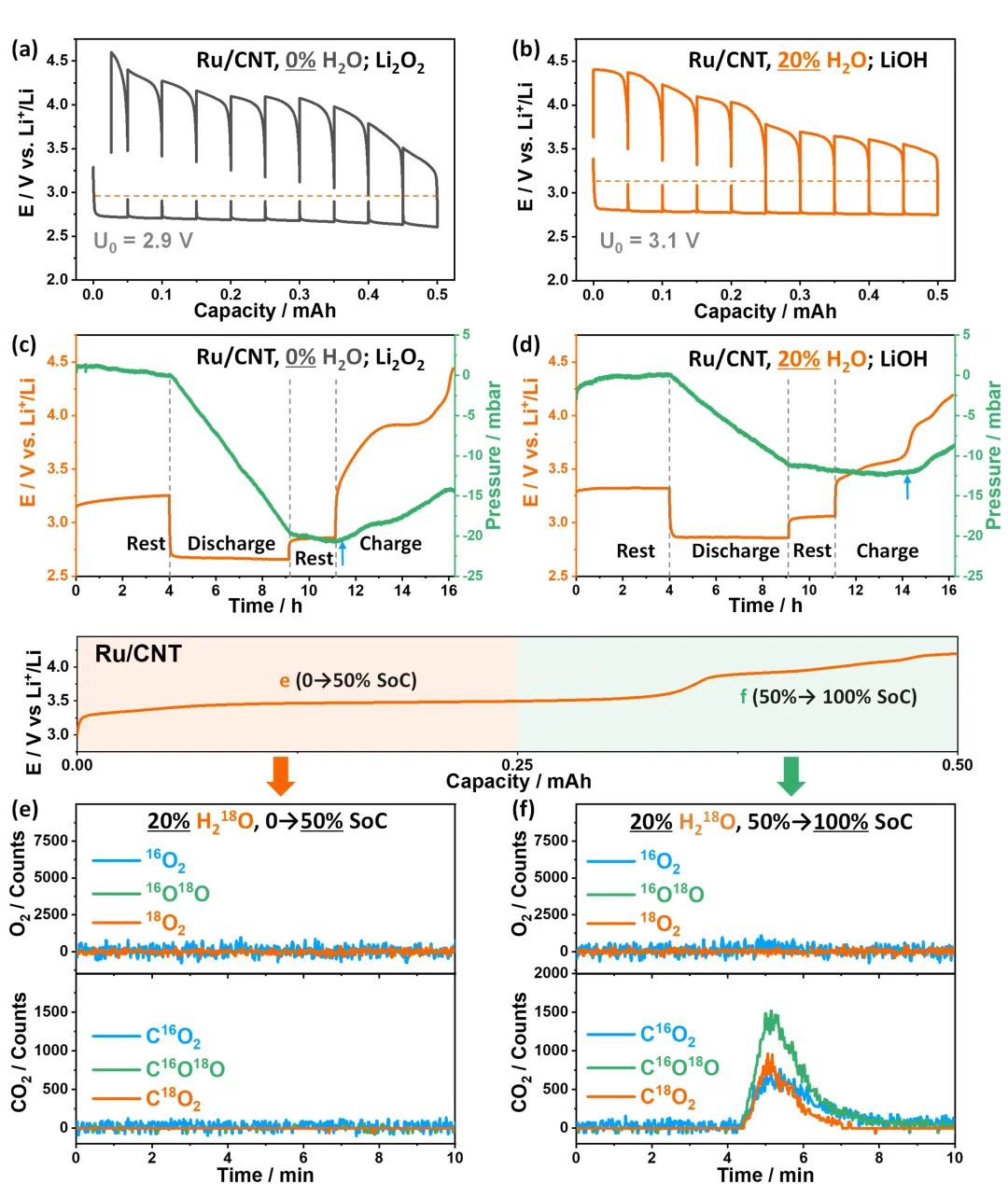
图4. 用GITT、OPERANDO气体压力测量和同位素标记质谱比较Li2O和LiOH化学反应性。(a-b)Ru/CNT在0%和20%H2O/TEGDME电解液中的GITT结果;(c-d)相应的 OPERANDO气体压力测量结果;(e-f)相应的同位素标记的质谱。@ Wiley
研究者用GITT、OPERANDO气体压力测量和同位素标记质谱研究了LiOH的反应性。
在GITT曲线中,0%-H2O/TEGDME电解液中,开路电位(OCP)在整个放电过程中保持在~2.9 V,由于不溶性副产物在正极上的积累,OCP持续增加;在20%-H2O/TEGDME电解液中,OCP保持在~3.05V,在第一平台上几乎保持不变,远低于3.32 V的E0(O2/LiOH)标准电位(图4a-b)。
理论上,Li2O2是通过2e−/O2过程形成,而LiOH是通过4e−/O2过程形成,这表明生成LiOH消耗的氧气量是Li2O2的一半。当电池放电到0.25 mAh后,在20%和0%-H2O/TEGDME电解液中,电池压力分别下降到11mbar和20mbar,对应于LiOH和Li2O2的形成,这表明LiOH的形成是一个4e−/O2过程(图4c-d)。研究者还进一步研究了充电时放出气体的组成,发现Li2O2充电时产生了O2和CO2;LiOH在充电的前半程O2和CO2的析出要少得多,在后半程,只观察到CO2的析出,
OPERANDO压力测量和原位同位素标记质谱结果表明,在TEGDME基电解液中,由于充电时没有O2析出,LiOH反应性是不可逆的,这是因为形成了高活性的OH*物种,如果使用更稳定的电解液,不会生成OH*的话,LiOH的转化有可能变成可逆。
4、形成了酸性物质
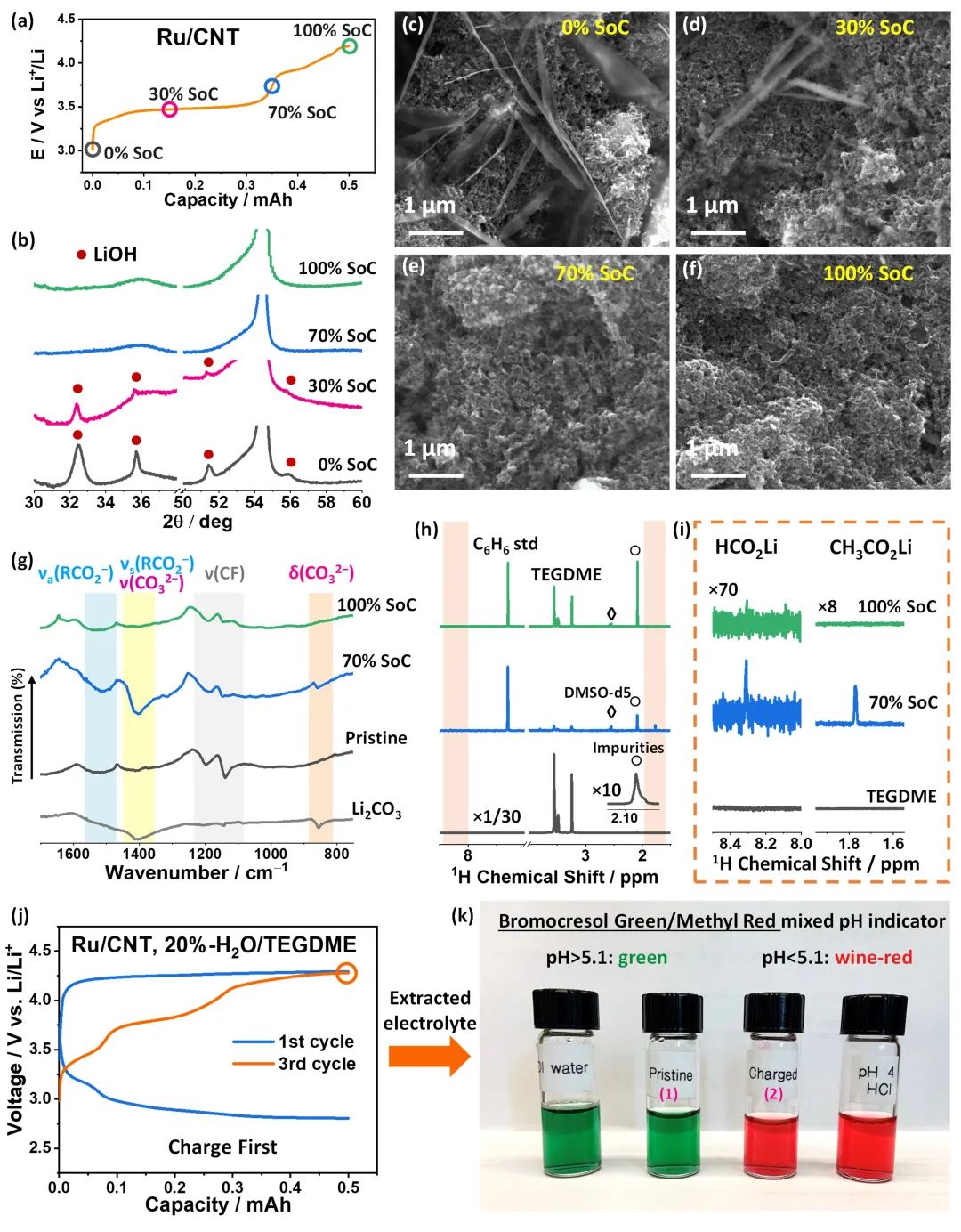
图5. 不同电荷状态下TEGDME基电解液中充电产物的非原位表征。(a)在20%-H2O/TEGDME电解液中,Ru/CNT在0%、30%、70%和100%电荷状态(SoC)下的电压曲线;(b) 相应的XRD谱图;(c-f)相应的SEM图像;(g)负载Li2CO3和各种Ru/CNT电极的红外谱图;(h-i)在70%和100% SoC下,TEGDME和 Ru/CNT的D2O萃取物的1H核磁共振和变焦光谱图;(j) 先充电后放电的Ru/CNT在20%-H2O/TEGDME电解液中的电压曲线;(k)加入pH指示剂后,不同溶液的照片。@ Wiley
研究者采用SEM、XRD、FTIR和核磁共振技术研究了LiOH的充电过程。发现在30%的SoC条件下,生成的LiOH被部分去除,在70%SoC时(即第一充电平台结束时)被完全去除(图5b,d,e),这是由于LiOH与电解液降解产生的酸性产物发生了化学反应,而酸性物质是高活性OH*与电解液反应生成的。FTIR和核磁共振结果表明,在70%的SoC下,正极上有不溶性的副产物沉积,包括Li2CO3、HCO2Li和CH3CO2Li,考虑到体系中不含有乙基官能团,他们认为和CH3CO2Li可能是由OH*引发的一系列自由基链反应形成的(图5g,h)。
为了证实电解液降解形成了酸性物质,研究者分析了第三个循环周期电解液的pH值。结果表明,当使用溴甲酚绿/甲基红混合pH指示剂时,电解液确实是酸性,pH<5.1(图5k)。
5、LiOH的反应机理
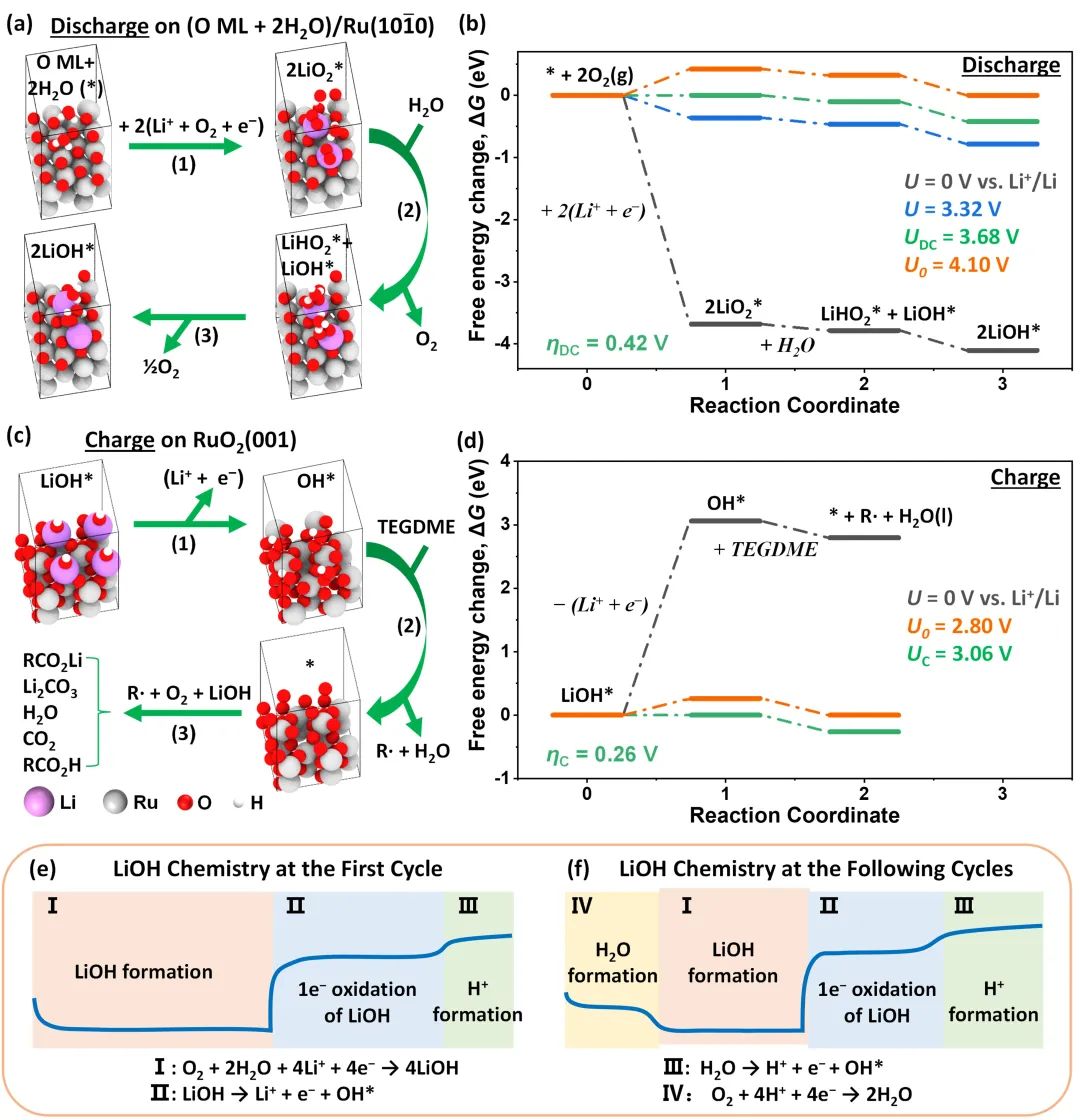
图6. LiOH的反应机理。(a,c)在高含水量电解液中Ru/CNT催化LiOH的反应路径和结构模型;(b,d)用密度泛函理论计算放电和充电反应在不同电势下的能量图;(e,f)在首次和随后的循环中,LiOH在高水含量电解液中的反应机理。@ Wiley
研究者采用密度泛函理论计算了高含水量电解液中LiOH生成的反应路径和相应的能量图(图6a-b)。结果表明,在放电过程中,O2首先通过单电子还原为LiO2*,然后LiO2*水解为LiHO2*,最后LiHO2*通过歧化反应生成LiOH*,这一反应路径与AIMD模拟一致。在低水分含量的电解液中,O2还原后,LiO2*通过歧化反应生成了Li2O2*,随后进一步水解形成LiOH* (图6d-f)。
随后,他们又计算了LiOH分解的反应路径和相应的能量图(图6e-f)。在充电过程中,LiOH*首先通过单电子氧化形成*OH(图6c),然后OH*从TEGDME中提取H原子,导致电解液降解(图6c-d),同时生成了酸性产物,中和了LiOH,形成了Li2CO3和RO2Li等副产物。LiOH去除后,出现第二充电平台,这与水的单电子氧化反应有关,生成了CO2和可溶酸RO2H。
在接下来的循环中(图6f),放电过程显示出两个平台。由于之前充电过程中质子的积累,被还原的O2与质子耦合形成了水,形成新的高电位放电平台。
05、成果启示
该工作结合实验和从头计算方法,全面阐述了锂空电池中LiOH复杂的演变机理。发现在Ru催化作用下,LiOH通过四电子还原反应生成。在充电过程中,LiOH通过单电子氧化反应分解,形成高反应性的OH*,导致电解液分解形成酸性物质,随后酸性产物中和了LiOH。随着酸性质子的不断累积,形成了质子耦合水,出现了一个新的高电压平台。
作者指出,利用氧化还原调控剂替代四电子还原反应,或者采用稳定的固体电解质或熔盐电解质来抑制OH*的生成,值得做进一步研究。
审核编辑:郭婷
-
锂金属电池中非活性锂的气体诱导形成2023-02-12 2049
-
从分子尺度分析SEI形成机理及其在锂生长过程中的动态演化过程2022-10-20 5049
-
基于LiOH的锂空气电池在空气中运行稳定性的评估2022-09-19 2299
-
电池锂动力学过程中时域分析的理论基础2022-07-10 4878
-
锂离子电池SEI膜形成过程中可能的机理和影响因素2020-09-21 17144
-
锂锰电池有什么优点?2019-11-06 3088
-
针对电池的安全性方面对固态电解质材料的研究分析2018-09-04 6111
-
锂硫/锂空电池不具备动力电池应用前景的原因解析2018-01-09 6204
-
锂硫电池电化学循环过程及其正极反应机理的研究进展介绍2017-10-01 1530
-
锂空气电池的研究进展和最新情况2016-01-13 5698
-
解密:锂空气电池2016-01-12 5467
-
新技术:锂空气电池是否能成为下一代电池技术标准?2016-01-11 2744
-
锂离子电池充放电机理的探索及“锂亚原子”模型的建立2009-11-04 1607
-
锂离子电池充放电机理及“锂亚原子”模型2009-10-30 2444
全部0条评论

快来发表一下你的评论吧 !

