

通过微流控混合器件实现靶向脂质体的一步式合成策略
描述
脂质体是一种由磷脂分子在水相中自组装形成的球状泡囊体,具有良好的生物兼容性和低免疫原性,能够保护药物不被降解,是一种极具前景的药物递送载体。近年来,脂质体已经被广泛应用于肿瘤免疫治疗、基因治疗、多模态分子影像等领域。相比于常规的脂质体,靶向脂质体能够有效地改善药物的细胞摄取以及靶向富集能力,能够显著地提升药物递送效率。但是,常用的制备靶向脂质体的方法正面临着一些挑战,例如,操作复杂、耗时久、批次差异性大等问题。 近期,中南大学湘雅医院皮肤科、中南大学机电工程学院等研究团队在Small期刊上在线发表题为 “ One-Step Formation of Targeted Liposomes in a Versatile Microfluidic Mixing Device ” 的原创性论著。该研究提出了一种基于微流控混合器件的靶向脂质体的一步式合成方法,成功实现了多种靶向脂质体的高通量、高可控性制备。使用微流控混合器件制备的靶向脂质体,在光声成像、小动物活体成像、光热治疗等研究中都表现出了优异的靶向性能。据悉,这项研究的第一作者和第一通讯作者单位均为中南大学。20级博士研究生单晗和20级硕士研究生孙鑫为该论文共同第一作者;中南大学湘雅医院皮肤科陈翔教授、赵爽副研究员和中南大学机电工程学院陈泽宇教授为共同通讯作者。
首先,研究人员基于靶向脂质体的制备流程筛选了微流控混合器的组合方案,提出了微流控混合器件实现靶向脂质体的一步式合成策略。然后,研究人员使用高精度3D打印技术制作了微流控混合器件(MMD)。
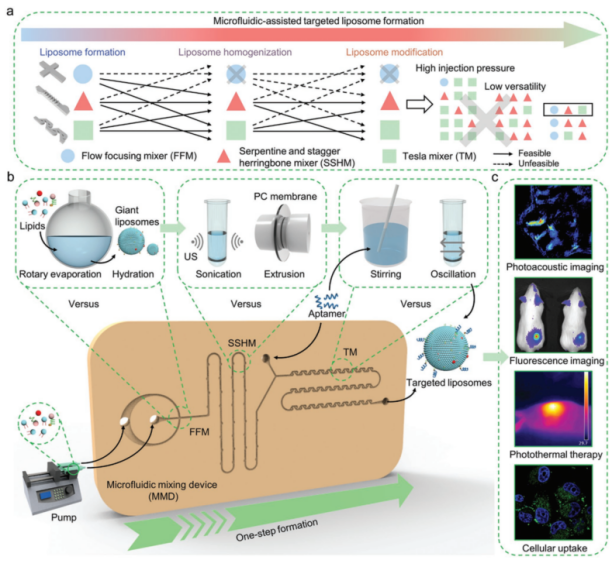
图1 微流控混合器件(MMD)制备靶向脂质体策略
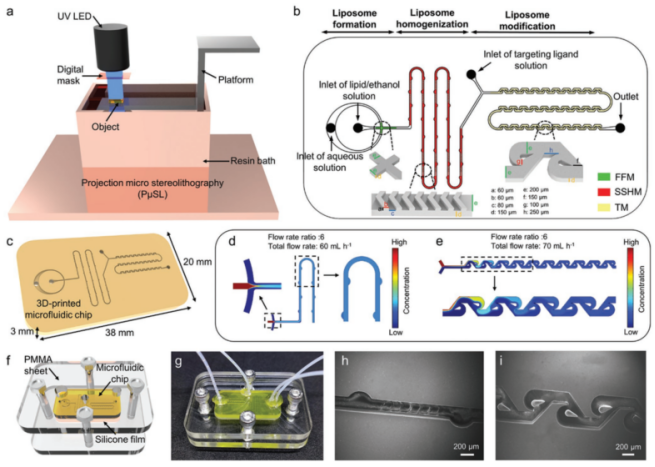
图2 微流控混合器件(MMD)制造
随后,研究人员对脂质体的组分、反应机理进行了设计,选择了吲哚菁绿(ICG)作为模型药物,并选择靶向PD-L1的适配体作为靶向基团,在MMD内发生混合后,巯基修饰的适配体和功能辅料DSPE-PEG-Mal发生共价结合,最终将适配体修饰到脂质体的表面(Apt-ICG@Lip)。
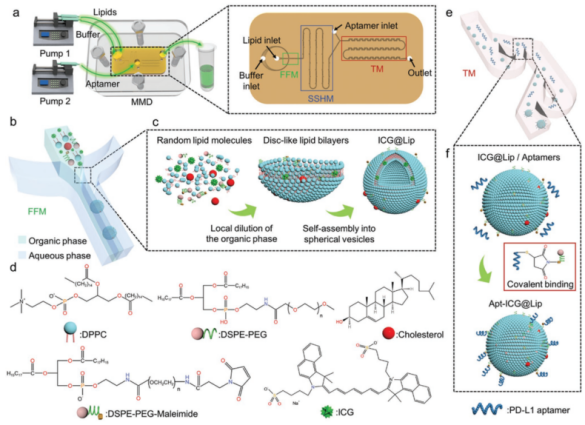
图3 一步式合成靶向脂质体Apt-ICG@Lip反应机理
接下来,研究人员对靶向脂质体Apt-ICG@Lip的性质进行了测试,包括脂质体的粒径分布、重复性、稳定性、包封率、形貌、细胞毒性、适配体结合效率等。结果显示,使用MMD制备的靶向脂质体Apt-ICG@Lip具有粒径小、批次重复性好、稳定性好、包封率高、低细胞毒性、适配体结合效率高等优点,适用于生物医学应用。
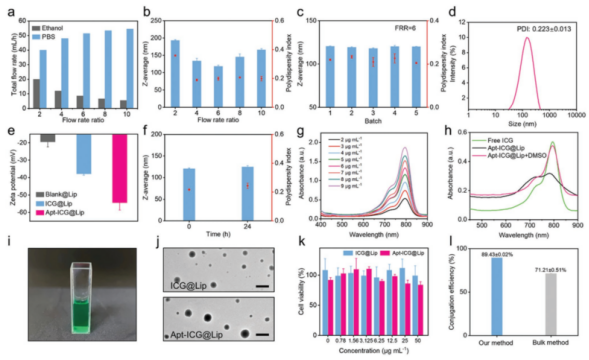
图4 靶向脂质体Apt-ICG@Lip性质测试
接着,为了验证靶向脂质体Apt-ICG@Lip的靶向性能,研究人员进行了光声成像(PACT)和小动物活体荧光成像研究。研究人员将高表达PD-L1的LLC肿瘤模型小鼠分为两组,实验组注射靶向脂质体Apt-ICG@Lip,对照组注射常规脂质体ICG@Lip。结果显示,靶向脂质体Apt-ICG@Lip具有更明显的肿瘤摄取和药物富集能力。
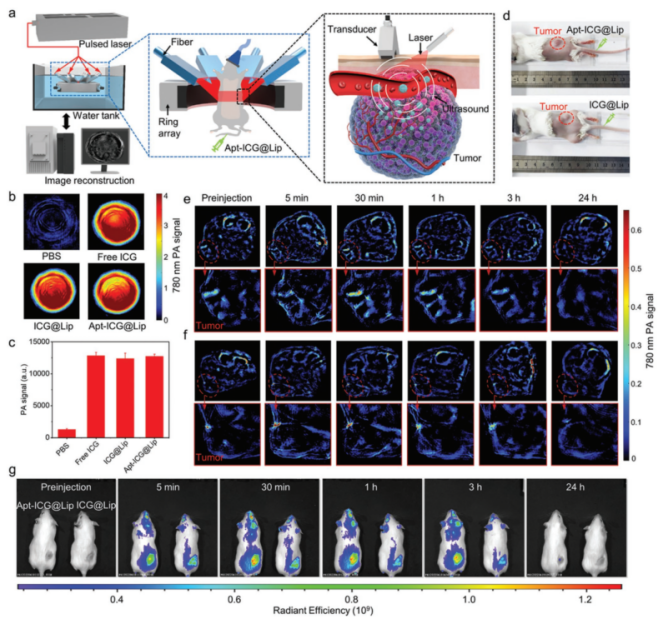
图5 靶向脂质体Apt-ICG@Lip光声成像和小动物活体成像研究
接着,研究人员进一步进行了光热治疗研究。研究人员将LLC肿瘤模型小鼠分为PBS、ICG@Lip、Apt-ICG@Lip三组,在注射药物后分别使用808nm激光进行照射,观测肿瘤的体积变化,并使用免疫组化和免疫荧光评估了肿瘤的治疗效果。结果表明,Apt-ICG@Lip由于具备主动靶向能力,具有更好的光热治疗效果,也进一步验证了MMD构建的靶向脂质体的性能。
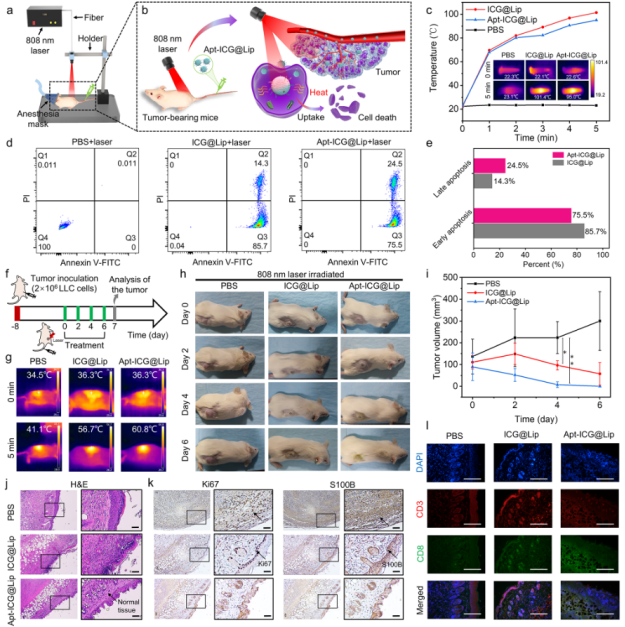
图6 靶向脂质体Apt-ICG@Lip光热治疗研究
最后,研究人员为了验证MMD构建靶向脂质体的通用性,进一步制备了多种不同用途的靶向脂质体。除了吲哚菁绿(ICG)外,研究人员还选择了FITC、NHWD-870和亚甲基蓝(MB)作为模型药物,并使用MMD制备了一种anti-Her2抗体修饰的靶向脂质体。研究人员使用Apt-FITC@Lip进行了细胞实验。结果表明,高表达PD-L1的细胞和Apt-FITC@Lip具有更明显的结合效果。
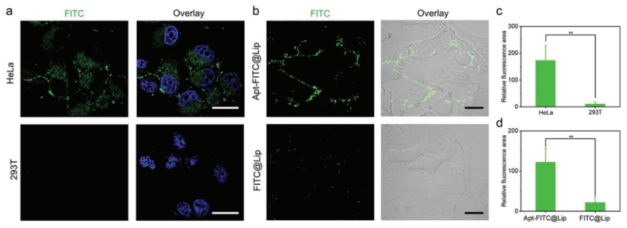
图7 靶向脂质体Apt-FITC@Lip细胞实验
综上所述,该工作提出的微流控混合器件(MMD)一步式构建靶向脂质体的方法,适用于多种靶向脂质体的制备,在靶向药物递送系统(分子成像、肿瘤治疗等)研究中具有巨大的应用前景。
审核编辑:郭婷
-
新型油气混合器的流体域模型2018-03-15 1132
-
脂质体-寡核苷酸在生物分析和生物医学领域的最新应用2020-08-05 3895
-
核酸脂质体纳米粒LNP的制备方法2022-04-06 6706
-
微流控器件的设计策略2022-10-21 1572
-
一种近红外光响应的脂质体纳米药物递送平台开发2023-02-06 2252
-
如何查看混合器芯片的型号2023-07-20 1094
-
基于PDMS的静态微流体混合器的制作与仿真2023-10-09 355
-
混合器件的原理及应用2023-10-25 2216
-
音频混合器电路图分享2024-02-21 17831
-
微混合器在食品科学中的作用2024-10-22 742
-
微混合器集成技术的市场前景2024-10-24 723
-
Si IGBT和SiC MOSFET混合器件特性解析2025-01-21 2595
-
创新应用:安泰功率放大器赋能声空化微流控器件2025-08-07 383
-
功率放大器在声空化微流控器件中的应用2025-11-11 170
全部0条评论

快来发表一下你的评论吧 !

