

综述:基于磁泳的微流控分离技术研究进展
描述
近年来,随着微流控芯片技术的不断发展,其在生化分析、临床医学和环境检测等领域展现出了巨大的应用潜力。微粒或细胞的分离是微流控芯片的一项重要应用。微流控芯片与磁泳结合的分离技术以其低成本、高选择性和高生物相容性等优势为生化分析、临床医学和环境工程等领域开辟了新的发展方向。
据麦姆斯咨询报道,近期,大连交通大学联合中国科学院于期刊《分析试验室》发表综述文章,该综述阐释了基于磁泳的微流控分离技术原理,分析了影响磁泳分离的主要因素,评述了基于磁泳原理的微流控分离技术中的间歇式分离方法和连续流动式分离方法及其应用,并对磁泳微流控分离技术的发展方向进行了展望。
基于磁泳的微流控分离技术原理
微粒在微流控芯片中的磁泳取决于微粒与载液流体介质磁化率的差异、微粒尺寸、流体粘度和磁场强度及梯度等参数。通过调节这些参数,可以实现微粒的分离。
微粒在微流控芯片中的磁泳运动分为正磁泳和负磁泳两种模式。当微粒的磁化率大于流体介质的磁化率时,微粒向磁场梯度高的方向迁移,发生正磁泳;当微粒的磁化率小于流体介质的磁化率时,微粒向磁场梯度低的方向迁移,发生负磁泳;而微粒本身可以是磁性的或者非磁性的。
在磁泳用于微流控分离的前期研究中,主要用正磁泳分离磁性粒子和磁性标记的微粒或细胞。随着近些年负磁泳微流控分离研究的深入,越来越多的研究表明负磁泳也是微流控技术中分离非磁性微粒或细胞的有效方法。负磁泳不需要对非磁性微粒或细胞进行磁性标记,就可以直接进行分离。正磁泳和负磁泳分离方法互为补充,拓展了磁泳微流控分离的应用范围。
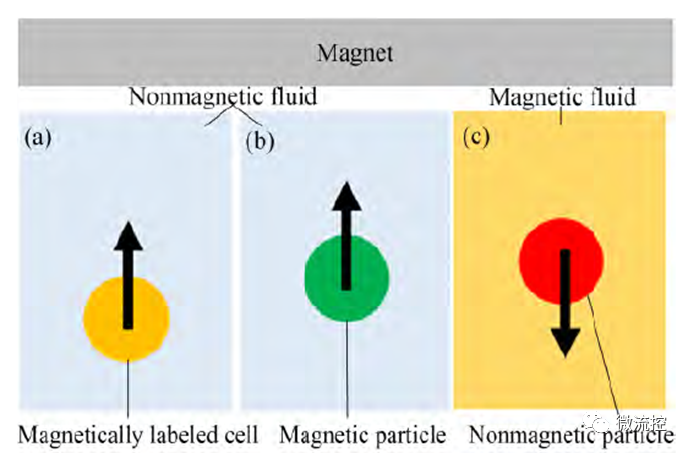
图1 微粒或细胞的磁泳模式
根据微粒或细胞的收集方式,磁泳微流控分离可分为间歇式分离和连续流动式分离两种分离模式。
间歇式分离
间歇式分离又称为磁性捕获分离,利用磁场力将微粒或细胞在通道中的特定位置进行收集。Hoshino等开发了一种基于微流控芯片的CTC细胞捕获系统,系统的磁场由三块并排放置的磁极交替的永磁体提供,且每两块磁体交界处的磁场梯度最强。CTC细胞用Fe₃O₄磁性纳米颗粒进行标记,将磁性标记的CTC细胞以1∶10⁹比例混合成血液样本注入微流控系统中。在磁场的作用下,磁性标记CTC细胞被捕获于微通道底部的载玻片上,且载有捕获细胞的载玻片可以直接从底部抽出,无需将细胞冲洗出通道便可收集。
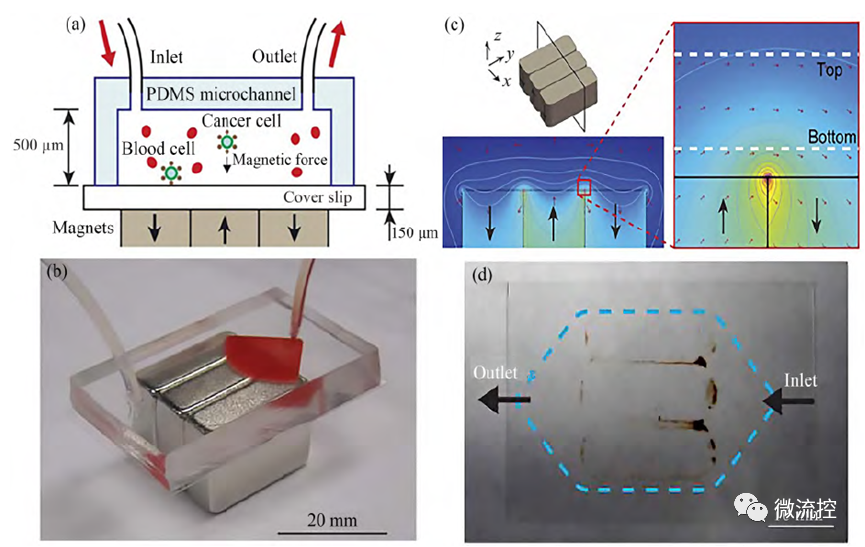
图2 基于微流控芯片的CTC 细胞捕获系统
连续流动式分离
连续流动式分离与间歇式分离相比,可以在载液不间断流动的情况下实现高通量、高选择性地分离目标微粒或细胞。连续流动式分离根据微粒或细胞与载液的磁化率差异分为正磁泳分离和负磁泳分离。
(1)正磁泳分离
正磁泳分离可以利用永磁体、通电线圈或导线、微型软磁结构作为磁场源。Wong等开发了一种利用载流导线作为磁场源的微流控分离装置,用于去除血液中的CTC细胞,装置原理图如图3a所示。将磁性微粒混合溶液注入通道,当电流通过微导线时产生磁场,磁性标记的CTC细胞受磁场作用被吸引从而实现分离。在1 μL/min流速和1.0 A电流条件下,磁性标记HeLa细胞的分离效率可达79%。
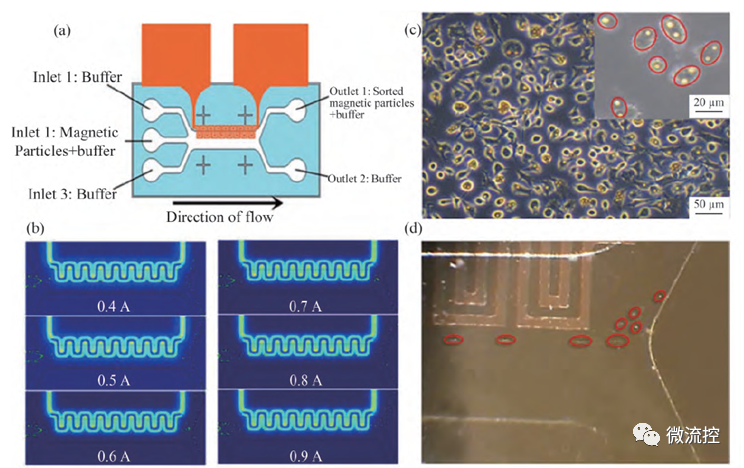
图3 载流导线作为磁场源的微流控分离装置
(2)负磁泳分离
当基于负磁泳分离原理进行非磁性微粒或细胞的分离时,在磁场的作用下,磁性流体中的磁性纳米颗粒会向磁场方向迁移,此时处于磁性流体中的非磁性微粒或细胞便会被磁性纳米颗粒挤压,向磁场梯度低的方向迁移。Zeng等开发了一种负磁泳高分辨率微流控分离系统,如图4a所示。利用永磁体产生的磁场,通过高磁导率的坡莫合金层施加到由Fe₃O₄粉末填充而成的三角形微磁阵列,在分离通道附近产生大于10⁵ T/m的超高磁场梯度。非磁性微粒在进入磁极阵列区域后开始发生负磁泳偏转,当非磁性微粒运动到两个微磁阵列中间区域时,磁场力达到最大,两种微粒发生明显偏转,并在通道末端实现分离。
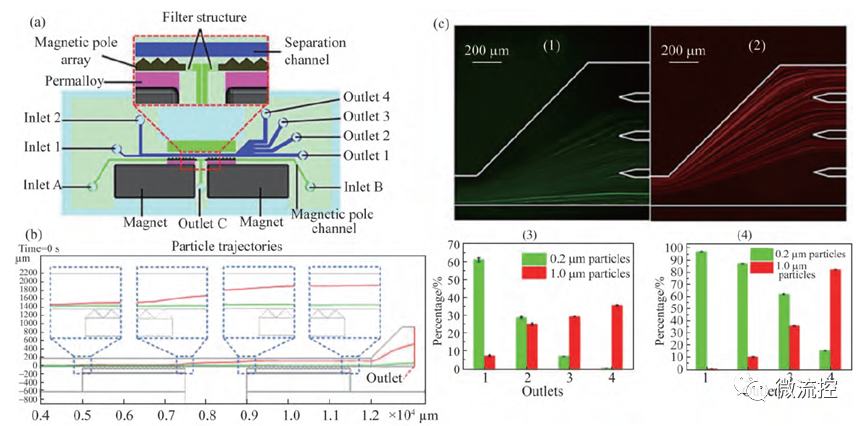
图4 高分辨率负磁泳微流控分离系统
综上所述,磁泳微流控分离技术以其非接触、高通量和高选择性的特点在临床医学、细胞分离和环境检测等领域迅速发展。该技术采用电磁场作为磁场源,可通过改变通电线圈或导线中电流的大小调节磁场强弱,使分离过程易于控制,但通电线圈或导线在分离过程中会产生热量,制约其在生物样品分离上的应用。因此,开发散热效果良好、可控性高的电磁场源,是磁泳微流控分离未来重要的研究方向。另外,应该加快磁泳微流控分离仪器研制,推动磁泳微流控技术产业化发展,给分离分析领域带来新气象。
审核编辑:汤梓红
-
新型铜互连方法—电化学机械抛光技术研究进展2009-10-06 7177
-
室内颗粒物的来源、健康效应及分布运动研究进展2010-03-18 3513
-
薄膜锂电池的研究进展2011-03-11 2949
-
图像中的文本定位技术研究综述_晋瑾 电子书2016-06-29 2741
-
太赫兹量子级联激光器等THz源的工作原理及其研究进展2019-05-28 2467
-
世界智能车辆行驶安全保障技术的研究进展2009-07-15 550
-
中药提取技术的研究进展2010-05-12 620
-
锂离子电池合金负极材料的研究进展2009-10-28 4732
-
废旧镍氢电池回收处理技术研究进展2009-12-07 1342
-
共振式无线电能传输技术的研究进展与应用综述2017-01-05 1071
-
农业机械自动导航技术研究进展2021-03-16 1142
-
量子计算关键技术研究进展2023-08-08 2662
-
先进激光雷达探测技术研究进展2023-10-31 507
-
液滴微流控技术研究进展综述2024-01-23 2945
-
碳化硅(SiC)MOSFET并联应用均流控制技术的综述2025-02-05 1436
全部0条评论

快来发表一下你的评论吧 !

