

模块化微流控芯片可远程实时控制脑类器官生长
描述
脑是脊椎动物身体中最复杂的器官,包含了约860亿个神经元和超过100万亿个连接。多能干细胞等衍生的类器官能够自我组装并产生多种组织特异性细胞类型,更适合构建复杂组织和系统。类器官技术为脑部区域构建高质量模型提供了更多可能。
近日,加州大学圣克鲁兹分校(UCSC)的研究团队开发了一种远程自动化控制脑类器官生长的新方法。在研究中,科研团队开发了一个多样化平台(multiplex platform),能够根据用户要求的流速在单独分隔的微环境中自动培养单个类器官。
研究人员将自动化、联网的微流体芯片称之为“Autoculture”系统。该系统可精确将营养液输送到单个大脑类器官,优化类器官的生长,且无需人为干预组织培养。
论文的通讯作者是加州大学圣克鲁兹分校电气和计算机工程副教授Mircea Teodorescu和分子、细胞和发育生物学代理教授Sofie Salama。
官方通稿中,这一研究对理解大脑发育和药物治疗癌症、神经退行性疾病等的作用具有重要意义。
培养大脑类器官往往需要在数周或数月内维持细胞生长的精确条件。因此,在本研究中,工程师团队决定使用自动化系统减少人为干扰对细胞培养生长的影响,以此提高准确度。官方通稿中也指出,自动化培养(Autoculture)解决了类器官生长过程中由于批次效应可能造成不均一的问题,能够帮助研究人员更好比较和验证试验结果。
Autoculture使用了研究人员设计的微流控芯片,这款新型芯片由独特的双层模具制成,具有微小的孔和通道,可将微量液体输送到培养类器官的小孔中。与此同时,科学家们可以精确控制营养浓度和副产物。整体来看,该系统主要使用了现成的低成本组件,更具模块化、更易于访问。
Mircea Teodorescu指出,这台机器的一个创新点是,一方面,它简化了流程并确保每批次培养的类器官具有均一性;另一方面,极具有模块化,该系统由计算机控制,芯片的不同部分可互换。
由于该系统向类器官不间断输送营养液,因此它更接近于大脑的真实情况,即不断通过血液为大脑提供营养。
Autoculture系统由6个连接的模块组成,分别是带有加样槽的冷藏库,注射泵、分配阀和控制接口,冷库中的条件培养基收集储液器,与细胞培养箱连接的微流体串行总线,多路复用的微流控类器官芯片,以及在微环境试管内固定的类器官。每个单独的孔都由流体控制器控制,控制器通过抽吸将使用过的培养基移到冷库里面的收集器中,然后在一定的时间间隔内用新鲜培养基补给。
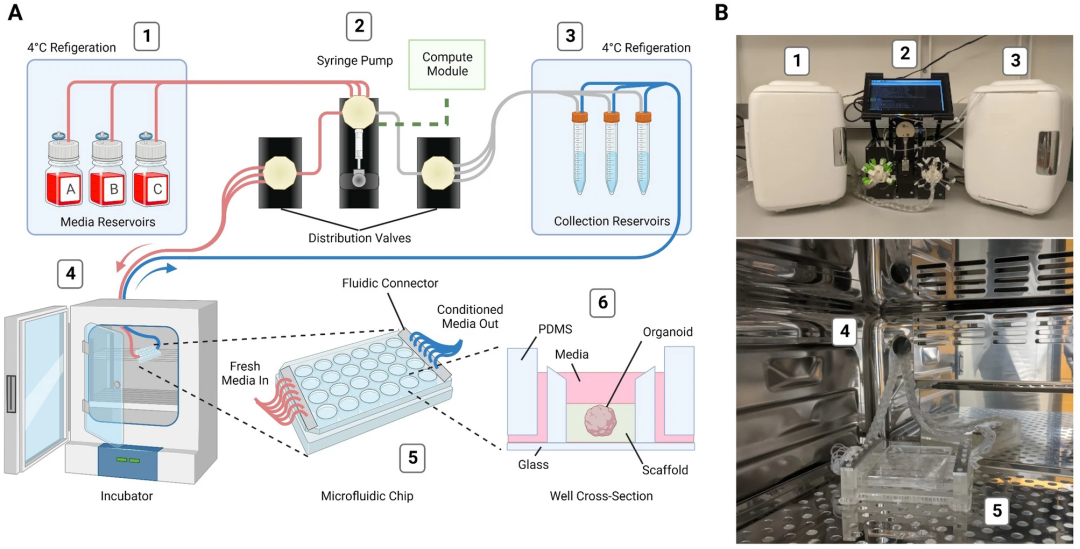
▲图 | 自动化微流控培养平台的设计与运行(来源:Scientific Reports)
该系统包含24个孔,每个孔中都是单独的实验槽,具有专用的入口管、出口管和收集容器。每个孔的加料时间表在速率和介质方面完全可定制,从而增加实验的灵活性。基于这些控制参数,整个板可以执行相同的工作流程,并生成同批次的类器官,还能从孔1到24以浓度梯度递增方式滴定试剂等。
此外,通过使用消息队列遥测传输(MQTT)等通信协议,该系统可联网实时同步管理、根据需求协调控制和数据采集工作。Autoculture软件体系可以基于AWS Cloud控制试验,比如说按需设计、启动、暂停、修改和停止试验。
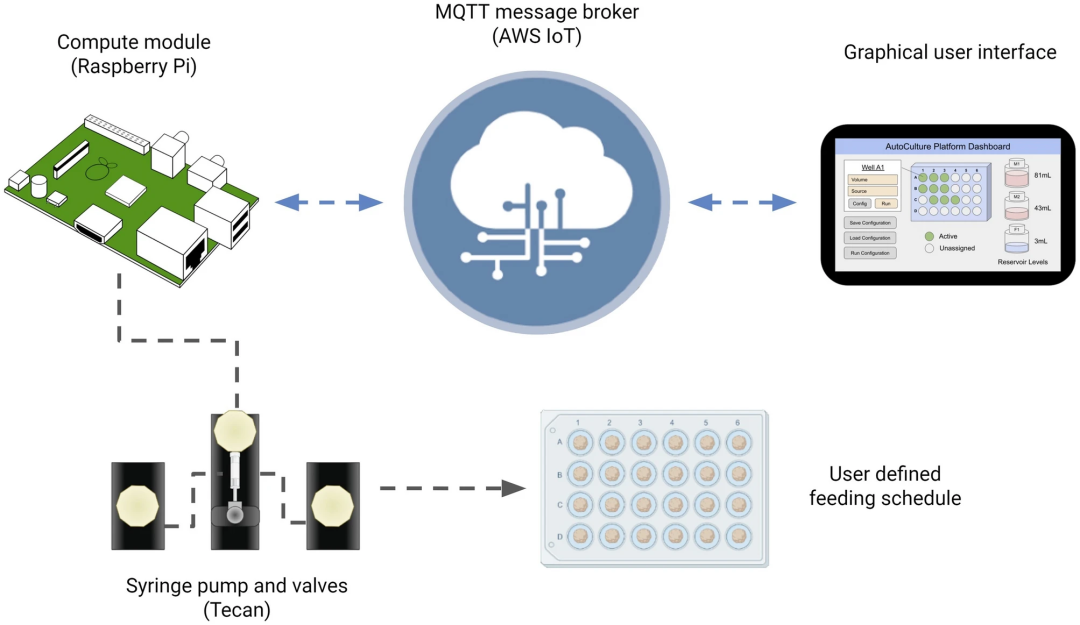
(来源:Scientific Reports)
当研究人员测量基于Autoculture系统培养的类器官时,研究人员发现自动化培养系统培养的干细胞既可以分化成各种细胞类型,还比用标准方法培养的细胞更健康。
RNA测序结果显示这种培养方式降低了糖酵解和内质网应激水平,有潜力解决细胞应激力问题。
论文中指出,这项研究也为UCSC活细胞基因组学中心正在进行的工作提供了一个重要的平台。这项研究将计算应用于生命科学,进一步推动了湿试验自动化。
审核编辑:刘清
-
模块化示波器的技术原理和应用2024-12-11 769
-
AMEYA360报道:微流控芯片基地可年产芯片1亿片!#微流控芯片#器官芯片 #体外诊断 #微流控芯片模具jf_09983350 2023-07-13
-
芯片上的器官2013-07-12 3151
-
模块化UPS的技术选择详解2018-09-30 3055
-
基于DSP和FPGA的模块化实时图像处理系统设计2017-10-23 1079
-
基于Fast Newman二值算法的加权脑网络模块化算法2017-12-08 928
-
基于微流控芯片的体外类生命系统2018-07-27 4432
-
3D打印不同功能的模块化微流控芯片2018-11-20 5572
-
类器官芯片与传感器的结合2019-04-15 12235
-
芯片上的器官模型 有专门的微流控平台2020-03-23 3744
-
类器官和器官芯片的研究进展综述2022-05-25 6052
-
综述:用于预测结直肠癌系统性治疗疗效的类器官和器官芯片研究进展2023-03-02 2414
-
综述:用于生命健康领域的模块化微流控系统2023-03-31 1520
-
微流控器官芯片中生物分子的无试剂共价固定研究2024-05-19 1718
-
芯片上集成功能性血管化类器官的微流控平台2024-11-18 868
全部0条评论

快来发表一下你的评论吧 !

