

氢键网络稳固锂离子电池有机正极材料
电池技术
描述
01
研究背景
发展可持续环境友好储能系统,对于协调能源分配和进一步发展能源至关重要,而锂离子电池由于其综合性能优异,适合大规模生产,将是未来储能系统发展的主要趋势。正极材料是影响锂离子电池性能好坏的关键因素。一般而言,锂离子电池正极材料常用金属基无机化合物,例如钴、镍、铁、锡和钒/锰基材料,但这些材料存在环境不友好、稳定性差等问题,阻碍其进一步大规模应用。
相比之下,有机正极材料具有不含过渡金属、绿色、可持续发展等特点,同时有机正极种类丰富,包括羰基、氮氧自由基、二硫化物和胺类物资等。然而,在实际使用过程中需要解决有机电极中小分子在电解液中易发生溶解的问题。研究者已采取了多种策略来解决这一问题,包括聚合、极性反转、电解质修饰和介孔限制等。
虽然现有研究已经成功抑制了有机活性材料的溶解行为,但其相应制造成本大、工艺复杂和非活性位点多,这严重影响了有机电极材料的实际应用,所以需要探索设计合成新型有机正极材料的新思路。受自然界启发,氢键作为一种相互作用力(即分子内、分子间氢键),广泛存在于生物体或无机物中。
虽然氢键是一种弱相互作用力,但却极大地影响聚集体状态、物理性质和形状结构,可以提高物质溶剂化能,抑制化合物溶解。因此,构建分子间氢键以抑制有机活性物质的溶解现象是具有可行性,是获得高稳定性有机正极材料的潜在策略。
02
成果简介
近期,南开大学陈军院士和陶占良教授在Angew上发表了题为“Hydrogen Bond Networks Stabilized High-Capacity Organic Cathode for Lithium-Ion Batteries”的文章。该工作通过分子间作用构建氢键网络来抑制活性物质溶解现象,深入研究了PTO-NH2分子中-C=O和-NH2间存在的氢键网络,在分子间氢键作用下PTO-NH2呈现横向二维伸展和纵向π-π堆积结构。
原位傅里叶变换红外光谱检测了氢键可逆演化规律,进一步证实氢键网络可以稳定中间体两电子反应态,提高PTO-NH2活性位利用率,展现出优异倍率性能和循环性能。本工作揭示了氢键在电化学过程中的作用和演变规律,为有机正极材料设计提供了新思路。
03
图文导读
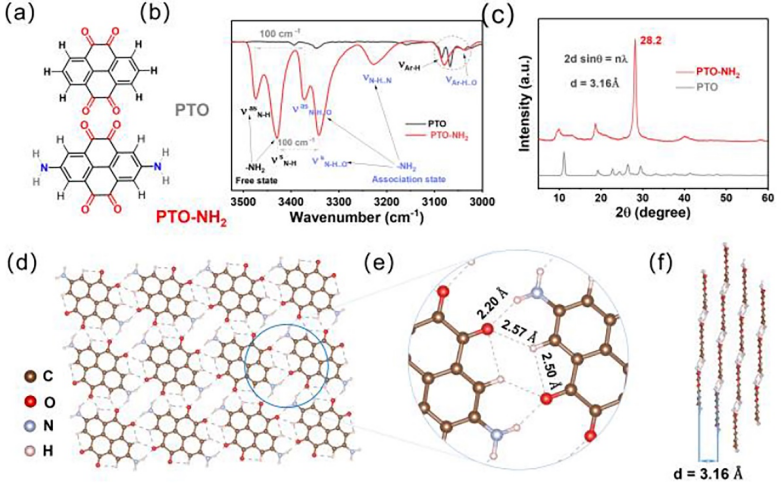
图1. 结构表征。(a) PTO和PTO-NH2分子结构;(b) PTO-NH2红外光谱;(c) PTO和PTO-NH2的XRD图;(d-f) PTO-NH2的氢键网络结构。
分子结构表征。首先,作者选择芘-4, 5, 9, 10-四酮(PTO)为活性单体,主要是因为其具有较高理论容量(408 mAh g-1),同时富含4羰基结构作为氢键受体。通过精细分子设计,向PTO单体中引入氨基(-NH2)作为氢键供体,合成了2, 7-二氨基-4, 5, 9, 10-四酮(PTO-NH2)正极材料,C=O和NH2间电子离域极化有助于分子间氢键形成,并最终在PTO-NH2晶体中建立起稳定的氢键网络结构(HBN)。
从PTO和PTO-NH2分子结构来看,在PTO的2位和7位引入-NH2可以提高氢键给体速率。分析PTO-NH2红外光谱,发现在3500-3300 cm-1处有四个尖峰,归属于游离-NH2(f-NH2)反对称/对称伸缩振动和缔合-NH2(a-NH2)的伸缩振动峰,同时a-NH2和f-NH2之间的波数间隙接近100 cm-1,进一步,证实了C=O和-NH2之间形成了氢键。
氢键的存在会增强PTO-NH2的稳定性,抑制PTO-NH2溶解行为,使PTO-NH2具有更强结晶性,呈现出横向二维延伸和纵向π-π堆叠结构。
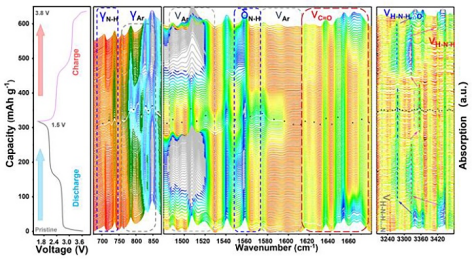
图2. 原位傅里叶红外光谱。
原位红外分析。为了揭示氢键在电化学过程中的作用,作者采用原位红外光谱研究了氢键和官能团演变规律。图2展示了电化学过程中不同官能团(C=O、-NH2和C-H)的FTIR光谱变化。对于C=O基团,在前三分之一放电过程,f-C=O吸收峰(1660 cm-1)减弱,而相应的a-C=O吸收峰(1620 cm-1)仅在剩余放电过程中减弱,这一现象证实了PTO-NH2中同时存在f-C=O(33%)和a-C=O(66%),且Li+先与材料边缘f-C=O反应,然后再嵌入HBN中a-C=O内。
对于-NH2基团,f-NH2吸收峰(3420~3450 cm-1)和a-NH2吸收峰(3330-3390 cm-1)分别红移到3320 cm-1和3270 cm-1,这是由于Li+嵌入增强了-C=O和-NH2间氢键的共轭作用,在最后四分之一放电过程(第四个Li+嵌入过程,四电子态),f-NH2明显蓝移到3360 cm-1,这是因为在四电子态,边缘f-NH2处的N-H键与整个共轭HBN结构之间的超共轭效应加强了N-H键。
对于Ar,vAr-L和vAr-H峰面积分别与偶极矩和分子对称性有关,这两个区域在电化学过程中呈现出完全不同变化趋势,发现中间两电子态(放电过程的一半)具有良好对称性,但具有较大瞬态偶极矩,这与其不稳定性有关,而在四电子态,这两个区域的峰强度与原始态一致,即四电子态比中间两电子态具有更小偶极矩、更高共轭结构和稳定性。
以上原位红外光谱揭示了氢键在充放电过程中的作用,深入分析了氢键含量和氢键网络结构的可逆演化过程,表明这种可逆的氢键网络结构可以降低PTO-NH2在电解质中的溶解度。
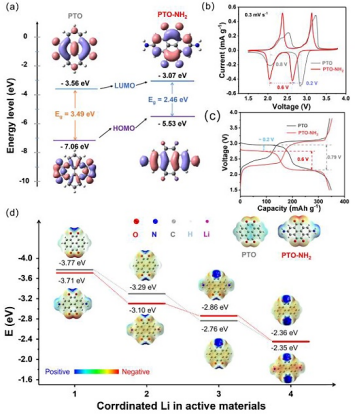
图3. DFT计算。(a) PTO和PTO-NH2的LUMO-HOMO图;(b) PTO和PTO-NH2的CV曲线;(c) PTO和PTO-NH2的充放电曲线;(d) 锂化后PTO和PTO-NH2的吉布斯自由能和静势图。
理论计算分析。为了评估-NH2基团对PTO单元电化学的影响,作者进行了DFT理论计算。结果表明,引入NH2提高了PTO最低未占分子轨道(LUMO)能级(从-3.56到-3.07eV)和最高已占分子轨道(HOMO)能级(从-7.06到-5.53eV),且PTO-NH2的LOMO-HOMO带隙(2.46eV)比PTO带隙(3.49eV)更窄。
由于还原电压与LUMO水平呈线性负相关,而电子电导率与Eg值呈正相关,所以PTO-NH2的还原峰和平台电压差(2.64/2.04 V,0.6 V)低于PTO(2.86/2.06 V,0.8 V),PTO-NH2的电子电导率高于PTO。
此外,PTO-NH2的浸润性和电荷转移阻抗低于PTO,表明PTO-NH2的离子转移动力学更快。PTO-NH2的实际容量为349 mAh/g(理论容量的95%)高于PTO(352 mAh/g,86%),说明引入氢键网络后展现出更高的活性位点利用率,归因于PTO-NH2的高共轭和电子电导率。
PTO和PTO-NH2的静电势分布图显示C=O周围电子云是最负区域,表明C=O是活性中心。对于PTO-NH2,-NH2具有共轭效应,提供额外电子,扩大共轭区域,有助于减小电压降,提高电子电导率。
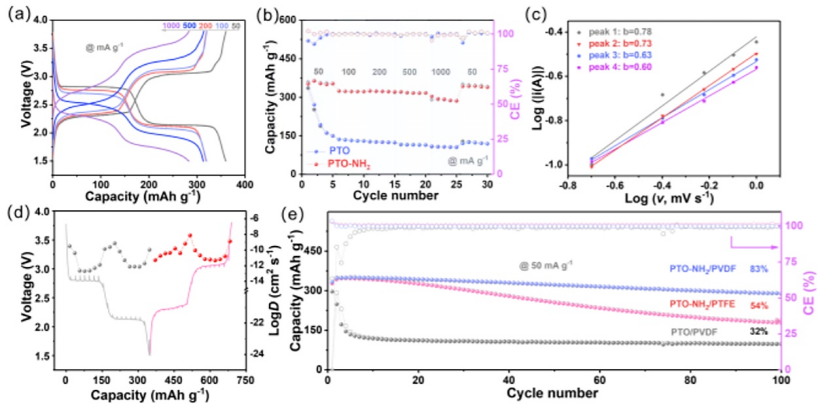
图4. 电化学性能测试。(a) 不同电流密度下PTO-NH2充放电曲线;(b) PTO和PTO-NH2倍率性能;(c) b值计算;(d) 离子扩散系数计算;(e) PTO和PTO-NH2循环性能。
电化学性能分析。最后,作者通过测定PTO和PTO-NH2的倍率性能和循环稳定性来进一步评估氢键对电化学性能的影响。PTO-NH2在1 A g-1仍展现出292 mAh g-1的高放电容量,远高于PTO(135 mAh g-1),表明PTO-NH2具有优异倍率性能。
根据不同扫描速率(0.2-1.0 mV s-1)下进行CV曲线计算出的b值在0.6-0.78之间,说明PTO-NH2具有电池和赝电容的双重性质。循环100次后,PTO-NH2容量保持率为83%,明显优于PTO(32%),表明引入氢键提高了有机正极材料的稳定性。
04
总结
作者通过分子设计思想,在PTO-NH2中形成分子间氢键(C=O中O和-NH2中H之间),构筑氢键网络结构,使有机分子呈横向二维延伸和纵向π-π堆叠结构。通过原位红外光谱跟踪了氢键可逆演化过程,发现氢键可以稳定材料在电化学过程中的两电子中间反应态,更有利于两电子态向四电子态发生稳定转变,因而PTO-NH2比PTO具有更稳定的循环性能。
此外,-NH2的引入扩大了共轭平面,缩小了过电位,加快了电子传导和Li+嵌入过程,提高材料活性中心利用率至95%。电化学性能测试结果表明,PTO-NH2展现出350 mAh g-1的高初始容量、良好倍率性能(1 A g-1下为292 mAh g-1),在50 mA g-1下循环100次后容量保持率为83%。本研究阐明了电化学过程中氢键作用,为抑制有机电极的溶解提供了一种新的材料设计思路,为高性能有机正极材料设计提供了全新策略。
审核编辑:刘清
-
锂离子电池有机正极材料2022-11-14 2650
-
锂离子电池正极材料性能分析方法汇总概述!2023-01-29 3097
-
锂离子电池的类型2013-05-17 4964
-
锂离子电池的性能2013-06-13 5480
-
锂离子电池的基本组成及关键材料2013-07-03 4216
-
有机化合物可作为锂离子电池正极材料2015-11-17 5469
-
锂离子电池和锂电池的区别2015-12-28 5681
-
锂离子电池简介2020-11-03 2721
-
如何选择动力型锂离子电池的正极材料?2021-05-12 3194
-
锂离子电池正极和负极是什么材料2009-10-20 1405
-
锂离子电池正极材料2009-10-21 2633
-
磷酸铁锂——新型锂离子电池正极材料2009-10-27 1375
-
高性能锂离子电池正极材料制备技术2009-11-20 763
-
南开大学开发出一种具有超高容量的锂离子电池有机正极材料2019-05-17 1387
-
什么是锂离子电池正极材料?2021-06-11 6121
全部0条评论

快来发表一下你的评论吧 !

