

双曲线微流控测定方法,用于拉伸应变下血小板机械转导机制研究
描述
血小板是生理性止血和病理性血栓形成的核心参与者。机械血流参数(血液动力学)是血小板信号转导和功能的重要驱动因素。心血管疾病和/或影响其功能的血液接触医疗器械会引起血小板各种血液动力学的变化,包括狭窄部位的壁面剪切应力/应变的增加;附着在血管壁、血栓或医疗器械表面上的拉伸力和压缩力的变化;以及由于红细胞着边和流动再循环引起的区域内质量传输现象。血小板将这些外部机械信号转导为细胞内生化信号(机械转导)。这些不同的机械转导机制的关键联系是细胞溶质钙[Ca²⁺]c通量,它整合了不同的信号转导途径并驱动相关的血小板激活事件,例如血小板形状变化和整合素αIIb β₃的激活。
目前,已有多种技术被用于进行血小板机械转导机制的研究,包括锥板和平行板流变测定法、微流控层析法、基于刚性和可变形弹性基板的静态粘附测定法,以及微量移液器抽吸或磁珠牵引法。然而,这些技术虽然可用于粘附受体介导的血小板机械转导机制研究,但无法用于缺乏粘附受体或表面粘附作用的自由流体中血小板机械转导机制的研究。此外,常见的基于流体流动的技术,例如微毛细管技术、直通道微流控技术和平行板技术,通常涉及混合动力学(包含剪切和拉伸分量),并且相关的研究大多数只关注壁面剪切效应。为了更准确地定义驱动血细胞和血小板行为的血液动力学参数,相关研究方法逐渐由使用可以提供稳态层流剪切流的简单直通道转变为使用更复杂的几何结构,例如阶梯式微收缩几何结构、具有复杂分叉微通道的微流控系统、交叉槽式装置和双曲线收缩结构。
据麦姆斯咨询报道,近期,来自澳大利亚莫纳什大学(Monash University)、墨尔本大学(The University of Melbourne)以及皇家墨尔本理工大学(RMIT University)的研究人员联合提出了一种双曲线微流控测定方法,用于研究不同拉伸应变状态下血小板的激活。通过理论计算和实验方法的结合,该研究探索了瞬时和时间相关的拉伸应变动力学对血小板Ca²⁺信号和机械转导方式的影响。此外,通过使用5个具有不同几何结构的双曲线微流控测定系统,该研究明确了触发最大血小板[Ca²⁺]c通量的拉伸应变上限。最后,该研究进行了药理学概念验证实验,阐明了血小板肌动蛋白细胞骨架和环状微管在血小板拉伸应变传感(ε˙-S)中的作用。相关研究成果以“A microfluidic method to investigate platelet mechanotransduction under extensional strain”为题发表于Research and Practice in Thrombosis and Haemostasis期刊。
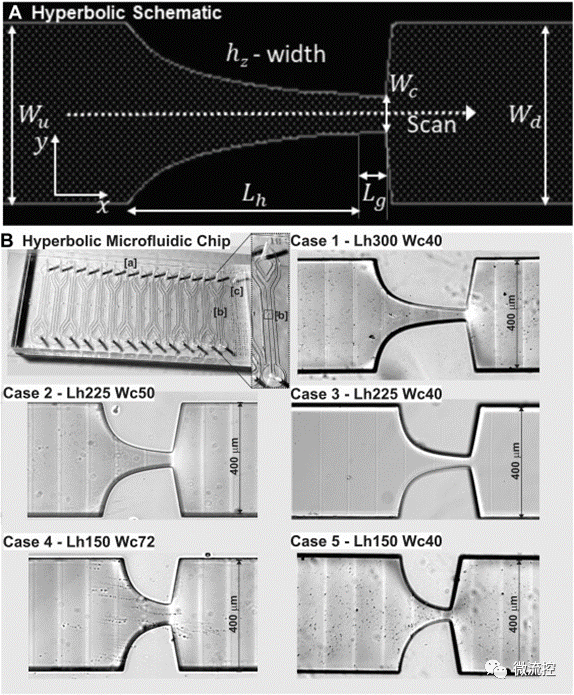
双曲线微流控芯片的设计
研究结果表明,在缺乏典型粘附的情况下,受体介导的血小板对747/s~3319/s范围内的拉伸应变率的初始增加和随后的减少高度敏感。此外,研究证明血小板可快速响应拉伸应变的变化率,且其阈值为7.33 × 10⁶/s/m,最佳范围为9.21 × 10⁷/s/m~1.32 × 10⁸/s/m。此外,该研究证明了基于肌动蛋白的细胞骨架和环状微管在调节拉伸应变介导的血小板机械转导中的关键作用。
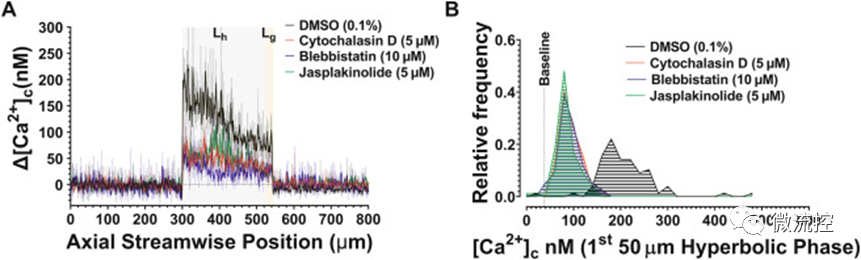
血小板拉伸应变传感(ε˙-S)过程中[Ca²⁺]c通量受肌动蛋白细胞骨架动力学调节
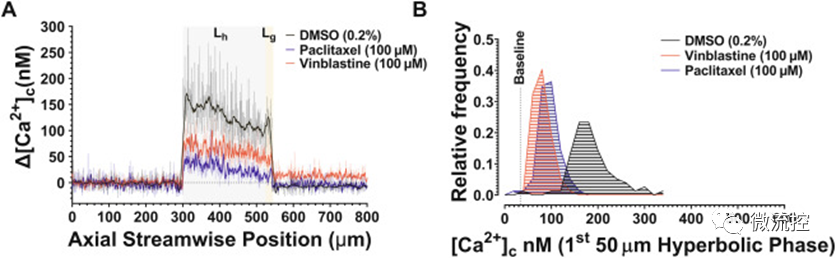
血小板拉伸应变传感(ε˙-S)过程中[Ca²⁺]c通量受微管动力学调节
总体而言,该研究开发了一种双曲线微流控测定方法,用于在定义的准均匀拉伸应变率下评估血小板机械转导。通过改变双曲线微流控芯片的几何结构和输入流速,该测定方法可以用于探索适用于生理和病理血流环境下的不同拉伸应变机制。这种方法打开了一个新的血小板信号转导机制研究的窗口,并且可能在识别易患与高度动脉狭窄相关的血栓栓塞并发症的患者或在其中拉伸应变率是主要血液动力学驱动因素的机械循环支架(MCS)系统中具有潜在的诊断效用。在未来的研究中,研究人员的目标是利用所描述的方法进一步探索支持拉伸应变传感(ε˙-S)的信号转导过程。更好地理解这种新型的不依赖于粘附作用的信号转导机制可能会促进抗血小板疗法的新发展,这些疗法专门针对超生理血流动力学,可最大限度地降低全身出血的风险,并在与医疗器械相关的血栓形成管理方面优于目前的疗法。
论文链接: https://doi.org/10.1016/j.rpth.2023.100037
审核编辑 :李倩
-
AD画双曲线轮廓2016-05-28 7373
-
请问印制PCB电路板机械切割的方法有哪些?2021-04-20 2520
-
基于电磁谐振技术的微水测定新方法研究2009-10-16 936
-
双曲线函数发生电路2011-10-13 1256
-
研究人员设计了一款能够实时测量血小板强度的微流控装置2019-03-22 4025
-
机械式拉力试验机的简介2020-03-29 1600
-
新品推介:创想智控弹性拉伸应变传感器2022-10-20 1805
-
PCB曲线分板机有什么特点?2022-04-09 1363
-
如何利用微流控技术实现血小板在肺血管系统中的高效生成?2023-07-24 2938
-
可拉伸导电水凝胶用于应变传感研究获进展2023-10-18 1300
-
gbt528-2009 硫化橡胶或热塑性橡胶拉伸应力应变性能的测定2023-07-26 1989
-
液态金属基微流控柔性应变传感器,用于人体运动和生理信号监测2023-12-18 3841
-
北海道大学:基于ZnO纳米粒子激光诱导石墨烯的超灵敏可拉伸应变传感器2024-11-20 1249
全部0条评论

快来发表一下你的评论吧 !

