

王春生教授nature:用于极端工作条件下的锂电电解液设计
描述
研究背景
目前现有的基于碳酸酯的最先进电解质无法满足极限锂离子电池(LiNi0.8Mn0.1Co0.1O2 (NMC811)||石墨锂)的大部分要求,如期望具有支持较高电压(≥4.5伏)、快速充电(≤15分钟)、宽温度范围(±60摄氏度)充放电(不镀锂)和不可燃性的能力。因为没有有效的可以概括此类电解质中电池性能、溶剂化结构和固体电解质-相间化学之间关系的原则来指导电解质的设计。
成果简介
近日,美国马里兰大学王春生教授,美国陆军实验室Oleg Borodin教授联合提出了一种基于一系列软溶剂的电解质设计方案,该策略在弱Li+溶剂相互作用、足够的盐解离和所需的电化学之间取得平衡,以满足所有上述要求。值得注意的是,4.5伏NMC811||石墨硬币电池的面积容量超过2.5毫安小时每平方厘米,当这些电池在- 50摄氏度(- 60摄氏度)以0.1C的C速率充放电时,保留了75%(54%)的室温容量。而NMC811||石墨袋电池与低电解质(2.5克每安培小时)实现稳定的循环,平均库仑效率超过99.9%在−30摄氏度。综合分析进一步揭示了NMC811阴极与石墨阳极之间的阻抗匹配,这是由于形成了相似的富氟化锂界面,从而有效地避免了低温镀锂。这种电解质设计原则可以推广到在极端条件下工作的其他碱金属离子电池。
研究亮点
1. 在本文中,作者提出了独特的平衡电解液设计原则,即取具有适中的DN值和介电常数的溶剂,满足该条件可使得电池应用于极端条件。这可以使Li+与溶剂的结合能最低且锂盐解离性最高。
2. 加入具有高还原电位的MDFSA作为共溶剂,进一步降低Li+的溶剂化程度,促进富LIF的SEI和富lif的CEI的形成。
3.正极和负极的热力学(容量)和动力学(阻抗)匹配使实际面积容量超过2.5 mAh cm-2的NMC811||石墨电池具有在较宽的温度范围内(-60℃~60℃)进行快速充放电的能力,无需镀锂。
4. 全电池在-30℃的温度条件下进行300次循环后仍保持超过83%的容量,平均库伦效率超过99.9%。
图文导读
首先作者建立了平衡电解质的设计原则,溶剂选择有两个标准,第一个是低冰点、适中沸点和较宽的电化学稳定窗口,第二个是软溶剂化能力,确保低Li+离子脱溶能,同时不牺牲离子解离能力,如图1a所示。根据图1b,c大多数已知的具有高盐解离能力的极性溶剂具有高DN(》10)(图1b中的I和II区)16,17,具有低DN和低介电常数的极性溶剂具有较差的盐解离能力(图1b,c中的III区),代表非溶剂化稀释剂。其中存在一个平衡区域(IV区),由具有中等介电常数的低DN溶剂组成,导致中等的Li+—溶剂结合能和盐解离。由上述标准选定了一个氟化酯族(二氟乙酸乙酯(EDFA), 2,3,3,3-四氟丙酸甲酯(M4FP),二氟乙酸甲酯(MDFA)和2,2-二氟-2(氟磺酰)乙酸甲酯(MDFSA);图1d所示的化学结构)作为溶剂,因其氟化酯溶剂(MDFA、EDFA和M4FP)具有更宽的电化学稳定窗口,更高的热稳定性和超低冰点,其中甲基(3,3,3-三氟哌酸盐)(M3FP)先前在- 60°C低温下已在锂金属电池中显示出较好的结果。
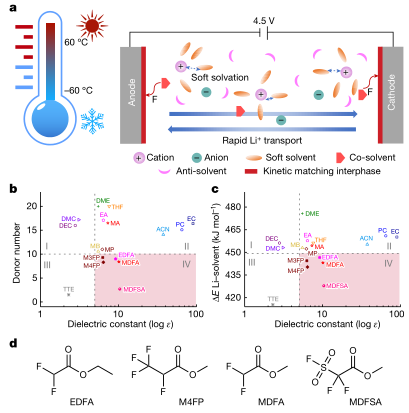
图1 |电解质设计策略。a,说明了软溶剂与Li离子之间的软溶剂化,锂离子的快速迁移和宽温度范围(±60°C)的稳定性。b, DN与介电常数的溶剂关系图。位于IV区的溶剂称为软溶剂,其中较低的DN和较高的介电常数有效地降低了Li+—溶剂的亲和力,而不牺牲动力学迁移。c, DFT计算的Li+ -溶剂结合能与实验介电常数的关系。雨,乙腈;DMC,碳酸二甲酯;测距装置,乙二醇二甲醚;EA,乙酸乙酯;EC,碳酸乙烯;MB,丁酸甲酯;MP,丙酸甲酯;PC,碳酸丙烯;四氢呋喃(四氢呋喃。d,软溶剂化溶剂的化学结构。
为了最大限度地提高离子导电性,软溶剂需要与高解离性和可溶解性锂盐相结合。LiTFSI具有较高的解离性和较弱的Li+结合能,在MDFA、EDFA和M4FP溶剂中的溶解度分别为5.0 M、4.5 M和3.0 M,是较好的选择。
软溶剂化溶剂本质上有利于在溶液中形成主要的离子对和聚集体,因此也促进富氟化锂(LiF)固体电解质界面相(SEI)和正极电解质界面相(CEI)的形成。加入2.2 V高还原电位的MDFSA作为共溶剂(氟磺酰基取代的二甲基二甲基呋喃;分子结构如图1d所示),进一步降低Li+的溶剂化程度,促进富lif的SEI和富lif的CEI的形成。当TTE在混合溶剂中的体积比超过40%时,加入1,1,2,2-四氟乙基-2,2,3,3-四氟丙基醚(TTE)稀释剂可使电解质不易燃。
在SEI自限形成过程中,增加LiF含量有望降低其厚度,即使在低温下也会降低区域特定电阻。在不同电流和温度下,SEI和CEI相似的富含lif的成分也改善了石墨阳极和NMC811阴极之间的过电位、容量和动力学匹配,允许最大的电池容量和通过控制电池电压防止Li0电镀。相比之下,传统碳酸盐电解质中形成的无机-有机SEI/CEI导致阳极和阴极之间的容量不匹配和过电位,从而影响了全电池的高速率和低温性能。
其次作者探索了选择电解质的理化性质和溶剂化结构。将LiTFSI溶解到不同溶剂中后,利用拉曼光谱对TFSI−···Li+配位进行了表征。由图2a可知MDFA具有最低的溶剂化能力,LiTFSI盐浓度的增加和TTE的加入进一步降低了Li+ -溶剂配位,导致离子聚集增加。利用核磁共振(NMR)探索电解质在不同溶剂(乙酸甲酯(MA)、EDFA、MDFA和M4FP)下的溶剂化结构。M4FP最小的Δδ为2.0 ppm(图2b)与Li+ -溶剂最弱的相互作用直接相关,与DN值一致。对所制备的电解质的离子电导率进行了测试如图2c所示。正如上文所述,M4FP基电解质的离子电导率最低,因为它具有最低的DN和介电常数。在20℃时,EDFA、MDFA和M4FP的离子电导率分别为1.8 mS cm−1、1.7 mS cm−1和0.6 mS cm−1,略低于EC/DEC电解质(6.4 mS cm−1)。然而,如图2C所示,由于电解质凝固(图2d),在低于- 20°C的温度下,mdfa基电解质的离子电导率优于EC/DEC电解质。综合考虑Li+—溶剂结合能、离子电导率、电化学稳定窗口等因素,选择1m LiTFSI MDFA/ MDFSA-TTE电解液进一步探索可能性。利用x射线对分布函数(PDF)进一步分析了1 M LiTFSI MDFA/ MDFSA-TTE电解质的溶剂化结构。实验结果与分子动力学(MD)在实(R)空间(图2e)模拟结果吻合较好。MD模拟箱的快照(图2f)表明TTE和MDFA的加入促进了离子聚集。在混合MDFA/MDFSA - tte溶剂电解质中,Li+主要由1.92个MDFA和1.66个TFSI−离子配位,MDFSA贡献0.09个(图2g)。
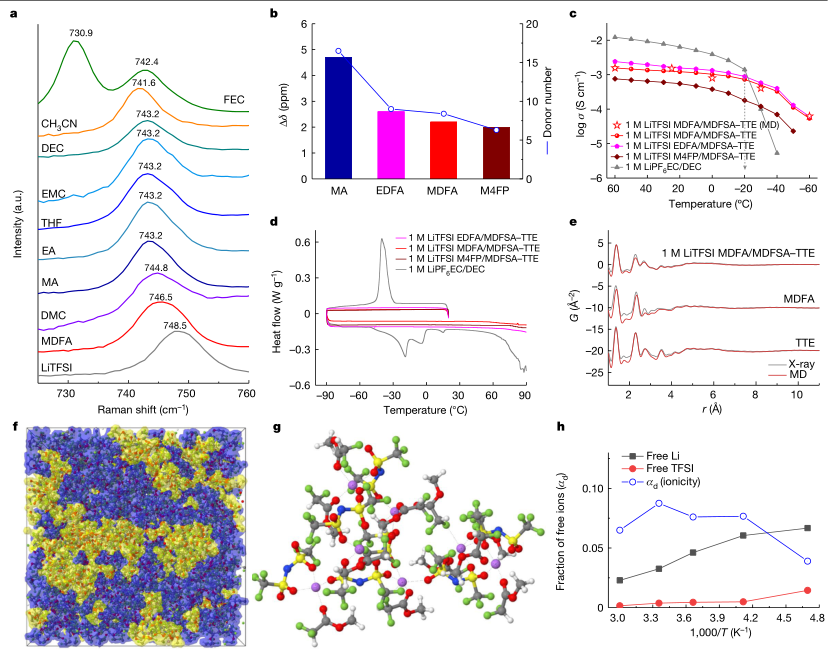
图2 |电解质的物理性质。a, 1 M LiTFSI在不同溶剂中的拉曼光谱。b,在不同溶剂中含LiTFSI和不含LiTFSI的Δδ(羰基碳的13C NMR谱)的总结。c,不同电解质导电性的温度依赖性。红色星号为不同电解质MD. d、DSC冷却和加热曲线预测的电导率值。e, 1 M LiTFSI MDFA/ MDFSA-TTE电解质和单一溶剂的PDF数据。灰线,实验数据;红线,MD模拟预测。f-h, MD仿真结果。f, 1m MDFA/ MDFSA-TTE仿真盒快照。LiTFSI-MDFA为黄色等值面,TTE和MDFSA为蓝色等值面。g, 25°C时MD模拟的代表性离子聚集体。Jmol采用的配色方案有:Li紫色;N,蓝色;F,绿色;S,黄色;C、灰色;O,红色;H,白色。h,游离Li+和TFSI的分数-定义为在5.0 Å范围内不与Li - n (TFSI)的任何反离子配位的离子,以及MDFA/ MDFSA-TTE电解质中1 M LiTFSI的动力学不相关运动ad(离子性)的程度。
接着作者探索了4.5 v NMC811||石墨全电池的电化学性能。图3a显示,1 M LiTFSI MDFA/ MDFSA-TTE电解质的全电池性能优于EC/ DEC电解质。1 M LiTFSI MDFA / MDFSA-TTE电解质经过400次循环后显示容量保留80.1%,平均CE为99.94%。与1M LiPF6 EC/DEC相比,呗性能的改善如图3b所示,1C时的容量为202 mAh g−1,2C时的容量185 mAh g–1,3C时的容量169 mAh g-1,4C时的容量140 mAh g-1(此处,C速率由充电时间决定,1C等于1小时,依此类推)。使用1M LiTFSI MDFA/MDFSA–TTE的不同C下电池的相应充电/放电电压曲线如图所示3c。
NMC811||石墨全电池在低温下也表现出优异的性能。图3d显示了在−30°C时,260次循环后仍能保留93.9%的容量,平均CE为99.98%。在低至−50°C/−60°C的温度下,观察到容量衰减略快。图3e比较了NMC811||石墨全电池在两种不同温度下的性能。−30°C下EC/DEC电解液凝固不能在工作,而1M MDFA/ MDFSA-TTE电解质的NMC811||石墨全电池在低温下的容量显示出较高的容量:在0°C、−20°C、−30°C、−40°C、−50°C和−60°C循环时,容量分别为206.8 mAh g−1(95%)、194.5 mAh g−1(90%)、188.7 mAh g−1(87%)、184.6 mAh g−1(85%)、161.0 mAh g−1(75%)和115.5 mAh g−1(54%)。图3f为1 M LiTFSI MDFA/ MDFSA-TTE电解质在不同温度下全电池的代表电压曲线。此外使用1 M MDFA/ MDFSA-TTE电解液的NMC811||石墨全电池,即使在- 60°C的超低温操作后,也能在25°C完全恢复原始容量。
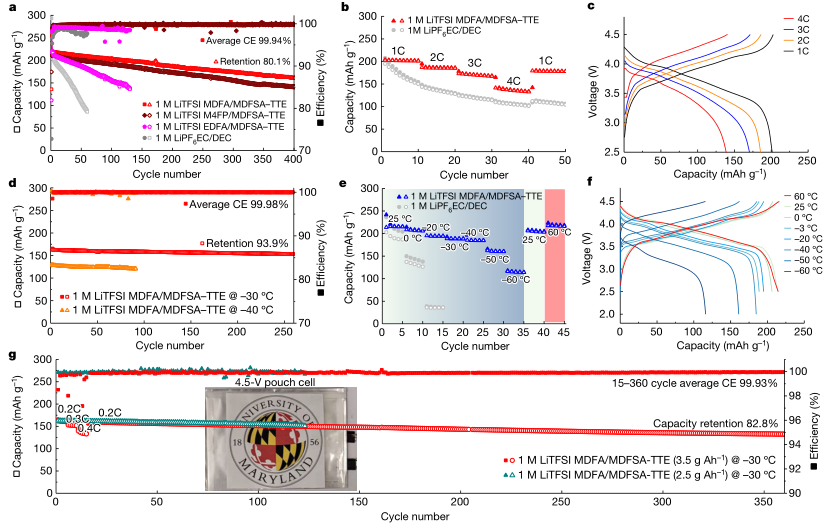
图3 NMC811||石墨全电池的电化学性能。a、25°C下0.5C时的循环性能。b, c,利率表现在25°C (b)和相应的电压概要文件(c), d-f长循环性能在0.2C,-30°c /−40°c (d),循环性能在不同温度下0.1摄氏度(60°C, 25°C, 0°C,-20°C,−30°C,-40°C,−50°C和−60°C) (e)和相应的电压概要文件使用1 M细胞e LiTFSI MDFA / MDFSA-TTE电解质(f)。g,囊细胞性能−30°C和速度0.2C使用2.5 g Ah−1或3.5 g Ah−1电解质。使用3.5 g Ah−1电解质(红色)的电池在不同的C速率下(0.5C循环,0.3C循环,0.4C循环5次,0.2C循环345次)进行速率性能测试。插图:4.5V电池的照片。
最后作者进行了循环后电极界面化学表征
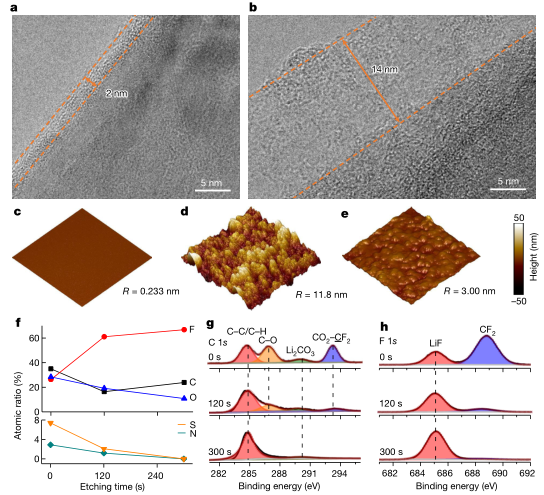
图4 −30℃循环后石墨阳极上SEI层的表征。a,b,含有1 M LiTFSI MDFA/ MDFSA-TTE电解质(a)和1 M LiPF6 EC/DEC电解质(b)的HRTEM图像。橙色虚线用于勾勒出循环石墨阳极上的SEI。c - e,在1 M LiPF6 EC/DEC电解质和1 M LiTFSI MDFA/ MDFSA-TTE电解质中循环前(c)和循环后(d)的石墨电极形貌(e)。在0.5 μm × 0.5 μm面积上的AFM粗糙度(R)比较。f - h, 1 M LiTFSI MDFA/ MDFSA-TTE电解质中循环石墨SEI的XPS结果:定量SEI中元素的原子比(f),相应深度剖析结果的列中显示C 1s (g)和f 1s (h)光谱。
为了确定界面化学性质,作者系统地研究了石墨阳极上SEI的形貌和组成。
在高分辨率透射电子显微镜(HRTEM)下,在MDFA/MDSFA基电解质中循环20次后,在石墨阳极上观察到均匀而薄的约2 nm的SEI(图4a)。如此低的厚度体现了基于LIF的界面相在绝缘电子隧穿中的有效性。相比之下,EC/DEC基电解质的SEI层要厚得多,约为14 nm(图4b)。利用电化学原子力显微镜(AFM)研究了SEI的粗糙度和厚度。如图4c-e所示,原始石墨颗粒表面光滑,粗糙度约为0.233 nm。AFM得到的MDFA/MDSFA基电解液中循环石墨的粗糙度增加到约3.0 nm(图4e) 与HRTEM观察结果一致,远小于EC/ dec基电解液中约11.8 nm的粗糙度(图4d)。
为了鉴定循环石墨阳极上SEI的化学成分,采用了x射线光电子能谱(XPS)和Ar+溅射深度分析。从1 M LiTFSI MDFA/ MDFSA-TTE电解液中回收的石墨SEI中检测到的元素及其相关原子比如图4f所示,C 1s和F 1s光谱分别如图4g和图4h所示,可以得出在该电解质中形成了一个内层富含LiF,外层富含有机物的坚固的双分子层SEI。
总结与展望
在该篇论文中,作者建立了在极端条件下工作的高能电池的电解质设计原则。该原理的核心是识别具有相对较低DN(小于10)和高介电常数(大于5)值的溶剂,这将最小化Li+ -溶剂结合能,同时仍能解离锂盐。该设计原理为高电压、快速充电和宽温度工作电池开辟了方向。
审核编辑 :李倩
-
锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?2024-01-11 2502
-
电解液与SEI的关系?电解液对SEI的影响?2023-11-10 1486
-
电池原材料要怎么选择?锂电池的电解液2023-04-18 2005
-
软溶剂锂离子电池电解液,在-60℃环境中可提供54%的室温容量2023-02-14 1661
-
深度解读钴酸锂体系电解液应用2021-04-17 8008
-
电解液宽温性能的影响因素和宽温电解液研究进展2020-10-21 12286
-
锂电池电解液的组成部分_锂电池电解液的危害2020-08-03 11670
-
锂电池电解液是什么_锂电池电解液主要成分2020-03-30 50689
-
电解液——锂电池的‘血液’2018-08-07 5927
-
锂电池电解液价格走势2018-03-08 11371
-
电解液电容器老化电压与电解液火花电压的关系2013-12-30 4288
-
现在的锂电池都是用什么样的电解液?电解液里加入什么添加剂?2009-10-23 5129
全部0条评论

快来发表一下你的评论吧 !

