

分子组装理论基础的探究
描述
分子组装是在分子以上层次创造新物质、产生新功能的重要手段. 提升分子组装过程的可控性和组装体功能性是该领域的核心目标, 但由于研究复杂分子组装体系的手段和理论的匮乏, 迄今绝大部分研究只能限于了解组装过程始末的“黑箱”模式, 这成为该领域的发展瓶颈之一. 厦门大学田中群院士等人围绕分子到亚细胞层次的分子组装体系及其理论方法与模型, 尝试将物质、能量与信息作为度量分子组装研究复杂性的三个维度, 从简单到复杂地逐级剖析探讨分子组装的理论研究现状、机遇和突破口. 首先, 在物质维度上揭示分子组装过程呈现多路径、多阶段和多尺度等复杂性; 进而在物质基础上引入能量维度, 阐明熵驱动或熵焓互补现象普遍存在于分子组装体系中, 并探讨远离平衡态的分子组装体系如何产生时空有序的功能耗散结构; 继而在物质与能量基础上引入信息维度, 探讨分子组装信息网络中的正、负反馈协同, 以及如何促使系统涌现出复杂的生理功能. 为了突破分子组装理论研究的瓶颈, 似乎亟需建立更大的框架. 从物质、能量和信息的三个维度协同研究, 有望系统深入认知组装规律, 进而建立新理论, 发展高效精准的调控手段, 提升分子组装体系的复杂性和功能性, 并可能为生命科学和软物质科学提供新视角和新方法.
物质科学是以认知自然物质结构和相互作用规律, 进而以创造新物质和产生新功能为主要目标的科学, 而化学合成和分子组装是两种最重要的手段 (图1a). 化学合成历经两世纪, 着重于共价键的操控, 已发展出成熟的合成方法学, 在分子层次创制新型化合物, 极大拓展了化学合成的边界, 丰富了人类的物质生活. 但是, 基于共价合成的材料在复杂性和功能性等各方面仍无法满足当今日益增长的物质需求. 分子组装(molecular assembly)则在分子层次以上, 基于范德华力、氢键和静电相互作用等非共价键作用 (以下简称非键作用), 提供一种创制分子机器、智能器件和自愈合材料等功能材料和仿生材料的有效途径, 也为从分子相互作用角度理解复杂的生命现象提供指导方法. 因而在物质科学中, 分子组装与化学合成二者相互交融, 协同发展.
相较于成熟的合成化学研究 (图1b), 分子组装研究起步较晚, 发展尚不成熟. “分子组装” 的基础和概念雏形最早可追溯至范德华力(1873年)和“锁–钥”模型(1894年) 的提出, 随后氢键、卤键和亲疏水作用等非键作用的发现, 极大丰富了非共价作用的类型, 然而当时这些观测结果是独立分散和局域的, 缺少对分子组装领域整体性的归纳与认知, 因而限制了该领域的进一步发展. 1960年代, Charles Pedersen、Jean-Marie Lehn和Donald Cram相继合成一系列具有离子选择性识别的大环分子, 如冠醚、穴醚等, 并因此荣膺1987年诺贝尔化学奖. 在此基础上, Lehn于1988年延伸了分子识别的概念, 正式定义超分子化学为“chemistry beyond the molecule”,指出“超分子化学是分子层次以上, 研究多种分子通过非共价相互作用形成有序功能聚集体的化学”. 1980年代, 化学家发现一系列有机硫分子可在金表面自发形成有序的单层膜结构. 1991年, Whitesides等基于此类现象, 提出分子自组装 (molecular self-assembly) 概念, 即分子在平衡态下, 通过非共价作用自发形成稳定、规则聚集体的过程. 此外, 一系列新概念 (如“非共价合成”和“自适应”等) 的提出与碰撞, 也促使分子组装领域蓬勃发展.
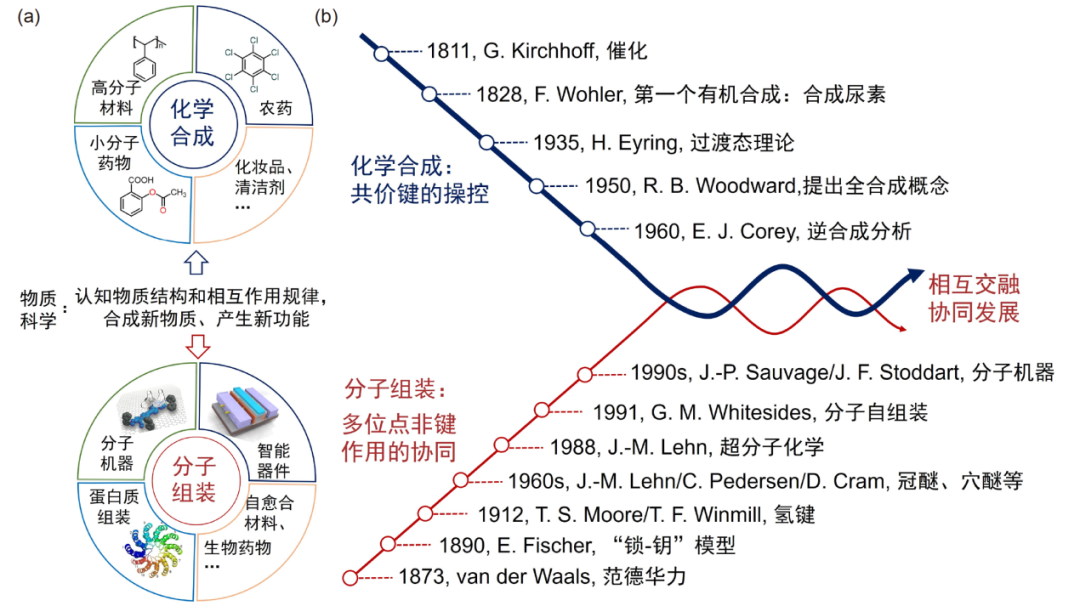
图1 (a) 化学合成与分子组装分别在物质科学中的作用和定位. (b) 二者相互交融且协同发展的化学合成与分子组装的发展简史.
分子组装的概念虽然提出较晚, 但分子组装现象广泛存在于生命体中, 如DNA双螺旋结构、蛋白质的多级结构和磷脂双分子层等, 并成为复杂、精妙的生命体功能的基石. 而人工分子组装领域在化学家的努力下和自然界的启发下, 历经三十余年, 在各方面取得长足的发展: 在结构复杂性方面, 大量具有精妙拓扑结构的组装体被制备, 如分子纽结、共价–非共价杂化聚合物和巨分子组装体等; 在可控性方面, DNA折纸术、框架核酸自组装和框架诱导组装等策略被用于构筑形状、尺寸可控的组装结构;在功能性方面, 人工光合组装体、肿瘤治疗和载药等实现了材料性能的跨越式发展.
分子组装通过 “自下而上” (bottom-up) 的方式, 依靠分子间多位点非键作用的协同, 实现在分子尺度, 精准控制材料形貌与缺陷, 已成为传统的 “自上而下” (top-down) 之外的重要加工方法. 然而, 目前人工分子组装体系仍无法达到生命体中的分子组装体系的复杂、精妙和 “智能”, 且缺乏高效、精巧且温和的调控手段. 因此, 很可能需要全面拓展乃至革新分子组装的研究范式, 深化拓展其理论基础.
目前分子组装的研究范式以设计组装基元为核心, 通过改变组装基元获得不同的组装体结构和功能. 然而, 由于针对多位点非键作用的研究手段和分子组装理论的匮乏, 尚无法详细研究大部分的组装过程. 这种只关注始末的“黑箱”研究范式极大限制了组装领域的发展.因此, 近年来分子组装过程的机理和理论研究愈发受关注. 但是, 现有分子组装研究的理论研究主要通过延伸已有的化学合成理论, 如过渡态理论、速率理论等. 关于分子组装的理论模型可追溯至19世纪初的平衡态成核生长模型, 该模型也进一步催生出Potts模型、Ising模型和胶体模型等. 但这些模型极少关注分子细节和区分各类非键作用, 导致其在拟合某些具备特定结构的组装基元的组装过程时, 产生了极大的偏差. 而随着表征技术的发展, 分子组装可在实验上被定量分析, 甚至可视化. 因此, 针对具体的实验体系, 更多的分子组装机制被提出, 如超分子聚合的非经典 “成核” 机制、手性非线性放大的热力学机制、结合数学理论的分子笼结构分析方法等. 同时, 一些生物大分子的组装机制也被深入研究, 如阿兹海默症中关键Aβ蛋白的错误折叠机制等. 但这些理论的针对性极强, 无法更全面、宽泛地指导如何精确操控非键作用和调控组装结构的动态特征, 也缺乏关键组装步骤的物理化学图像. 因此, 亟需发展更为普适的分子组装理论和研究框架.
为此, 本文通过探讨包括复杂生物大分子在内的分子组装体系和当前的理论方法与模型, 期望在物质科学的大框架下, 更系统、全局地审视现有分子组装的研究方法、理论基础和面临的挑战, 尝试发掘突破分子组装领域发展瓶颈的指导方法与机遇. 这要求我们从科学研究的哲学基础和认识论出发, 提升对分子组装研究的理解和认知. 在此方面, 著名物理学家 Anderson在1972年提出的 “More is different” 思想可能为我们指明了方向, 其中文翻译为 “多则异”, 核心为 “在复杂性的每一个层级, 都会有崭新的性质出现, 也需要有新的定律、概念和原理”. 即虽然高层级的物质科学也遵循底层级的定律, 但其表现出的行为和功能是无法仅凭底层级的理论所理解, 而表现出更高层级所独有的基本原理和核心规律. 因此, 物质科学研究普遍遵循由简至繁、逐级深入的研究规律, 而不同层级的物质科学研究的发展成熟度不同: 基于目前计算能力的局限, 越简单的体系越可精细研究, 越复杂的体系则一般较粗略研究, 并要采用“多则异”的原则去关注是否涌现出新特征和规律. 因此, 面向复杂分子组装研究, 可能需要首先对其分级分类.
控制论的创始人N. Wiener指出物质、能量与信息是组成世界的三大要素. 物质是能量与信息的载体, 能量与物质是系统与外界发生交换的主要方式, 信息则是维持系统稳定性和响应外界刺激的关键. 我们因此认为, 或许可将物质、能量与信息作为度量分子组装研究复杂性的三个维度, 进而对当前的分子组装的理论研究进行分级分类 (图2a). 在物质维度, 主要研究分子组装基元及溶剂等物质在平衡态下的组装过程, 如通过多物种的平衡组装过程, 可构建复杂的人工分子纽结(图2b). 同时也需探讨多物种在复杂组装环境中的传质过程、相互作用模式及物理化学图像; 进而在物质维度上引入能量维度, 可使分子组装体系远离平衡态, 而体系内的非线性相互作用将微小的扰动放大, 使体系产生时空有序的功能耗散结构. 如在生命体中, ATP驱使马达蛋白沿微管蛋白定向移动而实现主动运输(图2c); 最复杂的层级是在物质和能量维度之上引入信息维度并实现三者协同, 如在细胞中的转录过程中, 贮存在mRNA中的信息在GTP的驱动下, 经由转录机器 (核糖体) 将遗传信息写入蛋白质序列(图2d).同时复杂分子组装系统中的各物种将形成信息网络, 信息流在网络中被存储、处理及转换, 依靠正、负反馈的协同和不同层级间信息形式的转变, 进而涌现出自适应等功能. 目前分子组装研究主要关注物质维度, 对能量维度的研究刚起步, 对信息维度的探讨则鲜少涉及. 因此,从物质扩展到能量与信息维度, 逐级深入地理清研究思路, 进而建立跨尺度、跨层级的理论模型和计算方法. 同时在每一层级需分类研究对象, 从多维度探究分子组装机制, 把握组装过程的关键物理化学参数变化, 可能有助于高效把握各个维度的关键性特征及其关联, 全面深入认知组装规律, 全面构建不同层级分子组装过程的清晰物理化学图像和规律, 进而建立新理论和实验方法, 以期指导构建具有多样性和功能性的众多分子组装体系.
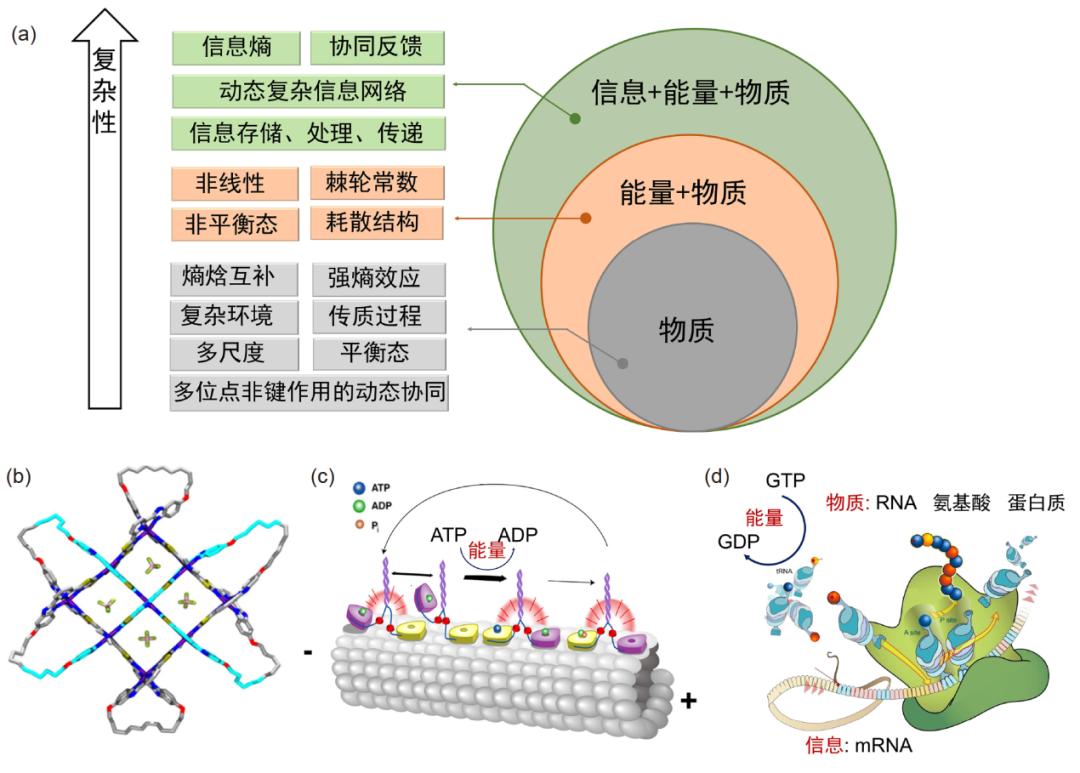
图2 (a) 分子组装研究以物质、能量及信息的三个维度进行分级分类. 随着复杂性的提升, 分子组装体系可能涌现出新特征和规律, 并体现更强的功能. (b) 在简单的物质维度: 多物种通过平衡组装过程而形成复杂的人工分子纽结. (c) 在物质基础引入能量: 在细胞中, 能量驱使马达蛋白沿微管定向移动. (d) 在物质和能量基础上再引入信息: 在细胞内的转录过程中, 存储于mRNA的信息在GTP驱动下, 经由核糖体传递至蛋白质序列.
审核编辑:刘清
-
传输线的理论基础2024-08-12 417
-
ESD分析与整改的理论基础2022-09-19 1968
-
EMC理论基础2022-06-30 718
-
智能控制--第1章 智能控制的理论基础2017-09-24 3034
-
简称 PI(power integrity)电源完整性理论基础2017-09-15 2133
-
智能控制--模糊控制的理论基础2016-12-25 782
-
电源完整性理论基础2015-12-22 830
-
【理论】电磁兼容理论基础(55页PPT)2015-08-23 4555
-
电路理论基础习题2011-06-19 3160
-
开关理论基础(一,二册)2009-09-25 4757
-
CT的理论基础及理论发展2009-06-14 1088
-
真空技术的理论基础2009-05-20 972
全部0条评论

快来发表一下你的评论吧 !

