

用于活病原体快速检测的微流控系统研究进展
描述
快速、敏感和选择性地检测活病原体仍然是质量控制和风险评估的关键优先事项。而传统方法往往需要复杂的工作流程、昂贵的试剂、实验室设备,并且耗时,不适合现场检测和在低资源环境的应用。开发低成本和快速的替代方法来检测不同环境基质中的活病原体已引起越来越多的关注。其中,以小型化方式集成各种实验室功能的微流控系统已被证明是一种有前途的病原体快速敏感检测工具。
基于此,英国克兰菲尔德大学(Cranfield University)杨竹根教授简要总结了近年来发展起来的新型微流控系统,并就检测时间、检测限和目标生物等方面与传统方法进行了比较,讨论了专门用于检测活病原体的微流控系统的发展。此外,该论文还展望了微流控系统用于活病原体检测的前景,并重点讨论了微流控系统在快速、低成本的现场检测方面的应用潜力。
检测活病原体的常规技术
尽管存在一些缺陷,例如无法检测不可培养的细菌以及耗时耗力的检测方案,但基于培养的微生物分析由于其高灵敏度、特异性和定量能力,仍然是活病原体检测的金标准(图1)。几种市售检测微生物指标(如大肠杆菌)的方法都是基于细胞培养方法。
该方法依赖于使用特定的生长培养基来选择性地培养和分离感兴趣的病原体。活细胞的检测通过在固体培养基上培养菌落、测量液体培养物的光密度或直接使用显微镜计数细胞来实现,通常需要数天甚至数周才能得出结果,这取决于病原体形成可见菌落的能力。
此外,虽然阳性培养结果可以作为活体有机体的确凿证据,但阴性培养结果不能作为样本中没有活细胞的证据。因此,检测不可培养细菌(VNCB)活体仍然是最重要的挑战之一,这可能导致临床诊断(如药物敏感性检测)中的假阴性结果和危险后果。此外,常规的检测技术不适用于低资源环境,因为它们需要昂贵的实验室设施,而且训练有素的人员可能需要几天甚至几周才能得出结果,这使得它们对于常规水质监测或快速追踪疾病暴发等特定任务不切实际。
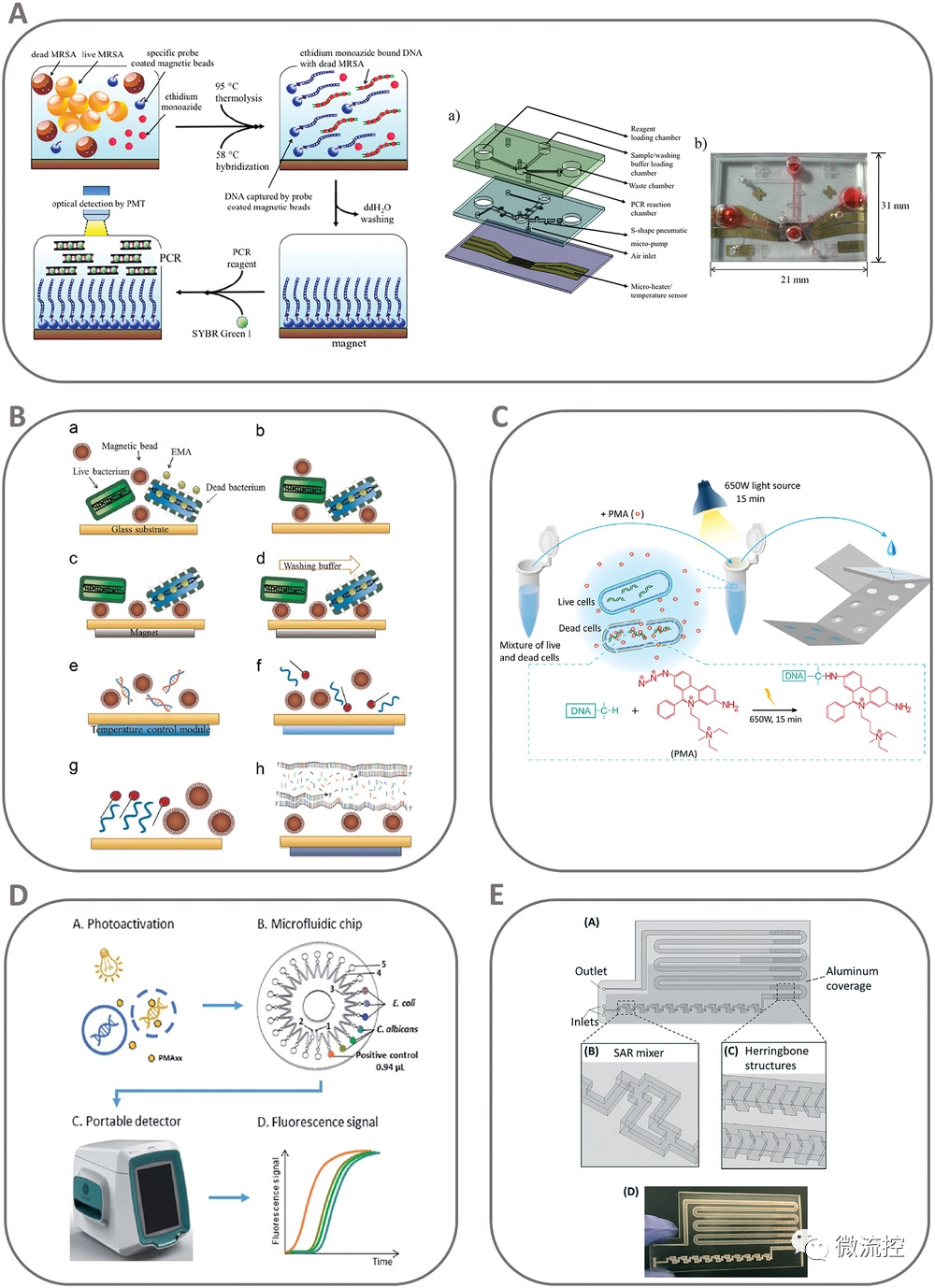
图1 检测活病原体的常规技术
用于检测活微生物的微流控系统
微流控系统可分为两大类:微全分析系统(µTAS)和基于纸张的微流控分析系统(µPADs)。它们的制造方法不同,采样和检测组件也不同。µTAS的概念于1990年首次提出,它是在硅片上建立的集样品预处理、分离和检测于一体的液相色谱仪。µTAS的应用方向主要包括细胞组学、医学诊断和环境监测,也被用于制药的微反应器。µTAS的优点包括使用低样本量和试剂量、降低检测成本和检测时间、简化操作,以及与传统检测相比可以集成更多功能。
近年来,一些微流控阻抗生物传感器已被开发用于检测活的全细菌细胞。最近,Liu等开发了一种阻抗生物传感器,用于检测火鸡食品样品中两种不同血清型的沙门氏菌细胞。该生物传感器由一个玻璃芯片和两个检测区域组成,检测区域由含有固定化抗沙门菌抗体的微间隙叉指电极(IDE)阵列构成,用于阻抗测量,以检测细胞的存在/缺失(图2A)。
该传感器包含两个感应IDE阵列,每一个都有针对特定沙门氏菌血清型的不同抗体。使用注射泵将样品通过抗原入口注入,之后放置半小时,使抗体与沙门氏菌细胞结合,然后进行后续洗涤步骤。随后使用阻抗分析仪测量阻抗并且将其与样品注入前获得的测量结果进行比较。这样,阻抗测量的差异就对应于样品中存在的细胞浓度。
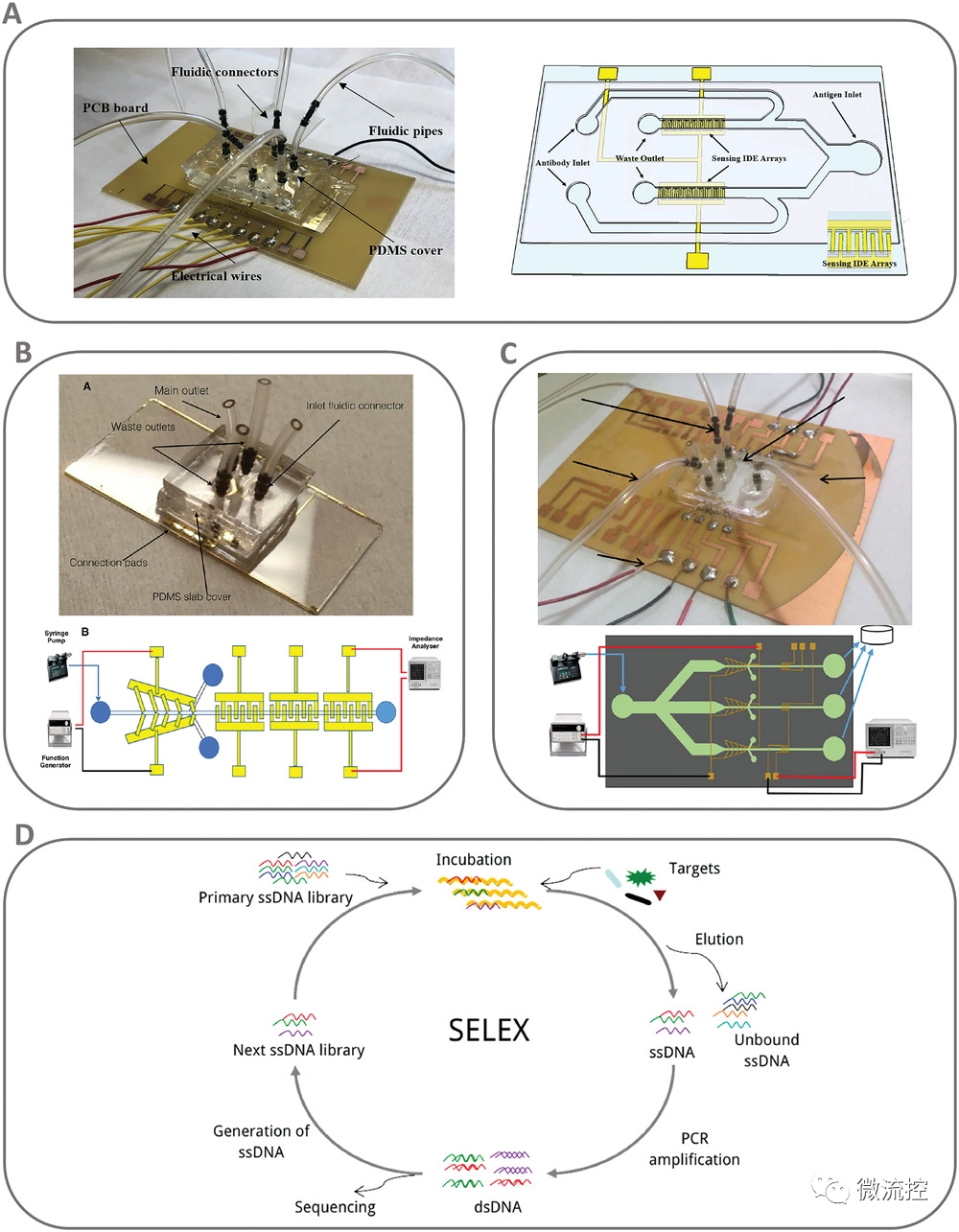
图2 用于检测活微生物的微流控系统
代谢活性与细胞培养
目前,有许多市售检测方法通过比色法、荧光法和生物发光法检测代谢活性或细胞分裂,以确定样品中是否存在活病原体。这些方法需要较长的检测时间和复杂的工作流程。微流控系统可以极大地将检测方案小型化和自动化,这可能是一种改善活细胞检测的有用方法。
ATP是最常用的细胞活力生物标志物之一,然而,将ATP测量纳入微流控系统的工作很少。Lee等人开发了一种用于实时检测气溶胶中ATP的生物传感器。将一个气溶胶冷凝系统耦合到一个硅微流控芯片和一个生物发光传感器中,冷凝过程允许气溶胶样本快速浓缩和水解,然后插入微流控通道,裂解缓冲液和D-荧光素-荧光素酶试剂通过单独的入口被引入。
随后,通过微流控通道将试剂与细菌细胞混合,使游离ATP与D-荧光素-荧光素酶发生反应,并将混合物运输到检测区域,在检测区域使用电路测量生物发光强度(图3)。
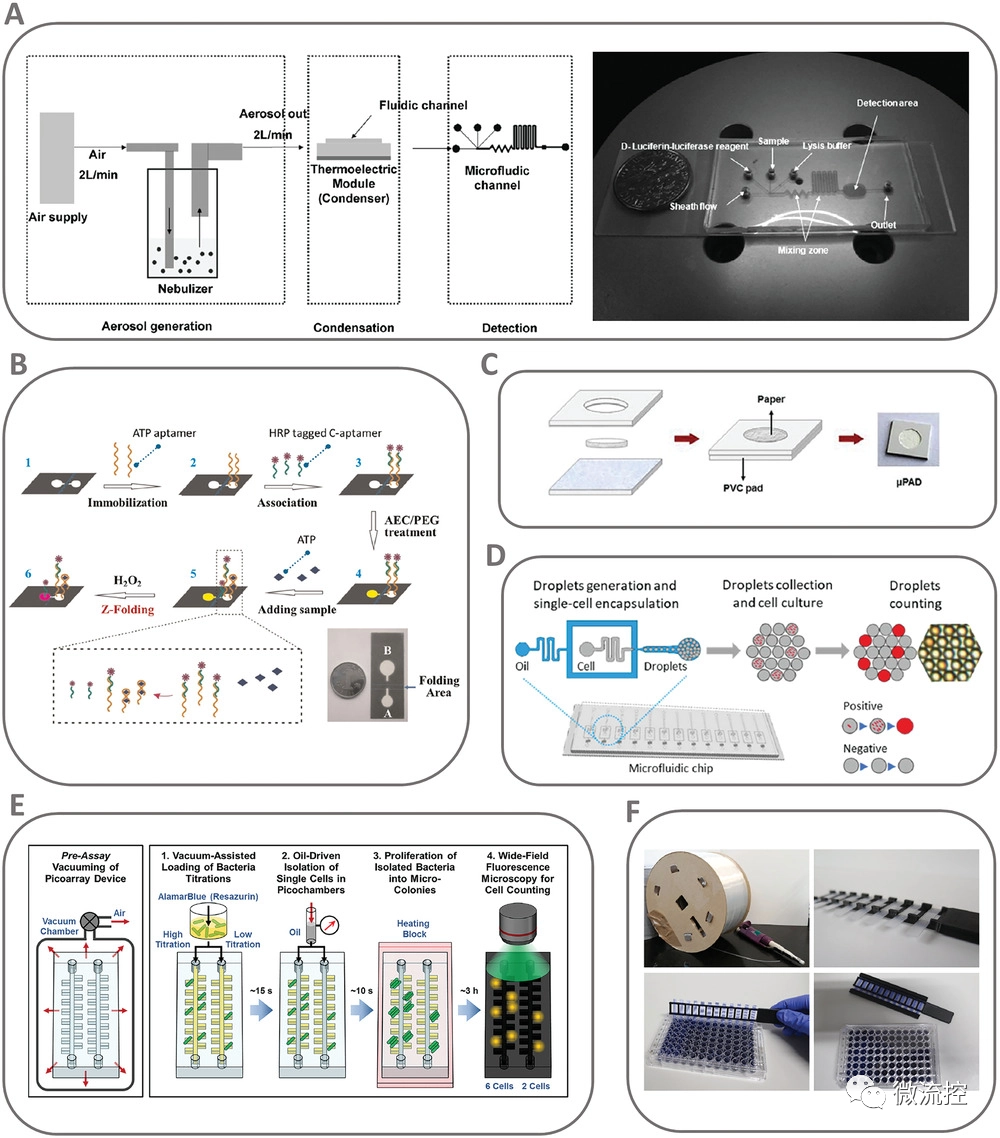
图3 代谢活性与细胞培养
总体而言,在活细胞检测方面,利用微流控系统进行的研究工作还非常有限,主要集中在阻抗传感器、ATP检测和液滴细胞培养等。然而,仍有一些不同的技术,如RNA检测、蛋白质合成、热流监测等,其集成到微流控系统的潜力仍有待探索。随着最近SARS-COV-2的暴发,全球为改善病毒诊断技术而做出的努力迅速增加。使用基于阻抗的微流控系统根据病毒包膜的完整性来区分传染性和非传染性病毒颗粒,是一个需要进一步研究的领域,可能在临床和流行病学研究中有很大用途。
审核编辑:刘清
-
微流控的最新进展2018-07-19 4551
-
流浪宠物疫情监控系统的设计资料分享2022-01-12 984
-
手机变身显微镜 快速处理病原体2009-11-24 746
-
一种新的技术手段通过一口痰液就能快速准确检测出病原体2018-12-03 12883
-
基于石墨烯的传感器可以检测食品中的病原体提高食品安全2019-06-06 1089
-
基于微流控纸芯片的病原体检测方法研究进展2019-04-25 7822
-
生捷科技呼吸道疾病多病原体测序芯片正式对外公布 可实现精确测量新冠病毒2020-03-13 1653
-
美国照明集团正开发一款新型UV LED商用灯泡 可帮助抵抗新型冠状病毒等病毒性病原体2020-04-08 819
-
英国豪迈公司推出新型UVC设备,有助于杀新冠病毒等有害病原体2020-07-21 1202
-
非接触式界面对抗病原体的传播2022-12-30 1013
-
用于快速和现场废水监测的低成本传感器解决方案2023-05-26 687
-
用于微生物病原体即时检测的材料功能化微流控系统研究进展2023-06-15 1802
-
微流控技术在病原微生物检测中的研究进展2024-12-25 1055
全部0条评论

快来发表一下你的评论吧 !

